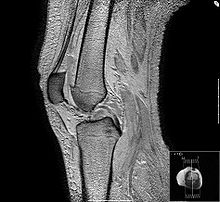
Imagerie par résonance magnétique
L'imagerie par résonance magnétique (IRM) est une technique d'imagerie médicale permettant d'obtenir des vues en deux ou en trois dimensions de l'intérieur du corps de façon non invasive avec une résolution en contraste relativement élevée.
L'IRM repose sur le principe de la résonance magnétique nucléaire (RMN) qui utilise les propriétés quantiques des noyaux atomiques pour la spectroscopie en analyse chimique. L'IRM nécessite un champ magnétique puissant et stable produit par un aimant supraconducteur qui crée une magnétisation des tissus par alignement des moments magnétiques de spin. Des champs magnétiques oscillants plus faibles, dits « radiofréquence », sont alors appliqués de façon à légèrement modifier cet alignement et produire un phénomène de précession qui donne lieu à un signal électromagnétique mesurable. La spécificité de l'IRM consiste à localiser précisément dans l'espace l'origine de ce signal RMN en appliquant des champs magnétiques non uniformes, des « gradients », qui vont induire des fréquences de précession légèrement différentes en fonction de la position des atomes dans ces gradients. Sur ce principe qui a valu à ses inventeurs, Paul Lauterbur et Peter Mansfield le prix Nobel de physiologie ou médecine en 2003, il est alors possible de reconstruire une image en deux dimensions puis en trois dimensions de la composition chimique et donc de la nature des tissus biologiques explorés.
En imagerie médicale, l'IRM est principalement dédiée à l'imagerie du système nerveux central (cerveau et moelle épinière), des muscles, du cœur et des tumeurs. Grâce aux différentes séquences, on peut observer les tissus mous avec des contrastes plus élevés qu'avec la tomodensitométrie ; en revanche, l'IRM ne permet pas l'étude des corticales osseuses (tissus « durs ») trop pauvres en hydrogène, ni donc la recherche fine de fractures où seul l'œdème péri-lésionnel pourra être observé.
L'appareil IRM est parfois désigné sous le nom de « scanner », ce qui en français prête à confusion avec le tomodensitomètre. Contrairement à ce dernier (et à d'autres techniques d'imagerie comme la TEP), l'examen IRM n'est pas invasif et n'irradie pas le sujet. Cela en fait donc un outil de prédilection pour la recherche impliquant la personne humaine, et notamment en neurosciences cognitives. À partir des années 1990, la technique d'IRM fonctionnelle, qui permet de mesurer l'activité des différentes zones du cerveau, a en effet permis des progrès importants dans l'étude des fondements neurobiologiques de la pensée.
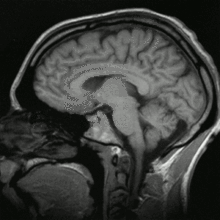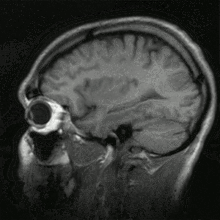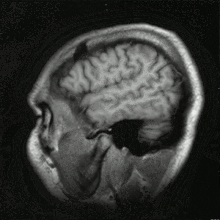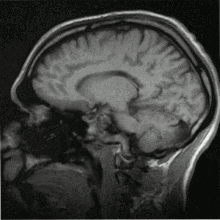
Histoire
Le principe de l'IRM repose sur le phénomène de résonance magnétique nucléaire (RMN), c'est-à-dire portant sur le couplage entre le moment magnétique du noyau des atomes et le champ magnétique externe, décrit par Félix Bloch et Edward Mills Purcell en 1946. Au début des années 1970, les nombreux développements qu'a connus la RMN, notamment en spectroscopie, laissent entrevoir de nouvelles applications de cette technique. Ainsi, Raymond Vahan Damadian propose dès 1969 d'utiliser la RMN dans un but médical et appuie sa proposition avec la démonstration que la spectroscopie RMN permet la détection de tumeurs.
En 1973, un progrès important est accompli : s'inspirant des méthodes de reconstruction d'images utilisées en tomodensitométrie, Paul Lauterbur réalise pour la première fois une « imagerie » (qu'il baptise Zeugmatographie) basée sur la RMN en utilisant le principe des gradients qui permettent de capturer l'image d'une « coupe virtuelle » d'un objet en deux dimensions. Simultanément mais de façon indépendante, Peter Mansfield propose une méthode similaire et introduit en 1977 la technique d'imagerie échoplanaire permettant la capture de nombreuses images en un temps relativement court. Le premier objet connu du grand public à avoir été étudié par IRM est un poivron, après un essai sur deux tubes capillaires.
Dans les années qui suivent, la technique évolue rapidement notamment grâce aux progrès réalisés en informatique et en électronique qui permettent de mettre en œuvre des méthodes numériques coûteuses en temps de calcul. Ainsi en 1975, Richard R. Ernst propose d'utiliser la transformée de Fourier pour analyser le codage en fréquence et en phase du signal IRM.
Les premières images de tissus humains seront produites en 1975 par Mansfield ; en 1977 sera réalisée la première image d'un corps humain vivant par Damadian qui dirigera ensuite la fabrication des premiers appareils commerciaux.
La principale innovation dans le domaine de l'IRM viendra avec la reprise par Seiji Ogawa des travaux de Linus Pauling et Charles Coryell sur le magnétisme de l'hémoglobine. En effet, le signal IRM émis par le sang oxygéné diffère du signal du sang désoxygéné. Cette propriété permit donc à Ogawa, John Belliveau et Pierre Bandettini de réaliser en 1992 les premières images du cerveau en fonctionnement : en réponse à des stimulations visuelles, ils purent mesurer une augmentation du débit sanguin cérébral dans les aires visuelles du lobe occipital. La mesure de cette réponse hémodynamique est à la base du fonctionnement de l'imagerie par résonance magnétique fonctionnelle, un outil central des neurosciences cognitives contemporaines.
Après plusieurs années d'évolution, l'IRM est donc devenue une technique puissante du domaine de l'imagerie médicale, lequel est sans cesse en développement. En reconnaissance de « leurs découvertes concernant l'imagerie par résonance magnétique », Peter Mansfield et Paul Lauterbur furent récompensés par le Prix Nobel de physiologie ou médecine en 2003.
En France, il y avait 592 appareils au ; le délai d'attente moyen était alors de 32 jours. En 2016, il y avait 839 appareils pour un délai d'attente moyen de 30 jours. En 2017, malgré un accroissement à 906 appareils, le délai d'attente était remonté à 34 jours.
Le centre européen NeuroSpin est en passe de devenir le plus grand centre au monde d'imagerie par résonance magnétique. L'un de ses objectifs est d'élucider le « code neural », autrement dit, comprendre comment l’information est codée dans le cerveau.
Technologie
Tunnel de l'aimant

Il ne concerne que les imageurs fermés, c'est le tunnel dans lequel est introduit le patient. Il a des fonctions de confort (comme l'éclairage et la ventilation) et des moyens de communication entre le personnel soignant et le patient (microphone et haut-parleurs). Son diamètre varie très légèrement en fonction des constructeurs et des modèles mais est approximativement de 60 cm.
Aimant
L'aimant est au cœur du fonctionnement de l'appareil IRM. Son rôle est de produire le champ magnétique principal appelé B0 qui est constant et permanent. L'unité de mesure de l'intensité du champ magnétique est le tesla, dont le symbole est T. Cette valeur fait référence à l'intensité de ce champ principal.
En 2007, dans le domaine de l'imagerie médicale de routine, les intensités du champ magnétique utilisé sont comprises entre 0,1 et 7 teslas, avec des intensités supérieures à 17 teslas pour l'étude de spécimens murins ou autres petits animaux, et jusqu’à 11,7 teslas pour les études précliniques et cliniques sur l'humain.
Remarque : 1,6 T équivaut à 30 000 fois le champ magnétique terrestre.
On distingue selon l'intensité :
- bas champ : < à 0,5 T ;
- moyen champ : entre 0,5 T et 1 T ;
- haut champ : > à 1 T.
Le champ magnétique statique doit être uniforme dans la section du tunnel. La valeur du champ magnétique statique est mesurée et uniformisée par calibration (transducteur à effet Hall) à l'isocentre de l'aimant et doit couvrir toute la longueur de l'antenne de réception. Les tolérances sont extrêmement critiques particulièrement à haut champ et en spectrométrie. Le champ magnétique diminue à mesure que l'on s'éloigne de cet isocentre : on parle alors de champ magnétique résiduel. La répartition des lignes de champ dépend de la puissance du champ magnétique mais également de la présence d'un blindage autour de l'aimant (voir chapitre sur le blindage de champ magnétique).
Les principales qualités pour un aimant sont :
- un champ magnétique d'intensité élevée afin d'améliorer le rapport signal sur bruit ;
- une bonne stabilité temporelle (le champ magnétique doit être le plus permanent possible) ;
- une bonne homogénéité du champ (par exemple : 0,2 partie par million ppm dans une sphère de 36 cm de diamètre ce qui correspond au diamètre moyen d'une antenne émission/réception crânienne : c'est la fenêtre minimale d'homogénéité de champ que doit obtenir le constructeur pour pouvoir vendre son appareil dans la plupart des pays).
Ces qualités sont recherchées parmi les trois types d'aimants disponibles sur le marché : l'aimant permanent, l'aimant résistif et l'aimant supraconducteur. Aujourd'hui c'est l'aimant supraconducteur qui est le plus répandu.
L'augmentation des champs magnétiques permet une amélioration importante de la qualité des images obtenues par IRM mais certaines personnes s'interrogent sur l'influence de champ magnétique de grande intensité sur le corps humain. Toutefois rien, en 2007, ne met en évidence un quelconque effet néfaste sur l'organisme si ce n'est quelques « vertiges » dus à l'induction de faibles courants électriques dans certaines structures nerveuses par les impulsions de radiofréquence. Dans tous les cas, même à champ faible, la présence d'objets ferromagnétiques constitue une contre-indication à l'IRM.
Aimant permanent
Il est constitué d'une structure ferromagnétique qui produit un champ magnétique permanent sans consommation d'énergie. Ces aimants, autrefois très lourds (jusqu'à 90 tonnes avec les ferrites), se sont allégés avec l'arrivée des alliages à base de terre rares (Bore-néodyme-fer). Un aimant aux terres rares de 0,3 T corps entier ne pèse que 10 tonnes. Un 0,4 T pèse 13 tonnes. Bien que l'on puisse faire des aimants permanents de 1 T, il est économiquement difficile d'aller beaucoup plus haut que 0,4 tesla. Leurs avantages principaux sont l'absence de courant de Foucault, une fiabilité exceptionnelle, une architecture ouverte et un champ vertical perpendiculaire au grand axe du patient, ce qui améliore les performances des antennes. Les systèmes IRM réalisés autour d'aimants permanents ont longtemps fait l'objet de développements limités. Ce n'est plus le cas. Depuis quelques années, ces systèmes se sont hissés à de très bons niveaux de performances. Plus de 8 000 systèmes ont été installés dans le monde entier en majorité aux États-Unis et au Japon, de plus en plus en Europe et plus lentement en France. Ils sont devenus moins coûteux, très fiables et efficaces, et la Haute Autorité de santé en France en a reconnu l'intérêt dans un rapport de et en préconise l'utilisation en France. Ils constituent également le meilleur choix pour les pays ne possédant pas l'infrastructure technique et logistique permettant de faire fonctionner un système supraconducteur dans de bonnes conditions.
L’utilisation d'un aimant permanent n'est pas sans danger ou problème car ce qui en fait la qualité (la grande stabilité et uniformité de son très puissant champ magnétique) en fait aussi le défaut puisqu'il sera impossible de suspendre le champ magnétique en cas d'urgence (on ne pourra pas appliquer la procédure de quench évoquée ci-dessous dans la section sur les aimants supraconducteurs). L'utilisation de l'appareil se fait donc avec des précautions préalable strictes (y compris par un examen radiographique classique préalable pour détecter des corps métalliques implantés dans des corps mous tels que les vaisseaux sanguins, ou résiduels de certains accidents). Cela nécessite également une surveillance du local d'examen contre la présence ou l'introduction de matériels ferromagnétiques susceptibles d'être projetés contre l'appareil, ou de causer des blessures graves. De plus, avec le temps, des poussières ferromagnétiques peuvent s'accumuler sur l'aimant et y persister, ce qui va progressivement en altérer l'uniformité du champ créé. L'environnement de l'appareil doit donc être tenu très propre, y compris l'air ambiant qui doit être filtré contre la présence de fumées polluantes, puisque le nettoyage de l'aimant sera très difficile ou nécessitera la reconformation du champ magnétique par adjonction d'écrans ou d'aimants complémentaires de correction. L’autre difficulté réside dans le transport et la livraison de l'aimant jusqu'au lieu où il sera déployé, les aimants de cette puissance faisant l'objet de mesures de sécurité spécifiques qui leur interdit par exemple le transport par avion si leur champ ne peut être totalement confiné dans l’emballage ou sa structure de protection et de pose dans l’appareil.
Aimant résistif
Cet aimant est constitué d'un bobinage de cuivre traversé par un courant électrique produisant un champ magnétique en son centre. Ce type d'aimant est assez peu utilisé depuis l'apparition des aimants supraconducteurs.
Il est assez peu coûteux à la fabrication et ne nécessite pas de liquide cryogénique de refroidissement (contrairement aux aimants supraconducteurs). De plus, le champ magnétique peut être annulé en quelques secondes en stoppant le courant (mais il faut attendre la stabilisation du champ lors de la remise sous tension).
Malheureusement, le champ magnétique maximum atteint à peine 0,5 T et reste très sensible aux variations de température. De plus, on constate des problèmes d'homogénéité du champ et une consommation électrique très importante pour alimenter la bobine en courant et pour alimenter les compresseurs du circuit de refroidissement afin de compenser l'effet Joule provoqué par la résistivité de la bobine.
Aimant supraconducteur
En 2008[réf. souhaitée], c'est le type d'aimant le plus répandu. L'aimant supraconducteur utilise le principe de supraconductivité : lorsque certains métaux ou alliages sont soumis à des températures proches du zéro absolu, ils perdent leur résistivité si bien que le passage d'un courant électrique se fait sans perte, donc sans production de chaleur.
L'aimant supraconducteur utilisé en IRM est constitué d'un bobinage de niobium-titane (Nb-Ti) baigné constamment dans de l'hélium liquide (près de −269 °C) qui en assure l'état supraconducteur. La résistance électrique nulle ainsi atteinte permet de créer des intensités de champ magnétique très élevées. La bobine est encastrée dans une matrice en cuivre qui sert de puits de chaleur afin de la protéger en cas de perte accidentelle de la supraconductivité (le quench).
Enfin, le système est entouré d'un écran refroidisseur (circuit d'air ou d'eau glacée) qui aide à maintenir l'hélium liquide à très basse température. Le tout est finalement enveloppé d'un espace de vide limitant les échanges thermiques avec l'extérieur. L'appareil est donc peu sensible aux variations de température ambiante.
Tout cet appareillage rend les appareils à aimant supraconducteur très coûteux à l'achat mais aussi à l'utilisation, du fait de leur consommation importante en hélium cryogénique. La supraconductivité permet néanmoins une consommation électrique moyenne ou faible : si elle n'est pas négligeable lors de la mise en courant des bobinages, elle devient ensuite quasi nulle une fois le régime permanent stable établi.
Les bobinages supraconducteurs étant parcourus par des courants beaucoup plus élevés, ils emmagasinent sous forme magnétique une énergie beaucoup plus élevée. Elle devient même considérable pour les bobines de grandes dimensions à 3 T ou plus. Ces équipements sont alors dotés d'équipements sophistiqués et fiables pour pouvoir la dissiper en toute sécurité en cas de quench.
Géométrie de l'aimant
Il existe deux types d'IRM (en pratique, on appelle IRM la technique comme l'appareil ou imageur) : l'IRM à champ fermé et l'IRM à champ ouvert.
Champ fermé
L'IRM « fermée » est la configuration la plus répandue et la plus connue à l'heure actuelle. Il s'agit d'un tunnel de 60 cm de diamètre pour 2 mètres de long pour les plus anciens et 1,60 mètre de long pour les plus récents.
De nouveaux systèmes sont apparus récemment, utilisant des tunnels plus larges jusqu'à 75 cm de diamètre. Ces systèmes parfois très abusivement qualifiés de « systèmes ouverts » restent des systèmes fermés, bien que leur capacité à accueillir des personnes obèses soit améliorée.
Champ ouvert
L'IRM « ouverte » est apparue après l'IRM fermée. Très peu répandue à ses débuts, la technologie des IRM ouvertes s'améliorant, on leur trouve des avantages dans la médecine humaine notamment pour les personnes qui ne pouvaient pas bénéficier de ce type d'imagerie en espace clos pour des raisons pratiques ou pour éviter une anesthésie générale. On compte parmi ces personnes :
- les individus obèses dont le diamètre de l'abdomen ou l'envergure des épaules dépasse le diamètre interne du tunnel ;
- les individus claustrophobes ;
- les enfants ne pouvant pas rester seuls plusieurs minutes dans l'IRM sans bouger ;
- les femmes enceintes.
Une application récente des modèles ouverts est l'IRM interventionnelle.
Toutefois, les capacités d'intensité de champ magnétique offertes par ce type d'IRM restent habituellement inférieures (0,3 à 0,4 T pour les aimants permanents[réf. souhaitée]) aux conformations fermées. Cependant, il existe actuellement plusieurs systèmes ouverts utilisant une technologie à supraconducteur, ayant des champs à 1 T et 1,2 T. Ces systèmes haut champ ouverts sont plus difficiles à fabriquer et donc plus chers.
Bobines de gradient de champ magnétique
Il s'agit de trois bobines métalliques enfermées dans un cylindre en fibres de verre et placées autour du tunnel de l'aimant. On les nomme respectivement : bobine X, bobine Y et bobine Z.
Le passage d'un courant électrique dans ces bobines crée des variations d'intensité du champ magnétique dans le tunnel, de façon linéaire dans le temps et dans l'espace. En fonction de sa géométrie, chaque bobine fait varier le champ magnétique selon un axe spécifique :
- la bobine X selon l'axe droite-gauche ;
- la bobine Y selon l'axe avant-arrière ;
- la bobine Z selon l'axe haut-bas.
Elles permettent notamment de sélectionner une épaisseur et un plan de « tranche » ou coupe (transversal, frontal, sagittal ou oblique) et de déterminer la localisation spatiale des signaux dans ce plan.
En sélectionnant une de ces bobines, on peut faire varier ces paramètres :
- la pente ou intensité : elle est de l'ordre de quelques dizaines de milliteslas par mètre (mT/m) et varie selon les imageurs ; son rôle est de contrôler l'épaisseur de chaque coupe ;
- le rapport de montée en puissance : elle correspond à la pente maximale atteinte par mètre et par milliseconde ; son rôle est la gestion de la rapidité d'acquisition ;
- Remarque : les commutations rapides de champ magnétique par les bobines de gradients produisent des courants de Foucault, eux-mêmes à l'origine de petits champs magnétiques.
Correcteurs de champ magnétique
Les correcteurs de champ magnétique ou shim sont des dispositifs qui servent à compenser les défauts d'inhomogénéité du champ magnétique principal B0 qui peuvent résulter de facteurs liés à l'environnement ou tout simplement de la présence du patient dans le tunnel.
Les correcteurs de champ sont disposés le long de l'aimant. Il en existe deux types pouvant être présents tous les deux dans une même machine.
Shim passif
Ce sont des plaques ferromagnétiques. Elles permettent un réglage grossier du champ magnétique, dans le cas d'un environnement perturbateur stable.
Shim actif
Ce sont des bobines résistives ou supraconductrices, dans lesquelles passe un courant électrique. Les shims actifs permettent un réglage fin et dynamique, lors de la présence de structures mobiles proches de l'imageur ou du patient dans le tunnel. Ils effectuent une compensation automatique à chaque fois que le champ magnétique devient hétérogène.
- Remarque : L'homogénéité du champ magnétique est vérifiée à chaque maintenance du système. Les bobines de shim sont alors calibrées finement (on parle de shimming) par un technicien ou ingénieur spécialisé.
Antennes
Ce sont des bobinages de cuivre, de formes variables, qui entourent le patient ou la partie du corps à explorer. Le principe de mesure est le même que pour les capteurs inductifs, à savoir la mesure d'une tension induite par la variation du flux.
Elles sont capables de produire et/ou capter le signal de radiofréquence (R.F.). Elles sont accordées pour correspondre à la fréquence de résonance de précession des protons qui se trouvent dans le champ magnétique :
= Fréquence de précession
= Rapport gyromagnétique
= Intensité du champ magnétique principal
Ce qui donne dans le cas du noyau de l'hydrogène (proton) :
- pour un champ de 0,5 T : onde R.F. de 21,3 MHz ;
- pour un champ de 1 T : onde R.F. de 42,6 MHz ;
- pour un champ de 1,5 T : onde R.F. de 63,9 MHz.
Les antennes sont très variables et peuvent être catégorisées de trois manières différentes :
- selon leur géométrie : volumique et surfacique ;
- selon leur mode de fonctionnement : émettrice-réceptrice ou réceptrice seule (on parle aussi de réceptrice pure) ;
- selon l'association ou non de différents éléments d'antennes : linéaire, en quadrature de phase ou en réseau phasé.
Le terme « antenne » est cependant critiqué par certains scientifiques, considérant que le signal détecté en IRM ne résulte pas d'une émission cohérente spontanée d'ondes électromagnétiques par les tissus, mais d'un phénomène d'induction en champ proche.
Antennes volumiques
Une antenne volumique est une antenne au centre de laquelle est positionné le segment à examiner. Elle est :
- soit émettrice-réceptrice : c'est un cylindre de bobinage métallique qui émet un signal R.F. approprié (sous la forme d'impulsions régulières) vers des protons de la région à explorer ; ceux-ci entrent alors en résonance ; puis l'antenne reçoit la réponse de ces protons, au moment de la restitution de l'énergie ;
- soit réceptrice simple : elle est constituée de plusieurs antennes réceptrices plates montées en réseau phasé autour d'une structure cylindrique ; c'est, dans ce cas, une autre antenne (l'antenne dite Corps ou Body intégrée à l'appareil lui-même) qui s'occupe de l'émission du signal R.F.
- Remarque : L'émission et la réception du signal se font de façon homogène dans tout le volume entouré par l'antenne.
Exemples d'antennes volumiques :
- L'antenne corps : il s'agit d'une antenne émettrice-réceptrice, elle est située autour du tunnel de l'aimant (non visible sur une installation en utilisation mais il est possible de la visualiser au cours des maintenances). Son diamètre est à peu près de 65 cm. Elle permet l'étude de régions anatomiques étendues (allant jusqu’à 50 cm de long).
- L'antenne tête : il s'agit d'une antenne émettrice-réceptrice ou réceptrice simple. Il s'agit d'une antenne modulaire de diamètre de 25 à 30 cm qui est adaptée à l'exploration de l'encéphale mais peut également être utilisée pour l'exploration comparative des extrémités chez l'adulte (main, poignet, pied et cheville) ou de l'abdomen des jeunes enfants.
- L'antenne genou : il s'agit d'une antenne émettrice-réceptrice ou réceptrice simple. Il s'agit d'une antenne modulaire de 22 cm de diamètre (peut varier). Elle est adaptée à l'exploration du genou, mais aussi du pied et de la cheville.
On peut aussi citer : l'antenne poignet, l'antenne épaule, l'antenne jambes…
Antennes surfaciques
Une antenne surfacique est une antenne plane positionnée au contact de la région à explorer. Elle est réceptrice simple et ne peut donc que recevoir le signal restitué par les protons, c'est l'antenne corps qui émet l'impulsion R.F. initiale.
En tant qu'antenne linéaire (utilisée seule), elle ne permet l'examen que de petits champs d'exploration. C'est pour cette raison qu'elle est souvent couplée à d'autres antennes surfaciques (en quadrature de phase ou en réseau phasé).
Elle procure un très bon rapport signal sur bruit dans la région d'intérêt à condition de son bon positionnement (le plus proche possible de la zone d'exploration).
Associations d'antennes
Comme nous l'avons vu précédemment, les antennes peuvent être utilisées seules ou en association afin d'avoir un rendu optimum et permettre le diagnostic :
- L'antenne linéaire : c'est une antenne surfacique utilisée seule et placée parallèlement au champ magnétique B0. Il y a donc réception du signal émis par le patient, uniquement lorsque ce signal passe devant l'antenne.
- L'antenne en quadrature de phase : c'est un ensemble de deux antennes surfaciques disposées autour d'une même région mais dans des plans différents. Chaque antenne reçoit un signal de la même région mais à des moments différents. Les deux signaux se regroupent alors sur un même canal de traitement pour former l'image finale. Ce principe augmente le rapport signal sur bruit et par conséquent la qualité de l'image. On peut aussi utiliser ce gain de signal pour diminuer le temps d'acquisition pour une qualité d'image, cette fois-ci, inchangée. Il est évident que les coûts d'achat de ce type d'antenne est bien plus élevé que pour une antenne linéaire.
- Les antennes en réseau phasé : c'est un ensemble de plusieurs antennes de surface de petit diamètre, disposées côte à côte. Chaque antenne possède son propre canal de réception du signal et produit l'image de la région anatomique en regard de laquelle elle se trouve. Les différentes images sont ensuite combinées par des algorithmes informatiques pour former l'image terminale. Ce principe procure un très haut rapport signal sur bruit et permet un large champs d'exploration (jusqu’à 48 cm), mais est bien plus onéreux que les deux autres types d'antennes précédemment décrites.
- Remarque: il existe des antennes dites « HDE » (haute densité d'éléments) ce sont des antennes qui contiennent plus de deux bobines appelées « éléments d'antenne » qui peuvent être comme des petites antennes élémentaires. Cependant les antennes HDE sont très onéreuses (pour l'exemple une « antenne-genou » 8 éléments coûte près de 25 000 €).
Blindages
En IRM, on parle de blindages pour certains dispositifs destinés au confinement des champs magnétiques produits par la machine et à l'isolement de celui-ci des champs magnétiques extérieurs qui viendraient perturber l'acquisition.
Il existe deux blindages dans une installation IRM :
Blindage des ondes de radiofréquence
Il est assuré par la cage de Faraday constituée d'un maillage de cuivre qui recouvre presque* toutes les parois de la salle de l'aimant et étanche aux ondes R.F. Cependant cette « cage » n'est visible qu'au niveau de la vitre de contrôle (aspect sombre du verre) et le cadre de la porte (de petites lamelles de cuivre), les plaques de cuivre étant cachées dans les murs, le plafond et le sol :
- elle empêche les ondes R.F. produites par le système de sortir de la salle de l'aimant ;
- elle empêche les ondes R.F. extérieures (produites par tout appareil électronique et objet métallique en mouvement) d'entrer dans la salle d'examen.
- (*) Dans toutes les salles IRM il existe ce que l'on appelle un panneau de pénétration, c'est un lieu de passages du circuit de refroidissement et des câbles transportant les informations entre la salle de l'aimant et le local technique, celui-ci fait un trou dans la cage de Faraday. Cependant ce passage est spécialement conçu pour ne laisser passer aucune onde R.F.
En outre, il existe un autre type de cage de Faraday. Miniaturisée, elle n'est utilisée que rarement pour certaines acquisitions notamment l'exploration des membres inférieurs, et ce, afin d'éviter l'artéfact de repliement (Aliasing) du membre controlatéral. Ce dernier est entouré par une petite cage de Faraday et ne peut donc répondre aux impulsions de radiofréquences. De nouvelles parades technologiques et des solutions d'anti-repliements rendent son utilisation très sporadique.
Blindage de champ magnétique
Il a pour rôle de rapprocher les lignes de champ au plus près de l'aimant et notamment de faire rentrer la ligne de 0,5 mT dans la salle d'examen.
- Remarque: on parle de la « ligne des 0,5 mT » ou « des 5 gauss ». C'est la limite au-delà de laquelle il y a dysfonctionnement ou dérèglement d'un pacemaker
Il existe deux types de blindages de champ magnétique selon les appareils :
- un blindage passif : c'est un ensemble de poutrelles d'acier ou de fer doux, entourant l'aimant. Ce dispositif est très lourd ;
- un blindage actif : c'est un bobinage métallique inversé placé aux deux extrémités du bobinage de champ principal B0. Au passage du courant électrique dans les spires inversées, il se produit un contre-champ magnétique dont les lignes de champ viennent s'opposer à celles de B0.
Le périmètre du champ magnétique est appelé champ magnétique résiduel. La taille du champ magnétique résiduel dépend de la puissance du champ magnétique et du fait que le système soit blindé ou non. Pour un IRM de 1,5 T non blindé, un champ supérieur à 0,5 mT s'étend jusqu’à près de 12 mètres de l'isocentre et de 9,5 mètres de part et d'autre de l'aimant (la cage de Faraday n'a aucune action de blindage contre le champ magnétique) ; avec blindage ce champ est réduit à 4 mètres de l'isocentre et 2,5 mètres de part et d'autre de l'aimant.
- Remarque : En raison du contre-champ du blindage actif, le champ magnétique est plus intense à l'entrée du tunnel et sous les capots qu'au centre de l'appareil (les intensités peuvent être presque doublées). Cette propriété peut être cause de vertiges et de sensations de fourmillement à l'entrée du tunnel lors de l'émission des ondes de radiofréquence, dues à de petits courants de Foucault induits dans certaines structures nerveuses. Il est important de respecter les consignes de sécurité et ne pas former de « boucle » avec les membres ce qui augmenterait l'intensité de ces courants et pourrait provoquer des brûlures ou/et de plus grands étourdissements.
Quench
Le Quench se définit par un passage brutal de l'hélium liquide à l'état gazeux volatil qui s'échappe alors de la cuve.
La raison accidentelle principale de ce phénomène est un défaut dans le système d'isolation thermique dû à la présence de micropores dans les joints, voire un non contrôle du niveau d'hélium et du bouclier thermique d'azote liquide (c'est la cause accidentelle la plus fréquente du « quench »).
Il y a un réchauffement de l'hélium liquide qui passe alors à l'état gazeux, avec un risque de voir l'évaporation s'accélérer avec la diminution du pourcentage d'hélium liquide présent en cuve.
- Remarque : Ce dysfonctionnement peut avoir des origines très diverses : panne dans le circuit d'eau glacée due à un dépôt important de calcaire, défaillance dans les compresseurs provoquant l'arrêt de la tête froide, ou une augmentation de pression dans l'aimant…
Le quench peut être aussi provoqué volontairement par le personnel de santé : en effet la propriété supraconductrice des IRM modernes fait que le champ magnétique principal reste même s'il n'y a plus d'apport de courant dans la bobine. Tout changement de la valeur du champ statique doit être opéré avec une procédure très stricte et toute variation rapide du champ statique engendre des courants de Foucault importants. Ceux-ci réchauffent les cuves de l'aimant et augmentent considérablement la consommation d'hélium, ceci peut conduire à un phénomène d'emballement qui évapore la masse d'hélium existant et conduit au « quench » et surtout au réchauffement du filament supraconducteur qui peut être détruit et brûlé.
Ainsi pour stopper le champ magnétique, il faut attendre plusieurs heures (voire journées) pour que la très faible résistance de la bobine diminue l'intensité du champ magnétique. En cas de danger immédiat pour une personne se trouvant dans la salle d'examen — par exemple, un individu coincé entre l'aimant et un gros objet ferromagnétique (brancard, bonbonne d'oxygène, cireuse…), il y a un risque de fracture voire d'asphyxie pour celui-ci et la puissante force d'attraction empêche de dégager la personne sans porter atteinte à son intégrité physique — on déclenche alors le quench :
L'hélium liquide passe à l'état gazeux, la bobine principale se réchauffe avec perte de la supraconductivité et reprise de la résistivité de la bobine. À terme, il y a remise en place de l'effet Joule (dissipation de l'énergie sous forme de chaleur) et l'intensité du champ magnétique chute progressivement.
L'hélium gazeux produit doit normalement s'échapper vers l'extérieur des locaux grâce à un conduit situé au-dessus de l'aimant. Si cette évacuation ne se fait pas correctement, l'hélium gazeux s'échappe dans la salle d'examen. Il y a alors un risque important d'asphyxie et de brûlure par le froid pour le patient présent dans le tunnel, ainsi qu'un risque de confinement de la salle : impossibilité d'ouvrir la porte de la salle selon son sens d'ouverture.
- Remarque : L'hélium gazeux n'est pas un gaz toxique pour l'organisme. Son inconvénient, dans ce cas, est sa détente du passage liquide à l'état gazeux pour finalement remplacer le dioxygène de l'air. En effet pour 1 litre d'hélium liquide on obtient près de 700 litres d'hélium gazeux ; un véritable problème lorsqu'on sait que la cuve d'un IRM contient (lorsqu'elle est pleine) de 1 650 à 1 800 litres d'hélium liquide.
Lorsqu'un quench se produit, il arrive que la totalité de l'hélium présent en cuve s'échappe. Dans ce cas l'appareil IRM ne peut plus être utilisé dans l'immédiat : il faut refroidir la cuve avant de la remplir à nouveau, puis relancer le champ magnétique jusqu’à atteindre sa complète stabilité. Il faut ensuite recalibrer le shim actif et procéder à des tests sur fantômes. Ces opérations sont très coûteuses en temps et en argent : dans un ordre d'idée, on peut estimer son coût à plus de 40 000 euros sans compter les pertes potentielles dues à l'impossibilité de pratiquer des examens pendant le temps de remise en service qui dure, environ, deux semaines.
Rappels de RMN
La résonance magnétique nucléaire exploite le fait que les noyaux de certains atomes (ou plutôt isotopes atomiques) possèdent un moment magnétique de spin. C'est en particulier le cas de l'atome d'hydrogène 1 que l'on retrouve en grande quantité dans les molécules qui composent les tissus biologiques comme l'eau (H2O) et les molécules organiques. En RMN (tout comme en IRM), on place les atomes que l'on veut étudier dans un champ magnétique constant. On peut alors imaginer les spins des noyaux atomiques comme des toupies tournant sur elles-mêmes autour de leur axe et effectuant un mouvement rapide de précession autour de l’axe du champ magnétique (mouvement appelé précession de Larmor). Cette fréquence de précession est exactement proportionnelle à l’intensité du champ magnétique (qui est de quelques teslas pour les appareils d'IRM actuels). On applique alors à ces atomes une onde électromagnétique à une fréquence bien particulière dite fréquence de résonance ou fréquence de Larmor. En effet, pour que le champ oscillant de l’onde électromagnétique puisse avoir un effet notable sur les spins, il faut que sa fréquence soit ajustée au mouvement de précession de ces spins (phénomène de résonance). La fréquence de Larmor étant différente pour des isotopes atomiques différents (à cause d’un rapport gyromagnétique différent), un choix judicieux de cette fréquence permet de cibler quels atomes on va détecter. En IRM, on utilise principalement les atomes d'hydrogène dont la fréquence de résonance est autour de 42 MHz/T, ce qui correspond à la gamme des ondes radio. En effet, l'atome d'hydrogène qui est constitué d'un seul proton, est très abondant dans les tissus biologiques et en outre, son moment magnétique nucléaire est relativement fort, ce qui fait que la résonance magnétique de l'hydrogène donne lieu à un phénomène de résonance très net et facile à détecter.
Même s'il s'agit en réalité de phénomènes quantiques, on peut se représenter, de façon imagée, que sous l'effet du champ magnétique statique, les moments magnétiques de spin vont progressivement s'aligner dans une direction initialement parallèle à celui-ci et donner lieu à une aimantation globale dans la direction du champ 



Lorsque l'on applique l'onde magnétique radiofréquence oscillante à la fréquence de Larmor, on va entraîner les moments magnétiques qui vont alors s'écarter progressivement de l'axe 

L'onde magnétique oscillante, notée 


Lorsqu'on interrompt le champ oscillant, les moments magnétiques qui se sont écartés de leur axe initial vont revenir vers la direction 
Relaxation longitudinale (T1)
Au fur et à mesure que les moments magnétiques retrouvent la direction du champ statique 


En notant 


Ce phénomène de relaxation (c'est-à-dire de retour à l'équilibre) suit donc une dynamique exponentielle, il faudrait alors un temps infini pour que tous les spins se retrouvent alignés, c'est pourquoi on définit comme temps T1 le temps mis pour retrouver 63 % de l'aimantation longitudinale à l'équilibre.
Ce temps de relaxation T1 dépend de l'agitation moléculaire dans le tissu que l'on observe. Il suit une courbe en U inversé : si l'agitation moléculaire est très faible, les atomes d'hydrogène mettront du temps à revenir à l'équilibre (c'est le cas des tissus durs comme les os). Si l'agitation des molécules d'eau est très forte, comme c'est le cas dans les liquides comme le liquide céphalorachidien, la repousse est aussi lente. En revanche, si l'agitation est modérée (c'est-à-dire avec une constante de temps autour de la fréquence de Larmor) comme dans la graisse ou dans la substance blanche, alors le temps T1 est relativement court. Ces différents T1 tournent autour de 1 seconde pour un champ 
Relaxation transversale (T2)
Par ailleurs, l'agitation moléculaire contribue aussi à un autre phénomène :
alors qu'en théorie les moments magnétiques devraient tous tourner de façon cohérente autour de l'axe 
Ce temps T2 mesure la disparition de l'aimantation transversale, c'est-à-dire de l'aimantation résultant du fait que les moments magnétiques sont synchrones dans leur rotation dans le plan transversal, perpendiculaire à 


Inhomogénéités de champ (T2*)
Dans un système idéalisé, tous les noyaux précessent à la même fréquence. Cependant, dans les systèmes réels, les inhomogénéités du champ magnétique principal conduisent à une dispersion des fréquences de résonance autour de la valeur théorique (effet d' off-resonance). Au cours du temps, ces irrégularités accentuent le déphasage de l'aimantation transversale et la perte de signal.
La relaxation transversale observée est donc décrite par un temps T2*, généralement beaucoup plus petit que le T2 « vrai » :

où T2' décrit la perte de signal résultant exclusivement des inhomogénéités du champ magnétique principal. Pour les molécules statiques, cette décohérence est réversible et le signal peut être récupéré en effectuant une expérience d'écho de spin.
Codage spatial grâce aux gradients
La localisation spatiale des atomes est obtenue en ajoutant un gradient directionnel sur le champ magnétique de base (
La résolution spatiale est liée à l'intensité du champ magnétique (de nos jours, en 2006, les appareils utilisent un champ de 1 à 3 teslas) et de la durée de l'acquisition (en général une dizaine de minutes). On atteint actuellement une résolution de l'ordre du millimètre.
Pondérations
En modifiant les paramètres d'acquisition IRM, notamment le temps de répétition entre deux excitations et le temps d'écho, temps entre le signal d'excitation et la réception de l'écho, l'utilisateur peut modifier la pondération de l'image, c’est-à-dire faire apparaître les différences de temps T1 et de temps T2 des différents tissus d'un organisme. Les tissus ayant des temps T1 et T2 différents en fonction de leur richesse en atome d'hydrogène et en fonction du milieu dans lequel ces derniers évoluent, peuvent renvoyer des signaux différents si l'on arrive à mettre en évidence ces différences de temps. Pour cela, on teste la réponse des atomes après des excitations particulières.
Des tissus différents ont des T1 différents. Après stimulation de radiofréquence avec un temps de répétition court, on ne laisse pas le temps aux atomes d'hydrogène de certains tissus de revenir en position d'équilibre alors que, pour d'autres atomes d'hydrogène d'autres tissus, le temps est suffisamment long pour qu'il y ait un retour à l'équilibre. Lorsque l'on mesure l'état d'énergie des atomes des tissus, on note des écarts d'état entre ces différents atomes. Si on laissait un temps trop long, tous les atomes auraient le temps de revenir en position d'équilibre et l'on ne noterait plus de différences entre différents tissus.
Des tissus différents ont des T2 différents. Après stimulation par un temps d'écho long, on retrouve des décroissances d'énergie d'amplitude plus importante entre les tissus. Les différences de T2 étant plus discriminants si le temps d'écho est long.
Pondération T1
Les paramètres de la pondération :
- temps d'écho : TE = 10 à 20 ms (ms = millisecondes)
- temps de répétition : TR = 400 à 600 ms
En utilisant un temps de répétition court et un temps d'écho court (neutralise les différences de temps T2), on obtient un contraste d'image pondérée en T1, pondération dite « anatomique » : en pondération T1 sur le cerveau, la substance blanche apparaît plus claire que la substance grise. Le liquide céphalorachidien, situé entre la substance grise et l'os apparaît lui nettement plus foncé.
Ces séquences sont également utilisées après injection de produit de contraste, pour caractériser une anomalie.
Pondération T2
Les paramètres de la pondération :
- temps d'écho : TE > 80 ms
- temps de répétition : TR > 2 000 ms
En utilisant un temps de répétition long (neutralise les différences de temps T1) et un temps d'écho long, on obtient un contraste d'image dite pondérée en T2, dite aussi pondération « tissulaire » : L'eau et l'œdème apparaissent en hyper signal.
Densité protonique
Les paramètres de la pondération :
- temps d'écho : TE = 10 à 20 ms
- temps de répétition : TR > 2 000 ms
En utilisant un temps de répétition long (2 000 ms à 3 000 ms) et un temps d'écho court (inférieur à 30 ms), on obtient un contraste d'image de pseudo densité protonique (Tissus > liquide > graisse). Seul les éléments tissulaires à faible densité protonique, comme les ménisques, seront en hyposignal par rapport aux liquides libres témoins d'une pathologie articulaire sous-jacente. En utilisant un temps de répétition plus long (5 000 ms) et un temps d'écho court (inférieur à 30 ms), on obtient un contraste d'image de vraie densité protonique (Liquide>Tissus>graisse).
Séquences
Écho de spin
Séquence SE classique
La séquence IRM la plus classique est sans doute la séquence écho de spin. Cette dernière se décompose en :
- une impulsion 90° dite d'excitation.
- une période de déphasage dans le plan transverse des protons pendant TE/2.
- une impulsion 180°, dite d'inversion.
- un rephasage pendant TE/2.
- la lecture du signal (lecture de l'écho de spin).
Cette séquence permet les pondérations T1, T2 et de densité protonique. Elle n'est plus utilisée car le temps d'acquisition est beaucoup trop long car il faut compter environ 50 minutes pour l'acquisition d'une coupe sur une matrice de 256².
Séquence TSE/FSE rapide
TSE pour Turbo Spin Echo et FSE pour Fast Spin Echo (le nom de la séquence dépend des constructeurs mais le principe est identique).
La technique associe la méthode écho de gradient et écho de spin pour une acquisition plus rapide mais plus sensible aux artefacts.
Le principe de ces techniques reste basé sur un angle d'impulsion radiofréquence (généralement 40°) appelé angle de Ernst intermédiaire entre la séquence SE et IR avec des temps de répétitions plus courts (300 ms) , cette technique appliquée à haut champ permet d'éviter certains artefacts dus aux spins mobiles.
Inversion-Récupération
Séquence IRT1 ou FLAIRT1 ou TRUET1
On envoie une impulsion à 180°, puis on attend un délai T pendant lequel ML (proportionnel à l'intensité longitudinale) a augmenté. Après T, on envoie une impulsion à 90°, qui provoque un basculement de ML, on obtient ainsi un courant mesurable et donc un signal lié à T1.
Séquence STIR
(= Short Tau Inversion Recovery)
Les séquences STIR ont pour but d'annuler le signal de la graisse.
Séquence FLAIR ou FLAIR T2
Il s'agit d'une séquence en inversion-récupération pondérée T2 sur laquelle on a « supprimé » le signal de l'eau libre (et donc du liquide céphalorachidien), qui apparaît alors en hyposignal, en adaptant le temps d'inversion. Cette séquence est très utilisée dans l'exploration cérébrale (notamment du cortex et des parois ventriculaires), l'œdème, la nécrose ou encore la gliose.
Écho de gradient
Gradient de diffusion
Les techniques de gradient de diffusion consistent à mesurer le mouvement brownien des molécules d'eau dans les tissus. Cela permet d'en déduire des informations sur les inhomogénéités des tissus et notamment de la substance blanche du tissu nerveux. Pour ce faire, les mesures de la diffusion sont effectuées sur un plus ou moins grand nombre de directions (de 6 à plus d'une centaine) qui permettent de calculer des tenseurs de diffusion dans chaque voxel. À partir de là, il est possible de définir la direction moyenne des fibres qui passent dans chacun des voxels et de reconstruire la trajectoire des principaux faisceaux de fibres grâce à des algorithmes de tractographie déterministes ou probabilistes. Cette direction moyenne est donnée par la direction propre associée à la plus grande valeur propre du tenseur de diffusion. Le plus souvent, les algorithmes déterministes interpolent les directions de chaque voxel contigu en fonction du degré d'anisotropie (mesuré par la fraction d'anisotropie) et de l'angle formé par deux directions moyennes de voxels jouxtants.
Saturation des graisses (ou fatsat)
La Fat Sat est une technique permettant de supprimer le signal de la graisse en IRM.
C'est une méthode qui utilise la légère différence de fréquence de résonance des protons des atomes d'hydrogène présents dans la graisse par rapport à ceux de la molécule d'eau. Cette différence est d'environ 220 Hz(à 1,5 Tesla). On envoie donc une radiofréquence dirigée spécifiquement sur la fréquence de la graisse afin de la saturer avant de recueillir le signal de la coupe.
Avantages :
- méthode utilisable en pondération tant T1 que T2 ;
- permet de mieux mettre en évidence les prises de produit de contraste en pondération T1.
Inconvénients :
- Très sensible aux inhomogénéités de champ, la différence de fréquence de résonance étant très ténue, si le champ magnétique a une valeur trop variable, la Fat Sat ne fonctionnera pas bien. Ce problème se pose souvent en cas de corps étrangers métalliques trop proches ou même en cas d'homogénéité limitée de l'aimant.
Artefacts
L'IRM, comme toutes les autres techniques d'imagerie médicale, n'échappe pas à la constitution de fausses images : les artéfacts.
Les artéfacts sont des images observables qui n'ont, pour la plupart, pas à proprement parler de réalité anatomique. Ils peuvent être évités ou minimisés en modifiant certains paramètres d'acquisitions ou de reconstructions. Cependant certains d'entre eux sont utiles pour le diagnostic.
Artefacts de mouvement
L’artefact de mouvement est un des artefacts les plus fréquemment rencontrés. Comme son nom l'indique, il se constitue lorsqu'il y a translation dans l'espace du segment étudié au cours de l'acquisition. Il y a deux types de mouvements rencontrés :
- les mouvements périodiques : Ce sont les mouvements de la respiration, les battements cardiaques et les flux sanguins ;
- les mouvements apériodiques : Ce sont les mouvements du patient, les mouvements oculaires, la déglutition, le péristaltisme digestif et le flux du liquide cérébrospinal.
Ils ont pour conséquence la dispersion du signal : image floue de la structure en mouvement.
Mais aussi (en particulier pour les mouvements périodiques) des erreurs de localisation du signal : des images « fantômes » ou ghosting ; en effet lorsqu'il y a mouvement au cours de différents codages de phase, plusieurs valeurs de codage et donc plusieurs localisations seront attribuées à un même proton.
Ces erreurs de localisations ne sont visibles que dans le sens de la phase car entre deux échantillonnages de codage de phase il peut se passer quelques secondes au cours desquelles un mouvement a lieu. En revanche entre deux échantillonnages de codage de fréquence seules quelques millisecondes se passent, un mouvement d'amplitude significative durant ce laps de temps très court est donc peu probable.
Cette propriété est importante car elle permet de modifier les paramètres en fonction de la zone d'intérêt diagnostic de l'examen. Par exemple : Lorsque le rachis est étudié en coupes axiales, le codage de phase peut être paramétré en droite-gauche afin d'éviter que le ghosting du flux sanguin de l'aorte ne vienne se projeter dessus. Les techniques de présaturations permettent de saturer les spins mobiles et d'éviter leurs artefacts sur l'acquisition d'image statique (cf respiration abdominale ou passage de gros troncs vasculaires ou du LCR dans la région spinale surtout à partir de 1.5 Tesla)) dans la zone d'examen.
Artefacts de champ magnétique
Artefact de susceptibilité magnétique métallique
Artefact de susceptibilité magnétique
Artefact d'hétérogénéité globale du champ magnétique principal
Artefact de non linéarité d'un gradient de champ magnétique
Artefacts d'impulsions de radiofréquence
Les antennes émettrices, qui excitent les protons du tissu à imager, possèdent un profil d'excitation limité dans l'espace. Le signal reçu est donc inhomogène, et les zones les plus proches de l'antenne apparaîtront en hyper-signal.
Artefact d'impulsions de radiofréquence croisées
Artefact de croisement de coupe
Artefact d'interférences aux radiofréquences extérieures
Cet artefact est dû aux interférences des radiofréquences émises par des appareils extérieurs : GSM, 3G, radio, etc.
Artefact d'hétérogénéité des impulsions de radiofréquence
Artefacts de reconstruction d'image
Ce sont les artefacts liés au problème de numérisation du signal (échantillonnage). Ainsi, si un pixel intersecte plusieurs objets, son niveau de gris sera une combinaison des niveaux de gris issus de chacun des objets traversés.
Artefact de déplacement chimique
Artefact de repliement
Afin de générer une image 2D, l'IRM impose une phase et une fréquence de résonance aux spins (voir plus haut) qui dépend de leur position. Nous savons que la phase est 2pi périodique, ainsi les zones de l'espace codées avec une phase de 2pi+phi et phi se chevaucheront.
Artefact de troncature (phénomène de Gibbs)
Il est lié à des interactions entre les protons et leur environnement, source d’apparition de faux contours.
Applications
Angio-IRM
L'angio-IRM ou ARM est utilisée pour visualiser les artères afin de mettre en évidence des anomalies telles que les sténoses, dissections, fistules, les anévrismes et artérite. Les artères cérébrales, cervicales, rénales, iliaques, pulmonaires et l'aorte sont les artères les mieux étudiées par cette technique.
L'angio-IRM fait appel aux séquences en échos de gradient ultrarapides avec injection de chélates de gadolinium en intra-veineuse. D'autres séquences, comme l'angiographie par temps de vol (TOF-MRA) ou par contraste de phase (PC), permettent aussi de visualiser les fluides en mouvement sans injection de marqueur particulier.
IRM cardiaque
Cholangio-IRM
L'étude des voies biliaires et pancréatiques par l'IRM de manière non invasive est une nouvelle approche des bilans d'imagerie des pathologies hépato-pancréatico-biliaires.
IRM fonctionnelle (IRMf)

La méthode la plus utilisée actuellement est celle basée sur l’aimantation de l’hémoglobine contenue dans les globules rouges du sang. L’hémoglobine se trouve sous deux formes :
- les globules rouges oxygénés par les poumons contiennent de l’oxyhémoglobine (molécule non active en RMN) ;
- les globules rouges désoxygénés par le métabolisme des tissus contiennent de la désoxyhémoglobine (active en RMN car fortement paramagnétique).
En suivant la perturbation du signal de RMN émis par cette molécule, il est donc possible d’observer l’afflux de sang oxygéné, qui chasse le sang désoxygéné. Lorsqu'une zone du cerveau augmente son activité, un afflux de sang oxygéné lui parvient grâce à un mécanisme combinant la dilatation des vaisseaux sanguins à divers autres mécanismes mal élucidés, ce qui répond ainsi à la demande de consommation locale en dioxygène des cellules actives : c'est le signal BOLD. En faisant l’acquisition d’images pondérées T2* à une cadence rapide (environ une image toutes les secondes, voire moins), il est possible de suivre en direct, sous forme de film, les modulations de débit sanguin liées à l’activité cérébrale, par exemple lors d'une tâche cognitive.
IRM paramétrique
Cette méthode consiste à mesurer par IRM des paramètres hémodynamiques ou de perméabilité des vaisseaux capillaires, dont les calculs dérivent d'un modèle mathématique appliqué aux données d'imagerie obtenues dans des conditions particulières. En général il s'agit de séquences dites dynamiques car avec une résolution temporelle élevée, permettant de suivre l'évolution de l'intensité de signal après injection d'un produit de contraste paramagnétique. Cette méthode permet de calculer le flux et le volume sanguin d'un tissu, et la perméabilité des capillaires (microvaisseaux) de ce tissu. Cette méthode semble très prometteuse en cancérologie pour déterminer quand une tumeur est cancéreuse (à préciser).
Imagerie du tenseur de diffusion
L’imagerie du tenseur de diffusion (DTI) est une technique basée sur l'IRM qui permet de visualiser la position, l’orientation et l’anisotropie des faisceaux de matière blanche du cerveau.
Spectroscopie RMN
Il permet l'étude de la présence et concentration de certains métabolites. Son application est encore rare, il demande des IRM de haut-champ (1,5 Tesla minimum et 3 Tesla pour obtenir des pics bien différenciés) et des formations spécifiques pour les radiologues.
Cependant la technique semble très prometteuse notamment en oncologie, par exemple, il permet de faire la différence entre récidive locale et nécrose post-radiothérapique dans un stade précoce avec une précision que, seule, une biopsie (invasive et parfois risquée) peut égaler.
Déroulement de l'examen médical IRM
Un examen IRM anatomique dure en général de 15 à 30 minutes. Un ensemble complet d'examens prend souvent entre une demi-heure et une heure pleine. L'examen est absolument sans douleur. Le patient est allongé sur une table d'examen motorisée. Au cours de l'acquisition, il ne doit pas bouger : la table se déplace automatiquement pour le faire passer dans l'antenne. Les seules gênes à en attendre sont le bruit notable et la sensation d'enfermement (le corps étant dans un tube ouvert) pouvant poser quelques problèmes chez certains claustrophobes. En général, le ou les manipulateurs en électroradiologie médicale restent en contact constant avec le patient.
L'examen IRM se réalise sur un patient en pyjama ; il doit retirer montres, bijoux, ceinture, clés, cartes bancaires, à puce ou magnétique, pièces de monnaie, etc. c'est-à-dire tout élément métallique qui pourrait être attiré par l'aimant. Les accompagnants (parents s'il s'agit d'enfants) doivent également se séparer de ces accessoires pour pénétrer dans la salle de l'appareil d'imagerie.
Indications
L'imagerie par résonance magnétique a l'avantage d'apporter une bonne visualisation de la graisse, de l'eau, donc de l'œdème et de l'inflammation avec une bonne résolution et un bon contraste.
En particulier, l'IRM permet d'imager la fosse sous-tentorielle de l'encéphale, dont l'exploration est difficile en CT-scan à cause d’artefact de durcissement de faisceaux.
Cette imagerie n'est pas adaptée à l'étude des tissus pauvres en protons comme les tendons et le tissu osseux.
Les éléments anatomiques étudiés par l'IRM :
- le cerveau et la moelle épinière :
- diagnostic des maladies neurologiques inflammatoires (sclérose en plaques),
- la fosse postérieure du cerveau est particulièrement bien visible par l'IRM (ce qui n'est pas le cas par le scanner cérébral),
- le rachis : hernie discale et toutes les pathologies disco-somatiques, lésions traumatiques du rachis et de la moelle, la spondylodiscite infectieuse ;
- les viscères digestifs et pelviens ainsi que les muscles ;
- les articulations et les structures adjacentes (hanches, genoux, ménisques, ligaments croisés), notamment chez les sportifs ;
- les processus tumoraux, même osseux ;
- les gros vaisseaux comme l'aorte et ses branches (artères rénales, iliaques), les vaisseaux cérébraux et cervicaux sont étudiés pour le bilan de maladie athéromateuse, des dissections, sténoses (artérite oblitérante des membres inférieurs). L'artère pulmonaire peut être analysée par l'ARM dans le cadre de l'embolie pulmonaire ;
- les malformations artério-veineuses mais aussi les malformations cardiaques congénitales (tétralogie de Fallot, atrésie pulmonaire, transposition des gros vaisseaux) ;
- les arbres hépatobiliaire et pancréaticobiliaire sont étudiés dans certaines pathologies hépatiques (CBP) et pancréatiques (tumeur du pancréas, insuffisance pancréatique exocrine) (cholangio-IRM) ainsi que le système porte (en ARM).
Contre-indications
Les contre-indications au passage d'examen IRM sont :
- la présence de métaux susceptibles de se mobiliser dans le corps :
- clips vasculaires cérébraux surtout chez les patients opérés d'un anévrisme cérébral,
- corps étranger métallique ferromagnétique intra-oculaire ou dont la mobilisation exposerait le patient à des blessures (séquelle d'accident de chasse, accident de meulage…),
- valves cardiaques non compatibles, ce qui est le cas de la valve Starr-Edwards pré 6000. La plupart des valves cardiaques sont compatibles avec l'examen IRM,
- Les clips caves inférieurs, clips de trompe de Fallope ou stents coronaires nécessitent une précaution d'emploi. Les différentes prothèses (hanche, genou) ne sont pas des contre-indications,
- on respectera, malgré une compatibilité avérée, un délai après chirurgie. Celui-ci se situant généralement entre 3 et 6 semaines après la pose du matériel. Ce délai correspond au temps nécessaire pour que les différents tissus de l'organisme adhèrent au matériel et le « stabilisent »,
- en revanche, il n'y a pas de délai postchirurgical après ablation de matériel, mais attention aux agrafes chirurgicales ;
- les dispositifs biomédicaux :
- stimulateur cardiaque et défibrillateur cardiaque non compatibles dont le fonctionnement peut être altéré par le champ magnétique et conduire à des troubles du rythme cardiaque potentiellement mortels. Les modèles les plus récents sont compatibles avec l'IRM mais il faut s'assurer que l'ensemble « stimulateur cardiaque + sondes » le soit. Même dans ce cas, la présence de ce matériel génère de nombreux artéfacts gênant l'imagerie proche du dispositif ;
- pompe à insuline ;
- neurostimulateur ;
- dispositifs transdermiques (patchs). Certains de ces dispositifs possèdent un mince halo métallique de protection dans leurs couches superficielles qui peut être cause de brûlures. C'est le cas par exemple de Nitriderm TTS, Scopoderm TTS et Neupro qui contiennent de l'aluminium ;
- l'état du patient :
- impossibilité de rester allongé (insuffisance cardiaque ou respiratoire avec orthopnée) ;
- impossibilité de rester immobile (patient pusillanime, enfants, troubles psychiatriques). Les examens d'imagerie peuvent le cas échéant être réalisés sous prémédication, voire sous anesthésie générale. Il convient alors d'utiliser le seul matériel d'anesthésie homologué pour entrer dans la salle d'IRM ;
- la claustrophobie, qui peut faire l'objet des mesures citées précédemment ;
- l'allergie au gadolinium ou à son chélateur/ligand ou encore à l'excipient est rare. Cependant, le produit est très toxique en cas d'extravasation (nécrose des tissus). Il n'existe pas d'interaction connue avec d'autres médicaments ;
- insuffisance rénale (uniquement en cas d'injection de produit de contraste) ;
- la grossesse, en dehors d'indication formelle. Il n'a jamais été démontré d'effet délétère des champs magnétiques sur le fœtus. Mais, par précaution, seules les indications mettant en jeu le pronostic vital ou fonctionnel de la mère sont validées. En cas d'injection de gadolinium : il y a un passage lent de la barrière placentaire (constaté uniquement sur spécimen murin) ;
- allaitement : en cas d'injection de gadolinium uniquement : excrétion faible dans le lait maternel (constaté uniquement sur spécimen murin), recommandation de traite et élimination du lait pendant 24 à 48 heures suivant l'injection.
Effets indésirables
Avec les précautions ci-dessus, l'imagerie par résonance magnétique est non invasive (excepté, s'il y a indication, l'injection de produit de contraste) et sans irradiation.
L'effet du haut champ magnétique et du champ oscillant reste discuté. Chez les personnes travaillant en IRM (et donc exposés durablement), il est décrit un goût métallique dans la bouche, des vertiges.
L'examen n'est pas contre-indiqué chez la femme enceinte mais des lésions de l'ADN de certaines cellules de patients soumis à une IRM cardiaque ont été décrits sans que les conséquences en soient claires.
Notes
Références
Voir aussi
Bibliographie
- B. Kastler, D. Vetter, Z. Patay et P. Germain, Comprendre l'IRM Manuel d'auto-apprentissage, 6e édition, 2006. (ISBN 2-294-05110-6) (édition antérieure : 5eédition, 2003 (ISBN 2-294-01411-1))
- (en) Haacke, E Mark, Brown, Robert F, Thompson, Michael et Venkatesan, Ramesh, Magnetic resonance imaging : Physical principles and sequence design, New York, J. Wiley & Sons, (ISBN 0-471-35128-8)
- (en) Lee SC, Kim K, Kim J, Lee S, Han Yi J, Kim SW, Ha KS et Cheong C, « One micrometer resolution NMR microscopy », J. Magn. Reson., vol. 150, no 2, , p. 207–13 (PMID 11384182, DOI 10.1006/jmre.2001.2319, Bibcode 2001JMagR.150..207L)
- (en) P Mansfield, NMR Imaging in Biomedicine : Supplement 2 Advances in Magnetic Resonance, Elsevier, , 364 p. (ISBN 978-0-323-15406-2, lire en ligne)
- (en) Eiichi Fukushima, NMR in Biomedicine : The Physical Basis, Springer Science & Business Media, , 180 p. (ISBN 978-0-88318-609-1, lire en ligne)
- (en) Bernhard Blümich et Winfried Kuhn, Magnetic Resonance Microscopy : Methods and Applications in Materials Science, Agriculture and Biomedicine, Wiley, , 604 p. (ISBN 978-3-527-28403-0)
- (en) Peter Blümer, Spatially Resolved Magnetic Resonance: Methods, Materials, Medicine, Biology, Rheology, Geology, Ecology, Hardware, Wiley-VCH, (ISBN 9783527296378)
- (en) Zhi-Pei Liang et Paul C. Lauterbur, Principles of Magnetic Resonance Imaging : A Signal Processing Perspective, Wiley, , 416 p. (ISBN 978-0-7803-4723-6)
- (en) Franz Schmitt, Michael K. Stehling et Robert Turner, Echo-Planar Imaging : Theory, Technique and Application, Springer Berlin Heidelberg, , 662 p. (ISBN 978-3-540-63194-1)
- (en) Vadim Kuperman, Magnetic Resonance Imaging : Physical Principles and Applications, Academic Press, , 182 p. (ISBN 978-0-08-053570-8, lire en ligne)
- (en) Bernhard Blümich, NMR Imaging of Materials, Clarendon Press, , 541 p. (ISBN 978-0-19-850683-6)
- (en) Jianming Jin, Electromagnetic Analysis and Design in Magnetic Resonance Imaging, CRC Press, , 282 p. (ISBN 978-0-8493-9693-9, lire en ligne)
- (en) Imad Akil Farhat, P. S. Belton, Graham Alan Webb et Royal Society of Chemistry (Great Britain), Magnetic Resonance in Food Science : From Molecules to Man, Cambridge, Royal Society of Chemistry, , 227 p. (ISBN 978-0-85404-340-8, lire en ligne)
Articles connexes
- Imagerie cérébrale
- Tomographie d'émission monophotonique (Single Photon Emission Computed Tomography)
- Imagerie moléculaire