Cancer du sein
| Médicament | Éthinylestradiol, fluoxymestérone (en), vinblastine, capécitabine, dexrazoxane, idarubicine, méthotrexate, carboplatine, paclitaxel, mitoxantrone, vinorelbine, trastuzumab, anastrozole, torémifène (en), létrozole, exémestane, épirubicine, docétaxel, tamoxifène, diéthylstilbestrol, irinotécan, cisplatine, estradiol, (RS)-cyclophosphamide, chlorambucil, méthyltestostérone (en), melphalan, sargramostim (en), leuprorelin, fulvestrant (en), doxorubicine, ifosfamide, testolactone (en), 5-Fluorouracile, (RS)-aminoglutéthimide (en), megestrol (en), acétate de goséréline (en), nandrolone, nératinib, tamoxifène, vinorelbine et éribuline |
|---|---|
| Spécialité | Oncologie |
| CISP-2 | X76 |
|---|---|
| CIM-10 | C50 |
| CIM-9 | 174-175,V10.3 |
| OMIM | 114480 |
| DiseasesDB | 1598 |
| MedlinePlus | 000913 |
| eMedicine |
1947145 med/3287 radio/115 plastic/521 |
| MeSH | D001943 |
| Patient UK | Breast-cancer-pro |
Le cancer du sein est un cancer de la glande mammaire. Autrement dit, c'est un cancer qui naît dans les unités cellulaires dont la fonction est de sécréter le lait, les unités ducto-lobulaires du sein, essentiellement chez la femme. Huit cancers du sein sur dix se déclarent après 50 ans.
Premier cancer dans le monde, il touche, en 2016, 1,8 million de femmes par an dans le monde, dont 50 000 femmes en France. On s'attend à ce qu'une femme sur huit reçoive un diagnostic de cancer du sein au cours de sa vie. Le traitement du cancer du sein s'est considérablement amélioré au fil des ans, et a conduit à davantage de cas de rémission.
De 5 à 10 % de ces cancers ont une origine génétique héréditaire ; 85 à 90 % des cas (forme dite sporadique ou non-héréditaire) ont des origines environnementales ou inconnues. Une proportion importante des cancers du sein sporadiques est induite par la prise d'hormones, œstrogènes et la progestérone contenues dans les contraceptifs ou les traitements contre la ménopause. Les facteurs de risque sont également la consommation d'alcool, de sucre, de produits laitiers, de graisses hydrogénées, l'obésité, le manque d'activité physique. Une première grossesse tardive et l'absence d'allaitement favoriseraient aussi ce cancer. Le cancer du sein peut aussi se manifester chez les hommes, mais c'est très rare.
Le traitement fera appel selon les protocoles à la chirurgie, la radiothérapie, la chimiothérapie, la combinaison de ces soins peut se compléter par l'hormonothérapie.
Épidémiologie
Le risque augmente de façon significative avec l'âge entre 30 et 60 ans ; il est ensuite homogène entre 60 et 80 ans ; l'âge moyen du diagnostic est de 61 ans.
Il existe certains facteurs génétiques prédisposants, ainsi que des facteurs hormonaux.
Il est à noter que l'incidence a baissé significativement (d'un peu moins de 9 %) aux États-Unis depuis 2003 et également en France, ce qui correspondrait à une moindre utilisation des traitements hormonaux substitutifs de la ménopause.
En 2002, on a évalué près de 1,1 million de nouveaux cas, avec plus de 400 000 décès dus au cancer du sein. L'incidence semble augmenter régulièrement avec plus de 1,6 million de nouveaux cas en 2010 et 425 000 décès. Près de quatre millions de femmes développent un cancer du sein[source insuffisante]. La fréquence des examens histologiques concluant à un « cancer » du sein dépend surtout de l'intensité du dépistage (voir surdiagnostic). La mortalité décroît sensiblement depuis les années 1990 dans les pays développés. Elle continue à croître dans les autres pays.
Le cancer du sein en France
La France fait partie des pays où l'incidence du cancer du sein est très élevée sur un plan mondial, et où le taux d'incidence de cancer du sein a augmenté le plus vite (+2,4 pour 100 000 femmes par an) sur la période 1980-2005, avec une baisse de ce taux entre 2000 et 2005 (+ 2,1 pour 100 000 femmes par an).
- Le cancer du sein a provoqué environ 11 000 morts chaque année dans les années 2000, la mortalité est stable (11 201 morts en 2005).
- Une femme sur huit est touchée par le cancer du sein en France.
- Il représente plus d'un nouveau cas de cancer sur trois (36,7 % en 2008) sur l'ensemble des nouveaux cancers, chez la femme.
- Dans les années 2000, on diagnostique chaque année environ 50 000 nouveaux cancers du sein.
- En 2005, ce nombre était de 49 814, ce qui correspond à un taux d'incidence parmi les plus élevés d'Europe. Ce taux a augmenté en France de 2,4 % en moyenne par an durant 25 ans (de 1980 à 2005).
- Moins de 10 % des cancers du sein surviennent avant 40 ans, 25 % surviennent avant 50 ans, près de la moitié avant 65 ans.
- Presque 10 % des femmes développent un cancer du sein. 75 % des nouveaux cas dépistés concernent des femmes de plus de 50 ans et ce nombre est en augmentation constante : 35 000 en 1995, 42 000 en 2001.
Ce cancer fait partie de l'un des trois cancers pour lequel la survie a augmenté puisque le taux de survie est passé de 80 % à 87 % au début des années 2000 selon un rapport conjoint de l'Institut de veille sanitaire, le réseau FRANCIM des registres des cancers, l'Institut national du cancer et les Hôpitaux de Lyon.
Le cancer du sein en Asie de l'Est
Le cancer du sein en Chine
Chez les femmes en Chine, le cancer du sein est le plus fréquent et la première cause de décès par cancers. La mortalité par cancer du sein a augmenté au cours des dernières années. Les données des deuxième et troisième Enquêtes nationales par sondage rétrospective des causes de décès en Chine estiment que la mortalité liée au cancer du sein a augmenté entre 1990-1992 et 2004-2005 de 3,84 par 100 000 à 5,09 pour 100 000 habitants. En 2008, environ 169 000 nouveaux cas de cancer du sein ont été diagnostiqués, et il était le type le plus fréquemment diagnostiqué de cancer chez les femmes chinoises. Au cours de cette même année, la mortalité liée au cancer du sein était de 5,7 par 100 000 habitants, ce qui a entraîné environ 44 900 décès.
Le cancer du sein au Japon
Selon une étude publiée en 2009, l'incidence des cancers du sein est historiquement beaucoup plus faible au Japon que dans les pays occidentaux; entre 1998-2002 à Osaka on compte un taux de 32,0 par 100 000 femmes, qui se compare à un taux de 105,6 par 100 000 femmes caucasiennes à Hawaï et 107,5 par 100 000 femmes japonaises à Hawaï. L'auteur note la consommation plus élevée des aliments à base de soja au Japon que dans les pays occidentaux et de ses effets sur les taux de cancer du sein au pays .
Facteurs de risque
Cancers sporadiques (non-familiaux)
5 à 10 % des cancers du sein diagnostiqués sont des cancers du sein à prédispositions génétiques. Les cancers non-familiaux constituent les 90 à 95 % restants. Un tiers de ces derniers, dans les pays occidentaux, pourrait être prévenus par un changement de mode de vie.
Mécanismes possibles
De nombreuses molécules ou cocktails de molécules semblent pouvoir déclencher ou favoriser le cancer du sein ; concernant les mécanismes en cause :
- Une inhibition du système de réponse aux dommages de l'ADN pourrait être en cause dans la moitié des cancers du sein, notamment pour ceux qui sont suscités ou facilités par les hormones utilisées pour les traitements hormonaux de la ménopause.
- Une protéine (Akt1) est sur-exprimée dans 50 % des cancers du sein sporadiques. Elle pourrait donc prédisposer au cancer du sein et/ou être impliquée par d'autres processus (environnementaux et non génétiques). L'activation d’AKT1 entraîne effectivement l'inhibition par séquestration de la protéine BRCA1 dans le cytoplasme ; or, si cette protéine ne peut plus pénétrer et circuler dans le noyau, l'ADN n'est plus réparé (comme en l'absence de gène BRCA1 dans le cas de nombreux cancers héréditaires). AKT1 est aussi activée par les hormones suspectées de causer des cancers du sein (de manière chronique chez les femmes suivant un long traitement hormonal à base d'œstrogènes). Dans ce cas, le gène BRCA1 non muté peut être perturbé, avec comme conséquence un risque accru de cancer du sein.
- De même une autre protéine ; « protéine-kinase CK2 » (enzyme importante pour la plasticité cellulaire épithéliale), semble en cause dans la progression de ces cancers ; l'altération de l'activité de cette protéine s'accompagne d'une transformation de cellules épithéliales en cellules cancéreuses (plus mobiles et source de métastases). Cette protéine semble normalement empêcher le mécanisme cellulaire dit Transition épithélio-mésenchymateuse » (EMT ; processus d'évolution des cellules épithéliales vers un état mésenchymateux et mobilité, accompagné d'une résistance à certains anticancéreux). Cette enzyme associe deux éléments : une « sous-unité catalytique » (CK2α) et d’une « sous-unité régulatrice » (CK2β). Un dysfonctionnement de la sous-unité CK2β, permettant l'EMT semble en cause dans la production de métastases pour ce type de cancer.
Causes hormonales (hyperœstrogénémie)
Le cancer du sein est souvent un cancer hormono-dépendant : les facteurs augmentant le taux d'œstrogènes sont donc à risque. Schématiquement, le risque de cancer du sein croît avec le nombre de cycles menstruels, qu'ils soient artificiels (pilule œstroprogestative) ou naturels.
Le traitement substitutif hormonal de la ménopause augmente sensiblement le risque de survenue d'un cancer du sein.
La ménopause tardive et la puberté précoce agissent par augmentation du nombre de cycles menstruels et donc des taux d'œstrogènes. Les facteurs de puberté précoce sont : l'obésité infantile, l'augmentation de la consommation de protéines animales (viande, lait), de la consommation de boissons sucrées, l'exposition à des perturbateurs endocriniens.
Non-fécondité ou fécondité tardive
Les femmes qui n'ont pas eu d'enfant, ou qui ont eu leur première grossesse tardivement (après 30 ans) ont un risque sensiblement augmenté de développer un cancer du sein, par rapport à celles ayant eu au moins un enfant avant 30 ans. Ce sont en effet les cycles précédant la première grossesse menée à terme qui semblent les plus dangereux pour le sein. La grossesse protège le sein par la modification des cellules mammaires dans le sens d'une plus grande différenciation. Les cellules différenciées sont moins sensibles aux carcinogènes en particulier hormonaux. La grossesse agit donc comme un vaccin vis-à-vis des œstrogènes. Plus cette première grossesse survient tôt, mieux elle agit.
Polluants et autres perturbateurs endocriniens
L'Endocrine Society, dans une déclaration rédigée par des experts internationaux, souligne le parallélisme entre l'augmentation de l'incidence du cancer du sein depuis les cinquante dernières années et la prolifération des perturbateurs endocriniens, produits chimiques de synthèse ayant une action œstrogénique ou cancérogène. Ces produits innombrables (les plus connus étant le DES, le DDT, le bisphénol A et les dioxines), de sources variées (pesticides, produits chimiques industriels, plastiques et plastifiants, carburants et autres produits chimiques omniprésents dans l'environnement), sont une source d'inquiétude importante pour les endocrinologues. Ainsi, les filles ayant été très exposées in utero dans les années 1960 au DDT présentent un quadruplement du risque de cancer du sein selon une étude publiée mi-2015. L'alimentation joue un rôle majeur.
L'Endocrine Society émet une série de recommandations visant à :
- accroître la compréhension des effets des perturbateurs endocriniens (notamment par des recherches fondamentales et des études cliniques) ;
- faire appliquer le principe de précaution ;
- préconiser l'implication individuelle et celle des sociétés savantes pour faire connaître le problème ;
- apporter des changements législatifs.
Liens entre cancer et obésité ou surpoids
Les liens entre cancer et surpoids sont contrastés selon l'âge auquel est acquis ce surpoids. En 2007, une étude a montré l'augmentation du risque de cancer du sein chez les femmes ménopausées en fonction de leur prise de poids. Pour des raisons mal comprises, l'obésité aggrave le risque de cancer du sein, et en particulier de prolifération rapide de ce cancer. Ceci a été démontré in vivo comme in vitro ; ainsi, quand des cellules tumorales (murines ou humaines) sont cocultivées avec des adipocytes matures, ces derniers augmentent les capacités invasives du cancer. De manière générale, l'obésité doublerait le risque de cancer du sein. Par contre, le fait d'être obèse ou en surpoids avant la ménopause diminue le risque de cancer pré-ménopause. Lorsque le surpoids est installé dans la période 18-30 ans, il protège du cancer du sein pré et post-ménopause.
L'obésité, de par l'augmentation de la quantité de tissu graisseux, augmente le taux d'œstrogène sanguin via une activation d'une enzyme appelée aromatase. Celle-ci transforme en effet les hormones de type androgène en œstrogène.
Des adipocytes cultivés avec des cellules cancéreuses présentent un phénotype modifié en termes de délipidation, et une diminution des marqueurs des adipocytes associés à une activé anormale caractérisées par une surexpression des protéases, notamment la métalloprotéinase-11, et des cytokines pro-inflammatoires (interleukine-6 (IL-6) ou IL-1β .
Inversement, les cellules tumorales du cancer du sein modifient les cellules graisseuses (adipocytes) du sein. Ces dernières sécrètent notamment des facteurs pro-inflammatoires dont l'interleukine 6 (qui in vitro suffit à elle seule à rendre métastasiques des cellules cancéreuses). Ceci pourrait expliquer pourquoi l’obésité augmente le risque de métastase et de diffusion rapide de ce cancer. Reste à comprendre les déterminants des dialogues entre cellules cancéreuses et adipocytes, et les tumeurs de plus grande taille et/ou impliquant une contribution des nœuds lymphatiques présentent des niveaux plus élevés d'IL-6 dans la tumeur entourant les adipocytes.
Les adipocytes péritumoraux présentent un phénotype modifié et des caractéristiques biologiques assez spécifiques pour être nommés adipocytes associés au cancer (ou CAA pour Cancer-associated adipocytes).
Acides gras animaux, acides gras saturés et trans
Il a été montré que la consommation de graisses animales ainsi que celle d'acides gras trans (qui rentrent dans la composition de nombreuses préparations de l'industrie alimentaire) étaient des facteurs de risque. Cette relation entre le niveau de matières grasses animales ingérées et le cancer du sein est connue depuis longtemps. L'influence des lipides polyinsaturés est moins évidente.
Une étude (Inserm-Gustave-Roussy, 1995-1998) a prouvé que le risque de cancer du sein augmente de près de 50 % chez les femmes ayant un taux sanguin élevé d’acides gras trans, produits pouvant être présents dans les aliments industriels tels que pains et biscuits industriels, viennoiserie, gâteaux, chips, pâtes à pizza.
Les acides gras saturés augmentent le risque de 9 % pour chaque tranche de 5 % d'énergie supplémentaire fournie par ceux-ci.
Produits laitiers
L'augmentation du risque serait lié à l'augmentation du taux d'IGF-1 dans le sang, elle-même fortement corrélée à la consommation de lait. Il existe, uniquement avant la ménopause, une association attestée entre présence de facteurs de croissance dans le sang et incidence du cancer du sein, sans qu'il soit possible d'établir de lien de causalité. La concentration en IGF-1 varie beaucoup suivant le type de lait (vache,chevre,brebis..), s'il est allégé , ou le mode d'élevage des ruminants (Somatotropine bovine). Cependant, d'autres études établissent plutôt un rôle protecteur lié au contenu du lait en vitamine D et/ou en calcium. Les produits laitiers riches en matières grasses serait très légèrement nocifs tandis que les produits laitiers pauvres en matières grasses serait légèrement bénéfiques.
Consommation d'alcool et de tabac
L'augmentation du risque et de la fréquence du cancer du sein est au moins pour partie liée à l'augmentation de la consommation d'alcool des femmes ;
- De nombreuses études ont montré que la consommation d’alcool (quel qu'il soit ; vin, bière ou alcool fort) augmente le risque de cancer du sein. Ce risque est augmenté en moyenne de 30 % pour trois verres d’alcool par jour. Des méta-analyses ont confirmé le rôle de l'alcool dans la genèse ou la facilitation du cancer du sein. Une étude a estimé que ce risque avait été surestimé, mais elle a été réfutée par une méta-analyse basée sur 98 études cas-témoins et prospectives.
- Le risque croît d’environ 10 % par 10 g d’alcool supplémentaires consommés en moyenne par jour avec des sensibilités génétiques différentes selon les individus, certaines sous-populations exposées à d’autres facteurs de risque cancérigène pouvant aussi y être plus sensibles. D'autres facteurs aggravent en effet ce risque : avoir plus de 50 ans, être en phase post-ménopause, être affecté par une maladie bénigne du sein, une tumeur impliquant des récepteurs aux œstrogènes et/ou des tumeurs avancées/invasives.
- Ce risque double en cas de consommation chronique d'alcool (chez les femmes ayant un indice de masse corporelle normal (IMC < 25), alors que l'obésité est un autre facteur souvent cité).
- Les conséquences de l'alcool comme facteur ou cofacteur cancérogène sur le sein pourraient être assez rapides, car les statistiques montrent que l'impact des consommations récentes est plus significatif que celui des consommations anciennes.
Il existe une corrélation entre le tabagisme et la survenue de ce cancer.
Manque de vitamine D
La vitamine D et ses analogues pharmaceutiques ont des effets anti-prolifération et pro-différenciation. Elle a donc une importance pour la prévention et le traitement des cancers en général. Elle peut notamment limiter une production excessive d'œstrogènes, en agissant sur l'aromatase.
Le cancer du sein est souvent associé à de bas taux de vitamine D (carence ou d'insuffisance dans 78 % des cas selon une étude faite sur 145 patientes). Un excès de mortalité par cancer (incluant le cancer du sein) chez les Afro-Américains est attribué à leur pigmentation cutanée, qui bloque plus de rayons ultraviolets que nécessaire à ces latitudes et entrave la production de vitamine D de façon marquée. Une étude française de l'évolution sur 10 ans de près de 68 000 femmes a confirmé l'importance du lien entre carence en vitamine D et survenue du cancer du sein. L'analyse de l'indice d'exposition au rayons UV chez ces femmes a montré que seules celles qui étaient le plus exposées aux UV obtenaient une protection contre le cancer du sein suffisante pour que l'apport alimentaire ait un impact mesurable ; pour toutes les autres, l'équipe de l'INSERM conclut que, plus on vit au nord, plus il est difficile d'atteindre ce seuil de vitamine D protégeant du cancer du sein.
Mastopathies
C'est un terme peu précis désignant toute maladie du sein. On le réserve en général à des anomalies bénignes qui peuvent prêter à confusion avec une tumeur et pour cela justifient un prélèvement (biopsie) permettant de les identifier précisément. Certaines peuvent favoriser un cancer ultérieur et justifient une surveillance régulière.
Un aspect dense à la mammographie, surtout s'il est étendu, augmenterait très sensiblement le risque de développer un cancer du sein.
Autres
Historiquement, il avait été mis en évidence chez des femmes ayant subi de nombreuses radioscopies à l'époque où la tuberculose était très répandue. Ce risque avait aussi été décelé chez des Japonaises qui avaient été irradiées à des doses non mortelles lors des bombardements atomiques d'Hiroshima et de Nagasaki. Il s'agit essentiellement au début du XXIe siècle des cas de radiothérapie du thorax lors du traitement de certains cancers — lymphome de Hodgkin en particulier — chez la jeune femme chez qui le risque de cancer du sein augmente substantiellement. Certaines nouvelles modalités d'examens radiologiques, telle que le scanner coronaire, peuvent conduire à une irradiation suffisante pour augmenter le risque de cancer du sein des décennies après la réalisation de l'examen.
Le travail de nuit augmente le risque de cancer du sein. Ce risque a été reconnu sur le plan juridique au Danemark et fait objet de compensations financières. Une méta-analyse suggère même une association positive entre l'exposition à une source lumineuse la nuit et le risque de cancer du sein, en particulier chez les femmes préménopausées.
Allaiter agit comme un protecteur vis-à-vis du cancer du sein, notamment par mise en sommeil des ovaires et diminution du nombre de cycles.
L'interruption volontaire de grossesse n'augmente pas le risque de cancer du sein
Dans les pays riches (il n'y a pas eu d'études sur ce point ailleurs), une taille supérieure à la moyenne à la naissance est corrélée avec un risque futur de survenue d'un cancer du sein. Une exposition fœtale à certaines hormones impliquées dans la croissance pourrait être en cause (à confirmer). 5 % des cancers du sein des femmes nées dans les pays développés seraient directement concernés.
Chez les hommes
1 % des cancers du sein est développé par un homme. À stade égal, le pronostic est identique. Néanmoins, la glande mammaire chez l'homme est de très petite taille, le diagnostic est souvent tardif, il y a donc beaucoup plus de cancers détectés à un stade évolué, accompagnés d'une atteinte cutanée ou des plans profonds (T4). Le risque de contracter un cancer du sein est majoré chez les hommes avec un historique familial de cancer du sein, particulièrement lorsqu’on retrouve une mutation des gènes BRCA1 et BRCA2.
Cancers familiaux
5 à 10 % des cancers du sein diagnostiqués sont des cancers du sein à prédispositions génétiques, soit entre 2 000 et 4 000 personnes atteintes chaque année, 550 à 1 000 décédées, en France. En 2008, dix gènes étaient associés à un risque accru de cancer du sein. Neuf sont liés au système de réponse aux dommages de l'ADN. Le dixième code une protéine qui inhibe l’action de l’enzyme AKT1 (enzyme dont l'inhibition joue aussi un rôle dans les cancers non génétiques). Deux de ces dix gènes (dits BRCA1 et BRCA2) sont à eux seuls responsables de la moitié de ces cancers à prédisposition génétique, soit 2,5 à 5 % de tous les cancers du sein.
Caractéristiques
Le plus souvent, ce type de cancer du sein apparaît chez une femme sans problème de santé particulier. Très rarement, la femme est porteuse d'une maladie génétique connue.
Plusieurs signes peuvent faire penser à un cancer du sein à prédisposition génétique :
- Jeune âge (moyenne de 43 ans au lieu de 60 ans dans les formes non transmissibles) ;
- Antécédents familiaux de cancer du sein ;
- Cancers survenant au niveau des deux seins de manière successive ou simultanée ;
- Apparition d'un second cancer au niveau de l'ovaire ;
- Type histologique médullaire du cancer.
Mode de transmission
Il est de type autosomique dominant. Chez une femme, la présence d'une seule mutation du gène expose à un risque de 80 % d'avoir un cancer de sein (au lieu de 10 % en l'absence de mutation).
Le risque couru par les femmes venant d'une famille où existe un gène anormal dépend de si elles en ont hérité ou pas. Si le gène hérité n'est pas anormal, le risque est le même que celui des autres femmes; si le gène est muté, elles auront 70 % à 80 % de probabilité d'avoir le cancer du sein. Le problème est semblable pour les risques de cancer des ovaires ou du côlon. Dans certaines familles, on peut observer ces cancers en ligne directe (grand-mère, mère, fille) ou chez des proches parentes (tante, sœur, cousine germaine). Ces cancers surviennent en règle générale dans la première partie de leur vie.
Un examen génétique peut mettre en évidence ce risque, mais un test de recherche d'un gène muté n'apporte de certitude que s'il est positif (dans ce cas, toutes les parentes devraient faire l'objet d'un suivi). Cet acte très spécialisé ne doit être demandé que pour les familles dont les femmes présentent vraisemblablement une hérédité à risque, mise en évidence par une consultation d'oncogénétique qui établira l'arbre généalogique de cette famille.
Gènes en cause
plusieurs gènes sont identifiés mais les deux principaux sont :
- BRCA1 sur le chromosome 17. Plus de 500 mutations ou variations de séquence ont déjà été décrites.
- BRCA2 sur le chromosome 13. Plus de 100 mutations différentes ont été dénombrées.
Seule une portion de toutes ces mutations accroît le facteur de risque de cancer. Les mutations du BRCA2 (1 femme sur 1460) sont retrouvées plus fréquemment que les mutations du BRCA1 (1 femme sur 1960). Ces mutations entraînent, outre l'excès de risque de cancer du sein, un excès de risque de cancer de l'ovaire.
La probabilité de développer un cancer du sein chez une porteuse d'une mutation de BRCA1 est d'environ 65 % avant l'âge de 70 ans (45 % pour les porteuses d'une mutation sur le BRCA2).
L'évolution des cancers porteurs de mutation sur BRCA1 est encore mal connue : aggravation selon certains, pour d'autres, gravité similaire pour les porteuses de mutations sur BRCA2 ou non-porteuse de mutations.
La prévalence de ces mutations reste faible chez les patientes ayant un cancer du sein (moins de 4 % pour BRCA1, même si elle est double chez les Juives ashkénazes).
Les autres gènes concernés sont le PALB2 qui intervient dans la stabilisation du BRCA2, le ATM, le CHEK2, le RAD51C, le BARD1, ou le TP53.
Conseil génétique
Dans certains pays, toute femme le souhaitant peut bénéficier d'une consultation génétique pour déterminer son risque de cancer héréditaire. Si la probabilité de prédisposition génétique est supérieure à 25 %, on propose à ces patientes un diagnostic moléculaire. Cette recherche moléculaire est particulièrement prédictive si on connaît la mutation chez un parent déjà atteint d'un cancer du sein à prédisposition génétique.
Surveillance des femmes à risque élevé
Les femmes à risque de prédisposition génétique ou porteuses d'une mutation sont suivies par des équipes de surveillance clinique tous les 6 mois dès l'âge de 20 ans et par mammographie annuelle dès l'âge de 30 ans[Où ?]. Parmi les facteurs augmentant le risque, figurent l'existence d'un carcinome canalaire in situ, considéré comme une forme pré-cancéreuse, et le carcinome lobulaire in situ, plus bénin mais pouvant évoluer en cancer dans 20 à 30 % des cas identifiés.
Dépistage
Détecter et traiter les tumeurs quand elles sont très petites (moins d'un centimètre de diamètre) est possible grâce à la mammographie et à un suivi régulier. Cela réduit le risque de mortalité, et permet des traitements moins lourds et moins traumatisants que la chimiothérapie, la chirurgie « mutilante » (ablation). C'est entre 50 et 74 ans que les femmes sont les plus exposées à ce type de cancer. Une mammographie tous les deux ans permet un dépistage efficace, mais qui expose à un risque de surdiagnostic correspondant à un faux positif : la femme est considérée comme porteuse d'un cancer du sein alors qu'elle ne l'est pas, l'exposant ainsi à un traitement non justifié avec tous les effets secondaires et les risques qui s'ensuivent. Le bénéfice de ce dépistage doit donc être soigneusement étayé. Selon une méta-analyse de 2003, une réduction significative de la mortalité en cas de dépistage peut être mise en évidence dans certains cas ; la même méta-analyse fait part toutefois de deux autres études concurrentes présentant une absence de réduction significative. Cette existence d'une réduction des risques est cependant critiquée.
En France, une structure de gestion départementale ou inter-départementale envoie à toutes les femmes de 50 à 75 ans une invitation pour une mammographie gratuite (prise en charge financière à 100 % par la Sécurité sociale) tous les deux ans. L'invitation peut être envoyée sur demande du médecin généraliste, du gynécologue ou de la femme elle-même. La visite doit être faite chez un radiologue accrédité, membre du réseau spécialisé dans le dépistage mis en place au niveau des départements. Cette stratégie repose notamment sur un rapport d'experts élaboré en 2001-2 par le département d'Évaluation des technologies de l'Agence nationale d'évaluation et d'accréditation des soins. L'objectif annoncé de ce rapport incluait le rappel des recommandations françaises en vigueur. Le rapport a conclu que l'inefficacité de la mammographie de dépistage n'étant pas prouvée, il fallait maintenir les recommandations en usage pour le dépistage du cancer du sein.
Une échographie associée à la mammographie peut détecter un plus grand nombre de cancer mais est associée à un nombre plus important de faux positifs (biopsie infirmant le diagnostic du cancer). La place de cet examen dans la stratégie de dépistage reste donc à évaluer.
L'Imagerie par résonance magnétique (IRM) serait également un examen prometteur avec une sensibilité supérieure à celle de la mammographie.
L'autopalpation était une technique de dépistage très en vogue dans les années 1980-1990, encore recommandée, mais n'ayant pas fait la preuve de son efficacité.
L'usage de la thermographie infrarouge, pour la détection, est un examen avec moins d'effet secondaire (pas de radiation), avec une meilleure sensibilité, moins de faux positifs et une détection plus précoce que la mammographie. Le coût de la thermographie serait par ailleurs nettement moins élevé que celui du dépistage par mammographie, dont le budget annuel est de 250 Millions d'Euros. La thermographie n'est cependant, en 2017, quasiment pas utilisée en France. La technique a montré sa simplicité à travers un fait divers.
Au-delà de 75 ans, l'intérêt d'un dépistage systématique n'est pas démontré. Il semble être faible entre 70 et 75 ans. Avant 50 ans, l'intérêt est discutable, sans diminution prouvée de la mortalité.
Surdiagnostic
Avant la ménopause, le dépistage systématique n'a pas fait les preuves de son efficacité car les anomalies suspectes minimes sont fréquentes. Les inconvénients semblent dans ce cas l'emporter sur les avantages, excepté pour les femmes à risques.
Le risque du dépistage systématique est de poser un diagnostic erroné et d'entraîner une prise en charge non justifiée, avec un coût et un risque en conséquence. C'est ce qu'on appelle le surdiagnostic. Dans le cadre du cancer du sein, la mammographie peut entraîner un taux non négligeable de surdiagnostic. Cette proportion pourrait aller de un cas sur dix à un cas sur quatre, voire un cas sur deux. Le rapport entre le nombre de vies sauvées et le nombre de femmes avec un surdiagnostic (reflétant partiellement ce qu'on appelle le rapport bénéfices/risques d'un examen) peut varier ainsi de 1 sur 2 à 1 sur 10.
L'explication de ces sur-diagnostics n'est pas univoque : mauvaise interprétation des documents, cancers d'évolution très lente ou même régression spontanée de certaines tumeurs malignes.
Cependant, selon le département des maladies chroniques de l'Institut français de veille sanitaire, ces analyses devraient à l'avenir permettre de rendre le dépistage encore plus performant avec comme but d'identifier les cancers qui vont évoluer de ceux qui vont rester latents, sans mettre en cause le bénéfice du dépistage lui-même.
Seins denses
Pour les seins denses ou extrêmement denses, une mammographie peut s’avérer inefficace pour pouvoir détecter un cancer. Les études ont mesuré que les mammographies ne trouvent pas les cancers dans près d’un tiers à la moitié des cas de femmes avec des seins denses[réf. souhaitée].
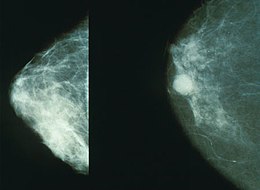
Le tissu dense du sein gêne la capacité de dépister un cancer lors d’une mammographie. Agissant comme un nuage, le tissu dense du sein est blanc et peut masquer un cancer qui apparaît en blanc également.
La densité des seins peut être mesurée par les BI-RADS utilisant un système de notation 1-4. Ce système permet aux radiologues de mesurer et décrire la densité des seins
BI-RADS 1 : Tissu dense du sein <25% BI-RADS 2 : Tissu dense du sein entre 26 et 50% BI-RADS 3 : Tissu dense du sein entre 51 et 75% BI-RADS 4 : Tissu dense du sein >75%
Presque la moitié des femmes aux États-Unis ont des seins denses. Dans certains États, les radiologues ont l’obligation légale de communiquer aux femmes la densité de leurs seins pour leur permettre d’avoir une conversation éclairée, avec leur équipe soignante, sur les analyses supplémentaires dont elles auraient besoin.
Cinq faits sur les tissus denses dans le sein :
- 40 % de femmes ont des seins denses ;
- la densité des seins est l'un des facteurs prédictifs les plus sûrs de l’inefficacité de la mammographie à détecter un cancer existant ;
- la mammographie ne détecte pas un cancer existant dans un tiers à la moitié des cas selon les études, pour les seins denses ;
- la densité du sein et son évolution sont des facteurs prédictifs bien établient du risque du cancer du sein ;
- la densité élevée de sein est un facteur de risque plus élevé que d’avoir deux parents du premier degré avec un cancer du sein.
Une échographie associée à la mammographie peut détecter un plus grand nombre de cancers pour les seins denses et hyper denses. Sur une échographie, certains cancers du sein apparaissent en noir et peuvent donc être détectés. Une échographie du sein n’est pas suffisante par elle-même pour le dépistage du cancer du sein.
Un autre type d’analyse est l'IRM.
Un autre type d’analyse s’est développé, aux États-Unis, pour pallier l’inefficacité des mammographies pour le dépistage du cancer pour les seins denses. La représentation moléculaire de sein (MBI) est un outil de diagnostic secondaire hautement efficace[réf. nécessaire].
Même avec un résultat de mammographie négatif pour les femmes ayant des seins denses (ou qui sont considérées à haut risque pour le cancer du sein), un test supplémentaire de MBI devrait être envisagé.
Une image de MBI représente une analyse fonctionnelle moléculaire active des tissus due à la prise d’un radio-traceur injecté dans les veines. Dans ces images, les tissus sains, denses ou non, apparaissent en noir et les tissus malades apparaissent en blanc, dû à l’absorption plus rapide de rayons gamma contenus dans la prise du radio-traceur.
Diagnostic
Clinique
La palpation du sein est le premier examen à réaliser. En raison de leur situation anatomique, les seins sont faciles à palper, d'autant plus lorsqu'ils sont de volume moyen ou petit. Il est recommandé que les patientes réalisent cet examen elles-mêmes de manière routinière à la fin des règles.
Lors de la palpation, la suspicion se fait à partir de la découverte d'un nodule, que l'on peut détecter par palpation à partir de 1 cm de diamètre environ. L'irrégularité peut ne pas être douloureuse, mais toute anomalie récente doit particulièrement attirer l'attention de la patiente et de son médecin.
Parmi les irrégularités, que la patiente peut surveiller d'elle-même :
- une fossette ou une ride creusant la surface du sein avec un aspect « peau d'orange » ;
- une déformation du mamelon, le rétractant vers l'intérieur ;
- un aspect eczémateux du mamelon qui devient rouge, croûteux ou érodé ;
- un écoulement mamelonnaire, surtout s'il est sanglant ou noirâtre.
La constatation de l'un de ces signes doit amener à une consultation médicale très rapidement. Cependant, seul le médecin pourra juger des examens complémentaires nécessaires, car tous ces signes ne se rencontrent pas seulement dans le cas des cancers. Un nodule peut être de nature bénigne :
- lorsqu'il est de consistance solide, il peut s'agir d'un adénofibrome qui s'est développé dans la glande mammaire. Celui-ci pourrait se développer à cause d'un environnement bactérien spécifique, qui ultérieurement pourrait se transformer ou non, en adénocarcinome.
- lorsqu'il est de nature liquidienne, il peut s'agir d'un kyste.
Mammographie
Le médecin peut décider de faire confirmer son premier diagnostic par une mammographie. L'échographie est un examen complémentaire qui peut aider à localiser l'anomalie pour faciliter un prélèvement ou reconnaître s'il s'agit d'un kyste liquidien, mais elle ne peut jamais remplacer la mammographie. La mammographie, pratiquée régulièrement et dans le cadre des programmes de dépistage, permet de diagnostiquer la maladie à un stade suffisamment précoce pour que le traitement soit le plus conservateur possible et en même temps efficace. En effet tant que la taille de la tumeur est inférieure à 1-2 cm, les chances de guérison sont voisines de 100 %.
Confirmation du diagnostic
Si l'ensemble des examens ne permet toujours pas de s'assurer d'un bon diagnostic et si des doutes persistent, il est alors nécessaire d'envisager un prélèvement réalisé le plus souvent par une grosse aiguille (trocart) sous anesthésie locale sans hospitalisation. Le prélèvement, ou biopsie, est souvent réalisé sous guide d'échographie ou de radiologie ; on parle alors de biopsie échoguidée et biopsie stéréotaxique du sein. Le diagnostic de certitude se fera par l'étude anatomo-pathologique de l'échantillon prélevé.
Bilan d'extension
La recherche de métastases est fondamentale dans la stratégie du traitement du cancer du sein. Mais, malgré les nombreuses études réalisées ou la connaissance approfondie de certaines explorations, il n'existe actuellement aucune stratégie validée de recherche systématique de métastase dans le cancer du sein.
La plupart des recommandations proposent actuellement un bilan d'extension comportant une radiographie thoracique, une échographie hépatique et une scintigraphie osseuse. Pour les tumeurs de très petite taille, ce bilan peut être facultatif. En revanche, pour les tumeurs évoluées (tumeurs inflammatoires, multi-focales, envahissement ganglionnaire important), le risque métastatique initial est élevé et peut justifier un bilan plus poussé comportant une Tomodensitométrie (TDM) corps entier et une IRM mammaire.
La taille de la tumeur, l'existence d'adénopathies métastatiques, l'existence d'une atteinte de la peau ou de la paroi thoracique ou de métastases à distance permettent d'établir une classification clinique des cancers du sein.
| Classification TNM | Description |
|---|---|
| Tx | Tumeur ne pouvant être appréciée par défaut de renseignements |
| T0 | Pas d'évidence de tumeur primitive |
| Tis | Carcinome canalaire in situ ou carcinome lobulaire in situ ou maladie de Paget du mamelon sans tumeur sous-jacente |
|
T1 T1a T1b T1c |
Tumeur inférieure à 2 cm dans sa plus grande dimension - T < 0,5 cm - T entre 0,5 et 1 cm - T entre 1 et 2 cm |
| T2 | Tumeur supérieure à 2 cm et inférieure à 5 cm dans sa plus grande dimension |
| T3 | Tumeur de plus de 5 cm dans sa plus grande dimension |
|
T4 T4a T4b T4c T4d |
Tumeur de toute taille avec extension : - à la paroi thoracique - œdème ou ulcération de la peau ou nodule de perméation - à la peau et à la paroi thoracique Cancer inflammatoire |
Différents types de cancer et carcinome du sein
Classification OMS
L'étude anatomopathologique montre l'existence de différents types de cancer du sein. Selon l'Organisation mondiale de la santé, le tableau ci-dessous montre la classification histologique des cancers du sein utilisée dans tous les centres anticancéreux.
Il existe comme pour toute tumeur épithéliale des cancers in situ. La variété la plus fréquente de cancer du sein est celle du type canalaire.
| Tumeurs épithéliales non infiltrantes |
| Carcinome canalaire in situ (intracanalaire) (CCIS) |
| Carcinome lobulaire in situ (CLIS) |
| Tumeurs épithéliales infiltrantes |
| Carcinome canalaire infiltrant SAI (sans autre indication) |
| Carcinome canalaire infiltrant avec composante intracanalaire prédominante |
| Carcinome lobulaire infiltrant |
| Carcinome mucineux (colloïde) |
| Carcinome médullaire |
| Carcinome papillaire |
| Carcinome tubuleux |
| Carcinome adénoïde kystique |
| Carcinome sécrétant juvénile |
| Carcinome apocrine |
| Carcinome métaplasique de type épidermoïde |
| Carcinome métaplasique de type à cellules fusiformes |
| Carcinome métaplasique de type chondroïde et osseux |
| Carcinome métaplasique de type mixte |
| Maladie de Paget du mamelon |
Cancer inflammatoire
Le cancer inflammatoire du sein est une forme très rare de cancer du sein (1 à 4 %) qui se développe rapidement en quelques jours ou quelques semaines. Il se propage par voie lymphatique rapidement sans avoir le temps de former une tumeur. Le blocage des vaisseaux lymphatiques par les cellules cancéreuses est à l’origine d’une inflammation locale du sein d’importance variée. Le diagnostic d’abcès du sein est souvent évoqué dans un premier temps d’autant que l’imagerie (mammographie et échographie) est souvent négative. Toute persistance d’une rougeur plus ou moins douloureuse du sein impose de faire des biopsies, qui seules affirmeront la maladie. Le traitement repose avant tout sur la chimiothérapie dont les progrès récents autorisent la guérison dans un grand nombre de cas.
Classification histologique et moléculaire
Dans le cadre de la recherche sur les cancers du sein, On distingue principalement quatre types de cancer du sein en fonction de leur morphologie et de la présence de trois marqueurs moléculaire : celle du recepteur aux estrogènes (ER), et de la surexpression du récepteur de la progestérone (PR), et du marqueur HER2, ce dernier étant un récepteur de type EGFR . Les quatre classes résultantes sont :
- basal ou triple négatif : ER-/PR-/HER2- ;
- HER2-surexprimant : ER-/PR-/HER2+ ;
- luminal A : ER+/PR+/HER2- ;
- luminal B : ER+/PR+/HER2+.
Le nom des types basal et luminal provient de la ressemblance des tumeurs aux tissus épithéliaux mammaires normaux correspondants. En général, les cancers de types basal et surexprimant HER2 ont un mauvais pronostic clinique.
Des études basées sur l'utilisation de puces à ADN de manière systématique dans des cohortes de patients ont également pu isoler différentes signatures d'expression génique : ainsi les cancers du sein de type luminal ont tendance à exprimer les gènes et protéines GATA3, KRT19 alors que ceux de type basal à l'inverse n'expriment pas ceux-ci mais entre autres ETS1 et CD44.
Traitements
Comme pour tous les cancers, il repose idéalement (du point de vue médical) sur l'ablation chirurgicale de la tumeur, qui permet dans le même temps d'en faire le diagnostic de certitude. Le problème suivant est de faire le bilan d'extension : présence ou non de ganglions atteints, présence ou absence de métastase.
Cependant, la mutilation mammaire correspond aussi en général pour les femmes à une mutilation psychologique et sociale, les seins étant un des symboles de la féminité parmi les plus forts. Certaines femmes peuvent vivre cette mutilation comme une négation de leur féminité et donc, de leur personnalité.
Il existe aussi d'autres traitements comme la chimiothérapie, la radiothérapie et l'hormonothérapie, qui dans certains cas peuvent être utilisés pour obtenir une diminution de la tumeur en préalable d'une opération chirurgicale. L'efficacité et les risques de chaque type de traitement dépendent du type du cancer, de son extension et du terrain.
Stratégie thérapeutique
De nombreux traitements du cancer du sein existent, mais toujours à individualiser pour un traitement optimal. Ainsi l'analyse génomique des cancers du sein ferait apparaitre une cinquantaine de types différents de cancer du sein, dont chaque type, ou groupe, serait susceptible d'une thérapie ciblée particulière.
Pour le cancer du sein localisé, le traitement a presque toujours un objectif curatif. Il repose sur les quatre armes thérapeutiques que sont la chirurgie, la chimiothérapie, la radiothérapie et l'hormonothérapie. La chirurgie est l'étape indispensable du traitement curatif du cancer du sein, les autres traitements ne visant généralement qu'à réduire le risque de rechute. Ils seront donc indiqués si ce risque est important et si le bénéfice supposé du traitement est suffisant, car tous ces traitements ont des effets secondaires. Le bénéfice attendu doit donc être mis en balance avec le risque de complication.
Pour le cancer du sein métastatique : à ce stade d'évolution, il est très rare de pouvoir proposer un traitement curatif. Mais les traitements modernes permettent souvent de prolonger la survie de plusieurs années. Il est impossible de détailler ici les différentes stratégies thérapeutiques envisageables car celles-ci dépendent de très nombreux facteurs. Le traitement du cancer du sein métastatique repose d'abord sur la chimiothérapie et l'hormonothérapie. Un traitement chirurgical ou par radiothérapie des sites métastatiques peut être envisagé soit dans un but curatif lorsque tous les sites sont accessibles à un traitement (ex. : métastases hépatique ou vertébrale unique) soit dans un but palliatif (ex. : irradiation d'une métastase osseuse douloureuse).
Il existe un certain nombre de marqueurs génétiques qui sont corrélés avec le pronostic du cancer du sein et qui peuvent donc potentiellement orienter le traitement.
Des marqueurs moléculaires de gravité et pronostic du cancer du sein existent aussi. Les métallothionéines (MT) en sont un. Elles se lient facilement à certains métaux et sont codées par au moins 10 gènes MT fonctionnels qui sont associés à la prolifération des cellules du cancer du sein, en particulier cancers invasifs canalaires du sein. Ceci fait des MT un biomarqueur de pronostic pour le cancer du sein détectable par immunohistochimie. Plus les MT sont exprimées dans les cancers du sein plus grave est le cancer.
Certains traitements (alkylants ou tamoxifène) peuvent être inhibés par une surexpression de métallothionéines (par exemple chez un patient qui a été victime d'une intoxication par métaux lourds)
Chirurgie
Ablation de la tumeur

Il existe trois types de chirurgie du sein : la tumorectomie (ablation de la tumeur), la segmentectomie (ablation d'une partie du sein) et la mastectomie (ablation de la totalité du sein).
Dans les cas où la tumeur est prise en charge suffisamment tôt, une chirurgie minime (chirurgie conservatrice) est possible. Parfois, il faut enlever la totalité du sein. Une chirurgie reconstructrice peut être faite dans le même temps ou secondairement.
- Illustration de la chirurgie reconstructrice du sein : récupération d'une partie des muscles de l'abdomen (restus abdominus) pour reconstruire le sein, Institut national du cancer.
Curage axillaire
Cette technique consiste en l'ablation des ganglions se situant dans le creux axillaire (au niveau de l'aisselle). Cette opération a de nombreux effets secondaires du fait que cette ablation déstabilise le réseau lymphatique, pouvant conduire à l'apparition d'un lymphœdème (gros bras). C'est dans le but de diminuer ces effets secondaires que la technique du ganglion sentinelle a été mise en place.
Technique du ganglion sentinelle
Dans une tumeur, le ganglion sentinelle est le premier à recevoir le drainage lymphatique.
Le ganglion sentinelle est identifié grâce à l'injection d'un colorant, accompagné ou non d'un colloïde radioactif. Il est ensuite retiré pour permettre une étude anatomopathologique. Si le ganglion étudié est sain, cette technique permet de ne pas avoir recours à un curage axillaire (retrait de la quasi-totalité des ganglions de la région), ce qui entraînerait des séquelles importantes. Elle peut être appliquée sur des patientes présentant une tumeur faisant moins de 3 centimètres, et concerner jusqu'à 70 % d'entre elles.
Cette technique est validée, avec un taux d'erreur inférieur à 10 %.
Prévention de la douleur post-opératoire
Une diminution du risque de douleurs chroniques post-opératoire peut être obtenue en réalisant une anesthésie loco-régionale au moment de l'acte chirurgical. Trois à douze mois après une opération de cancer du sein, la douleur chronique post-opératoire peut être prévenue chez une personne sur sept (nombre de sujet à traiter). Bien qu'encourageants, ces résultats reposent sur des données de faible niveau de preuve.
Surveillance après opération
Après le traitement initial, il est indispensable que la patiente soit suivie régulièrement.
La multiplication des examens n'est pas nécessaire, mais la mammographie bilatérale annuelle est indispensable, surtout en cas de chirurgie conservatrice. Selon le cas, elle pourra être associée à d'autres examens complémentaires définis en fonction de chaque cas.
Même un cancer du sein traité d'une façon optimale peut récidiver localement ou à distance (métastase). La récidive peut survenir des années après le traitement initial, d'où l'intérêt de maintenir la surveillance.
Radiothérapie
Elle réduit la mortalité de ce cancer, mais exige une technique irréprochable afin de réduire l'irradiation des tissus sains pouvant entraîner une surmortalité par pathologie cardio-vasculaire. On distingue les radiothérapies sur le sein de celles portant sur les aires ganglionnaires. En cas de chirurgie conservatrice, une radiothérapie doit toujours être réalisée car elle diminue significativement le risque de récidive locale. La radiothérapie sera d'autant plus importante que la femme est jeune. En cas d'ablation totale du sein, la radiothérapie est indiquée, dans certains cas, pour diminuer le risque de récidive locale. L'irradiation des chaînes ganglionnaires est fonction de la localisation de la tumeur et du résultat de l'examen anatomo-pathologique des ganglions.
Effets secondaires à long terme
Le risque de mortalité secondaire à la radiothérapie comparé à celui de la mortalité cardiovasculaire ne semble s’accroître que dans la troisième décennie suivant le traitement selon une étude portant sur le suivi de plus de 500 000 femmes.
Une étude européenne sur les risques pour le fœtus dans le cadre d'une radiothérapie ou d'une chimiothérapie pour le traitement du cancer a montré que les fœtus dont la mère aurait été traitée pendant la grossesse ne présenteraient pas plus de malformation cardiaque qu'un enfant non exposé.
Pour identifier les risques de fibrose mammaire induits par la radiothérapie, un test a été développé par l'Inserm pour mesurer le taux d’apoptose radio-induite lymphocytaire (TALRI). Plus le taux de TALRI est élevé et plus le risque de fibrose du sein est faible.
Chimiothérapie
Elle consiste à administrer des médicaments anti-cancéreux, à intervalle fixe, en général toutes les 3 semaines. Le nombre de cures de chimiothérapie adjuvante (chimiothérapie réalisée après la chirurgie) pour le cancer du sein est entre 4 et 6. Les avantages des chimiothérapies adjuvantes par rapport au traitement chirurgical sans chimiothérapie sont une réduction significative de la mortalité et un taux de récidive moindre. En cas d'atteinte ganglionnaire axillaire, le schéma associant 3 cycles de chimiothérapie avec anthracycline (Farmorubicine°) et cyclophosphamide (Endoxan°) puis 3 cycles avec docetaxel (Taxotere°) est actuellement la référence. Pour les cancers sans envahissement ganglionnaire axillaire, la recherche de facteurs de mauvais pronostic pouvant expliquer une évolution défavorable (grade histologique élevé, pas de récepteurs hormonaux, taille tumorale supérieure à 15 voire 10 mm pour certains…) permet de poser également l'indication d'une chimiothérapie adjuvante.
En cas de tumeur avancée ou inflammatoire, il est parfois nécessaire de commencer le traitement par une chimiothérapie (chimiothérapie néo-adjuvante) pour diminuer la taille tumorale et permettre éventuellement une chirurgie conservatrice.
Les chimiothérapies néo-adjuvantes sont aussi pratiquées afin de limiter la taille de l'exérèse : une tumorectomie est parfois suffisante lorsqu'une mastectomie avec chimiothérapie adjuvante était initialement prévue.
Dans cette dernière indication, alors que la mortalité globale, le délai d'aggravation de la maladie et le taux de récidive à distance ne sont pas différents par rapport à la chimiothérapie adjuvante, les récidives loco-régionales seraient plus fréquentes. Il n'existe pas de protocole de chimiothérapie néo-adjuvante de référence actuellement.
Inconvénients : fatigue générale, nausées et vomissements, chute temporaire des cheveux. Ils varient selon les produits utilisés, et sont de mieux en mieux maîtrisés.
Nombre de produits ont fait leur preuve dans le cadre du traitement adjuvant du cancer du sein et ont un protocole de référence, mais d'autres produits arrivent sur le marché et/ou font l'objet d'études.
Thérapies ciblées
Le trastuzumab a bouleversé la prise en charge de nombreuses patientes. D'autres médicaments sont en cours d'évaluation. Ces molécules sont souvent caractérisées par une bonne tolérance, en revanche ce sont des produits particulièrement chers.
Trastuzumab
Certains cancers du sein surexpriment le gène Her2 de façon importante (ceci concerne environ 25 % des cancers mammaires, souvent de mauvais pronostic, puisque Her2 - ou CerbB2 - est le récepteur membranaire permettant d'activer une des voies de la prolifération cellulaire accrue). Les cellules cancéreuses présentent alors une addiction oncogénique, en étant dépendantes pour leur survie du fonctionnement de la voie de signalisation induite par Her2. Celle-ci est inhibée par le trastuzumab (Herceptin°), un anticorps monoclonal bloquant ce récepteur. L'Herceptin a d'abord été utilisée en situation palliative. Dans ce contexte, l'Herceptin a permis, en moyenne de doubler le temps de survie de ces patientes. Ajoutée à la chimiothérapie adjuvante, l'Herceptin° en perfusion tous les 21 jours, pendant 12 mois, réduit de moitié le risque de rechute chez les patientes HER2+ et d'environ un tiers la mortalité.
Depuis novembre 2017, l'Ontruzant, médicament biosimilaire du trastuzumab, est détenteur de la première autorisation de mise sur le marché émise par la Commission européenne, permettant ainsi sa distribution dans l'Union européenne ainsi qu'en Norvège, en Islande et au Liechtenstein.
Bévacizumab
En 2007, le bévacizumab (Avastin) est utilisé dans le cancer du sein métastatique (autorisation de mise sur le marché français en 2007, en première ligne métastatique). C'est un anticorps monoclonal anti VEGF, délivré en perfusion. Il se fixe sélectivement sur ce facteur de croissance et bloque ainsi la néo-angiogénèse. Associé au paclitaxel, ce traitement double le temps de réponse (temps jusqu'à progression de la maladie). En revanche, il n'y a pas d'augmentation du temps de survie.
Cependant, en France, en mai 2011, la Haute Autorité de santé conclut : « Compte tenu du faible gain de survie sans récidive et de l'absence d'amélioration de la survie globale avec l’association bevacizumab/taxane versus taxane, l'intérêt de l’ajout de bevacizumab au paclitaxel est aujourd'hui moins bien établi. Cet intérêt est limité aux patientes négatives aux récepteurs HER2, aux œstrogènes et à la progestérone. »
Lapatinib
Le lapatinib (Tyverb), donné en traitement oral, est un inhibiteur intracellulaire de l'activité de tyrosine kinase des récepteurs HER2 et HER1 (EGFR). Chez les patientes surexprimant HER2, en progression tumorale sous herceptin et ayant déjà reçu des anthracyclines et des taxanes, l'association lapatinib-capécitabine double le temps de réponse par rapport à la capécitabine seule, sans bénéfice sur la survie globale. L'AMM fut obtenue en 2008.
Hormonothérapie
Dans environ deux tiers des cancers du sein, les cellules cancéreuses présentent des récepteurs hormonaux en excès. La tumeur est alors dite hormono sensible car les œstrogènes stimulent la prolifération cancéreuse par l'intermédiaire de ces récepteurs. Dans le cancer du sein les traitements hormonaux agiront soit en diminuant le taux d'œstrogènes dans le sang et donc la stimulation des récepteurs hormonaux (castration, anti-aromatases), soit en bloquant les récepteurs hormonaux (anti-œstrogènes).
Suppression ovarienne
- chirurgicale, par laparotomie ou cœlioscopie
- radique, en réalisant 12 à 16 Gray en 4 à 8 fractions sur un petit pelvis, après avoir repéré la position des ovaires par échographie ;
- médicale, le plus souvent, en utilisant les agonistes de la LH-RH
- Leuproréline, Enantone LP 3,75 mg / 4 sem
- Goséréline, Zoladex 3,6 mg / 4 sem
- Note : Décapeptyl n'a pas l'AMM dans le cancer du sein.
Anti-œstrogènes
-
Tamoxifène 20 mg j−1
- Mécanisme : antagoniste partiel des récepteurs à l'œstradiol
- Précaution : faire examen endomètre 1/an, contrôler fonction hépatique et triglycérides, doser œstradiol plasmatique et ajouter LHRH si augmenté, contraception efficace (tératogène).
-
Fulvestrant 250 mg IM tous les 28 jours
- Mécanisme : antagoniste des récepteurs à l'œstrogène sans action agoniste partiel.
L'utilisation du tamoxifène est bénéfique s'il existe des récepteurs aux œstrogènes au niveau de la tumeur quel que soit l'âge de la patiente. La durée optimale d’application de l’hormonothérapie adjuvante par tamoxifène est de 5 ans à la dose de 20 mg j−1. L'utilisation du tamoxifène réduit le risque de récidive de 8 % et celui de décès de 5 %.
Anti-aromatases
Depuis 2004, des nouvelles molécules peuvent être proposées aux femmes ménopausées. Ce sont les inhibiteurs de l'aromatase. Les deux molécules les plus évaluées sont l'anastrozole et le létrozole. Leur profil de toxicité est différent du tamoxifène. L'administration de ces deux molécules permet de réduire les rechutes après chirurgie du cancer du sein, sans bénéfice quant à la survie globale (versus tamoxifène).
-
Létrozole, Femara 2,5 mg j−1
- Mécanisme : inhibiteur de l'aromatase non stéroïdienne
- Précaution : densité osseuse, dyslipidémie
-
Anastrozole, Arimidex 1 mg
- Mécanisme : Inhibiteurs de l'aromatase non stéroïdienne
- Précaution : densité osseuse, dyslipidémie
-
Exémestane, Aromasine 25 mg
- Mécanisme : inhibiteur de l'aromatase stéroïdien
- Précaution : densité osseuse, dyslipidémie
Alimentation
L'association d'un traitement classique avec la consommation de deux portions par jour de fruits et légumes riches en vitamine C réduit la mortalité toutes causes confondues de 14%, celle de légumes riches en bêta-carotène de 20%. Deux portions par semaine de myrtilles réduisent le risque de mortalité de 17%, la consommation de fraise la diminue de 16%, cinq portions de légumes par jour de 16% avec un effet particulièrement important des crucifères et des légumes verts feuillus; tandis que la consommation de 2 portions par jour de jus de fruit (sauf de jus d'orange) augmente la mortalité de 20%, le mais et les pois l'augmente de 10% également. Dans une autre étude, le taux sanguin de caroténoïdes, issu de l'alimentation, est associé à une moindre récurrence. Un régime riches en fibres et pauvres en graisses diminuent probablement la mortalité globale. L'obésité augmente la mortalité et le risque de contracter un deuxième cancer.
Un apport élevé en isoflavones est associé à une mortalité plus faible uniquement pour les femmes atteintes de cancers ER−, PR−, ou celles qui ne reçoivent pas d'hormonothérapie dans le cadre de leur traitement. Cependant, des échantillons plus grands, des évaluations plus précises de l'apport en isoflavones de soja (et de l'apport total en phytoœstrogènes), un meilleur contrôle des facteurs de confusion et des suivis plus longs sont nécessaires pour pouvoir conclure définitivement.
Les femmes diagnostiquées à un stade précoce ayant des apports alimentaires plus élevés en acide eicosapentaénoïque (EPA) et acide docosahexaénoïque (DHA) ont un risque de récidive du cancer du sein et de mortalité toutes causes confondues réduit d'environ 30 %, en comparant le tiers supérieur et le tiers inférieur.
Supplémentation
La supplémentation en vitamine D diminue la récurrence des cancers oestrogènes-dépendants (ER+). La supplémentation en vitamines A, C ou E n'a pas d'effet prouvé.
Prévention : facteurs protecteurs
Les facteurs de risque ont un dénominateur commun : l'augmentation de l'imprégnation hormonale des femmes : directe, pour les traitements hormonaux de la ménopause, la pilule œstroprogestatives, l'augmentation du nombre de cycles menstruels (faible nombre de grossesses ou des courtes durées d’allaitement), ou indirecte via l'augmentation de l'activité de l'enzyme aromatase dans la graisse, pour l'alcool, le surpoids, le manque d'activité physique.[Interprétation personnelle ?] Il est possible de jouer sur certains de ces facteurs pour une prévention primaire du cancer du sein.
Perte de poids après la ménopause
L'obésité et le surpoids apparaissant après la ménopause accroissent le risque de cancer du sein. Selon une étude américaine menée en 2006, une perte de poids post-ménopause semble efficace pour annuler ce risque. Le professeur Pierre Kerbrat (centre Eugène-Marquis, Rennes) estimait en 2008 que la lutte contre l'obésité féminine permettrait d'éviter 13 000 nouveaux cas de cancer du sein par an dans l'Union européenne.
Exercice physique
L'activité physique, qui aide à préserver de façon générale des cancers, montre aussi ses effets dans le cancer du sein, et d'autant plus que l'activité est intense. Une pratique modérée, avec 30 minutes d'activité physique, 5 jours par semaine, réduirait selon les sources de 10 % à 40 % le nombre de nouveaux cas. L'effet protecteur vient à la fois de la lutte contre l'obésité et de l'action de l'exercice sur les sécrétions hormonales. Des études américaines ont également montré son effet préventif contre une récidive de la maladie.
Réduction de la consommation d'alcool
Le risque de cancer du sein augmente avec la prise d'alcool. Une consommation modérée d'alcool accroît le risque de 20 % à 30 %. Plus précisément, le risque s'accroît de 10 % quand la consommation quotidienne d'alcool augmente de 10 g d'alcool (soit un verre).Âge de la première grossesse
La diminution du délai entre ménarchie et première grossesse permet de diminuer le risque du cancer du sein car les cycles entre la puberté et la première grossesse menée à terme semblent les plus dangereux de ce point de vue.
Allaitement prolongé
L'allaitement prolongé (car mettant les ovaires « en sommeil ») réduit le risque. Selon le rapport du Fonds mondial de recherche contre le cancer (FMRC), l'allaitement maternel apporte un bénéfice quel que soit le moment de développement du cancer (pré- ou post-ménopause). Une durée totale d'un an étalée sur l'ensemble des grossesses réduirait le risque de 18 %.
Éviter le traitement hormonal de la ménopause (THS)
« Le traitement hormonal de la ménopause est désormais considéré comme un facteur de risque du cancer du sein, notamment lorsqu'il est pris pendant plus de 5 ans » rapporte Le Figaro en 2008. Le risque est lié aux THS associant estrogènes et progestérone.
Comportements alimentaires
- Le quintile des femmes qui consomme le moins de gras animal a environ 30 % de risque en moins comparé au quintile qui en consomme le plus (étude sur des femmes de moins de 50 ans).
- Le quintile des femmes qui consomme le plus de légumes à environ 20 % de risque en moins comparé au quintile qui en consomme le moins (pour les cancers hormono-indépendants).
- Le régime méditerranéen serait protecteur pour les cancers hormono-indépendants, avec des effets inverses pour les cancers hormonaux-dépendants.
- Les caroténoïdes et les oméga 3 semblent favorables.
- Manger moins de viandes rouges, plus de fruits et de légumes et plus de fibres pendant l'adolescence est protecteur.
- En date de 2023, un potentiel effet bénéfique des flavonoïdes et des isoflavones est toujours débattu au sein de la communauté scientifique.
Autres
- La non prise de traitements hormonaux réduirait le risque de cancer du sein.
- Des traitements de type SERM (tamoxifène, raloxifène) réduiraient le risque. Cependant, ces médicaments ont des effets secondaires non négligeables (augmentation du nombre de maladies thromboemboliques pour les deux molécules, du cancer de l'endomètre pour le tamoxifène) et leur place reste à déterminer.
Traitements chirurgicaux « préventifs »
Des traitements chirurgicaux préventifs ont été proposés chez les femmes ayant des antécédents familiaux de cancer du sein avec mutation sur les gènes BRCA1 ou BRCA2. Chez ces femmes, le risque de cancer du sein varie entre 40 et 85 % avant l'âge de 80 ans. Les propositions chirurgicales sont soit l'ablation des deux seins avec ou sans ovariectomie bilatérale, soit l'ovariectomie bilatérale seule.
Les études observationnelles actuelles sur la mastectomie bilatérale préventive (MBP) montrent qu'elle pourrait réduire l'incidence de cancers du sein et/ou de décès , ces études ayant malgré tout des limites méthodologiques. La satisfaction à la suite de cette intervention semble bonne, avec une inquiétude relative au cancer qui diminue s'accompagnant d'une diminution de l'image corporelle et des sensations sexuelles. Chez les femmes ayant eu un cancer à un sein, enlever l'autre sein semble réduire l'incidence de cancer, mais l'effet est incertain sur la survie à long terme en raison du risque continuel de récurrence ou de métastase du cancer original
Aspects psychologiques
Apprendre qu'on a un cancer peut être très difficile à assumer, tant cette nouvelle a longtemps été considérée comme celle d'une mort imminente. Par ailleurs, l'hospitalisation, l'opération chirurgicale et les traitements adjuvants changent profondément la vie du malade. Il est donc essentiel d'apporter aux malades un soutien psychologique adapté, ce qui passe en général par la participation à des groupes de patients qui vivent les mêmes épreuves.
Cependant, les cancers du sein diagnostiqués tardivement sont souvent très mutilants. Cette mutilation mammaire correspond en général pour les femmes à une mutilation psychologique et sociale. Le sein étant l'un des plus forts symboles de la féminité, certaines femmes peuvent vivre cette mutilation comme une négation de leur féminité et donc, de leur personnalité.
La relation de couple subit souvent les conséquences de la maladie. Dans la période qui suit le traitement, il arrive que la patiente ou son conjoint exprime des émotions négatives, telles que des reproches. Ce type de situation devrait être pris au sérieux par les professionnels, car elle est peut-être associée à des troubles psychologiques tels que la dépression. Selon Nicolas Favez, Sarah Ciro Notari, Tania Antonini et Linda Charvoz, ce type de situation est susceptible d’apparaître dès les premiers stades de la maladie, et même lorsque le pronostic médical est optimiste. Dans ce cadre, la chirurgie réparatrice peut être proposée, accompagnée d'une prise en charge psychologique.
Le cancer du sein n'est donc pas seulement un problème médical. Il impacte la vie, l'organisme et la confiance en soi. Lorsqu’une femme reçoit le verdict « cancer du sein », elle quitte le cabinet médical, la peur au ventre, avec de nombreuses questions sur ce que sera sa vie dorénavant. Comment parler de ceci à ses proches ? Comment faire face à la chute des cheveux et des sourcils ? Comment sortir de chez soi et affronter le regard des autres ? Comment continuer à s’occuper de ses enfants ? Pourra-t-elle encore en avoir ? Perdra-t-elle son travail ? Qu’adviendra-t-il de sa relation avec l’homme de sa vie ? Tant de questions, peu de possibilités de dialogue, beaucoup de tabous. Souvent les femmes se replient sur la maladie et cela est néfaste même pour la réussite de la thérapie.
Il reste beaucoup à faire pour communiquer correctement avec les patientes et leur entourage mais également pour améliorer concrètement les soins médicaux apportés aux femmes et leur qualité de vie en général.
Dans la culture populaire
L'artiste humoriste Marie Reno soutient les actions de sensibilisation au cancer du sein au moyen de sa chanson humoristique Attention à vos nichons !.
Voir aussi
Articles connexes
- Sein
- Cancer de l'ovaire
- Cancer de l'utérus
- Mastectomie, prothèse
- Mitoxantrone
- Perturbation cognitive post-chimiothérapie
- Atossa et le cancer du sein
- Oncotype DX
- Seintinelles
- Bernard Peyrilhe, un précurseur
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- MalaCards
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) ICD-10 Version:2016
- (sv) Internetmedicin
- (en + es) MedlinePlus
- (en) National Cancer Institute
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- Le cancer du sein sur le site santé de l'Assurance maladie
- www.cancerdusein.org Le site de l'« Association Le Cancer du Sein, Parlons-en ! », à l'origine du mois d'octobre Rose de sensibilisation à la lutte contre le cancer du sein et au dépistage précoce, en France depuis 1994
- Le cancer du sein sur le site de la Fédération nationale de la lutte contre le cancer
- catégorie Cancer du sein de l'annuaire dmoz
- GRCS, le groupe de recherche en cancer du sein du centre de recherche du CHUM à Montréal
- Radio Curie Une webradio d'information dédiée aux femmes atteintes d'un cancer du sein et à leurs proches