Toxoplasmose
| Causes | Toxoplasma gondii |
|---|---|
| Transmission | Contamination féco-orale, transmission placentaire (d), greffe d'organe (d), transfusion sanguine et haemocontact transmission of pathogen (d) |
| Symptômes | Adénopathie, encéphalite, hépatomégalie, splénomégalie, fièvre légère (d) et hépatosplénomégalie |
| Médicament | Sulfadiazine, cotrimoxazole, clindamycine, pyriméthamine, Spiramycine et chloroquine |
|---|---|
| Spécialité | Infectiologie et gynécologie obstétrique |
| CIM-10 | B58 |
|---|---|
| CIM-9 | 130 |
| DiseasesDB | 13208 |
| MedlinePlus | 000637 |
| eMedicine | 229969 |
| MeSH | D014123 |
| Patient UK | Toxoplasmosis |
La toxoplasmose est une infection parasitaire dont l'agent est le protozoaire Toxoplasma gondii. Le parasite infecte le plus souvent des animaux à sang chaud, y compris l’être humain, mais son hôte définitif est un félidé (dont le chat fait partie). L'infection est asymptomatique dans la majorité des cas pour les sujets immunocompétents, ne présentant un risque sérieux que pour les femmes enceintes, les personnes séropositives au VIH et les sujets ayant un système de défense immunitaire affaibli.
La maladie est présente partout dans le monde et on estime qu’un tiers de la population mondiale est porteur de Toxoplasma gondii. Sa prévalence chez l’être humain est variable. Évaluée d'après la séropositivité au toxoplasme (entraînant donc une immunité à une réinfection), la prévalence est faible en Asie ou en Amérique et varie entre 20 % et 70 % dans les autres régions du monde.
La toxoplasmose est transmissible de la mère au fœtus. En France en 2003, la séropositivité chez la femme enceinte était de près de 44 %. Chez les mères séronégatives, en cas d'infection maternelle le risque de transmission au fœtus dépend de l'âge de la grossesse au moment de la contamination. Il est inférieur à 2 % avant deux mois de grossesse, mais, dans ce cas, l’atteinte fœtale est grave. Il atteint 70 % en fin de grossesse et le fœtus subira alors essentiellement des lésions oculaires.
Historique
Le parasite est décrit pour la première fois en 1908 à l’Institut Pasteur de Tunis par deux médecins français, Charles Nicolle et Louis Herbert Manceaux, après une épidémie de laboratoire sur un rongeur sauvage d’Afrique du Nord, le Ctenodactylus gundi. Ils isolent un protozoaire de forme arquée qu’ils nomment Toxoplasma gondii, « toxoplasma » venant des mots grecs toxon, « arc », et plasma, « forme ». Au même moment, l’Italien Alfonso Splendore trouve ce même parasite après la mort des lapins de son laboratoire à Sao Paulo au Brésil. Nicolle et Manceaux proposent le genre Toxoplasma et T. gondii devient l’espèce type du genre. Par la suite, ce parasite sera isolé chez de nombreuses autres espèces animales, et à chaque fois une nouvelle espèce est proposée, nommée d’après l’espèce hôte chez qui elle avait été détectée. Ce n’est qu’en 1939 que Sabin apporte la preuve que ces différentes espèces n’en sont en fait qu’une seule, T. gondii.
La classification reste cependant incertaine et seuls les stades asexués, merozoïtes et kystes tissulaires, sont alors connus. C’est dans les années soixante que les preuves de la nature coccidienne de T. gondii arrivent, et dans les années 1970 que l’on décrit le cycle parasitaire de type coccidien de T. gondii et l’existence de stades sexués dans l’intestin grêle des chats.
En 1923, l’ophtalmologiste tchèque Josef Jankù décrit la maladie humaine, un cas de toxoplasmose congénitale chez un enfant atteint d’une choriorétinite.
Ce n’est qu’en 1939 que la toxoplasmose est reconnue comme une maladie congénitale par Wolf et al. chez un enfant atteint d’encéphalite.
En 1948, Sabin et Feldman mettent au point un test immunologique, le Dye test, qui permet le diagnostic sérologique de la maladie.
Cycle du toxoplasme et pathogénie
Les trois formes parasitaires
Toxoplasma gondii ne peut se multiplier de manière sexuée que chez les Félidés, qui constituent ainsi ses hôtes définitifs, bien qu’il puisse infecter tous les animaux homéothermes, dénommés hôtes intermédiaires. Le toxoplasme a un cycle complexe qui implique la transmission entre hôtes par des stades spécialisés pour l’invasion (voir figure) :
- le stade tachyzoïte, forme proliférative infectieuse chez l’hôte intermédiaire, se développe dans des vacuoles transitoires qui peuvent contenir jusqu’à 128 parasites ; cette forme peut se retrouver aussi chez le fœtus.
- le stade bradyzoïte, chez l’hôte intermédiaire, est contenu dans des kystes intracellulaires qui mesurent environ 100 µm de diamètre et contiennent plusieurs milliers de parasites ;
- le stade mérozoïte, chez l’hôte définitif, est le seul stade capable de reproduction sexuée ;
- le stade sporozoïte, résultat de la reproduction sexuée chez l’hôte définitif, est libéré dans l’environnement avec les déjections du chat dans des oocystes de 10 à 15 µm de diamètre qui contiennent 8 sporozoïtes.
Les stades sporozoïte et bradyzoïte correspondent à des formes de résistance et de dissémination du parasite car, dans une certaine mesure, les kystes et les oocystes protègent les parasites qu’ils contiennent des variations de température, de pH, etc. T. gondii peut alterner entre ces stades en fonction de son hôte et de son contexte, par un processus de différenciation.
- Forme végétative
- Le tachyzoïte ou trophozoïte : C’est la forme que prend le parasite seul. Il est alors très fragile ; sa présence est toujours endocellulaire (il ne résiste ni à l’eau de Javel ni à l’acide chlorhydrique gastrique). L’ingestion n’est donc pas contaminante.
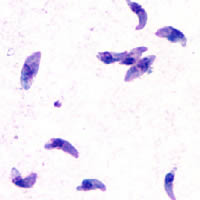
- Il se reproduit rapidement par un processus de multiplication asexuée (endodyogénie) chez l’hôte intermédiaire, toujours dans des macrophages. Puis il en sort en perforant la paroi au moyen d’une protéine qu’il produit (perforine). Des parasites génétiquement modifiés pour ne pas produire cette protéine ne peuvent sortir du macrophage qui gonfle en formant une boule. Visuellement, l’enveloppe du parasite a la forme d’une goutte d’eau un peu arquée (toxon en grec signifie « arc »), d’environ 6 à 8 μm de longueur et de 3 à 4 μm de largeur. Le pôle postérieur arrondi contient le noyau tandis que le pôle antérieur plus aigu possède des ultrastructures adaptées à la pénétration cellulaire (complexe apical).
- Forme kystique
- Cette forme est plus résistante que la précédente (forme de résistance et de dissémination), entourée par une membrane épaisse, de forme sphérique ou ovoïde, elle mesure de 50 à 200 µm. Elle contient en plusieurs milliers d’exemplaires une forme végétative particulière le bradyzoïte ou cystozoïte (3 à 4 microns), un kyste de 100 µm en contient 2 000 à 3 000. Les bradyzoïtes résultent d’une série de multiplications asexuées, colonisant l’intérieur d’une cellule hôte. Leur multiplication est assez lente, et ne peut se faire que dans une cellule nerveuse ou musculaire de l’hôte intermédiaire. Dans les tissus, les kystes restent longtemps vivants, produisant des antigènes qui entretiennent l’immunité. Les kystes peuvent survivre plusieurs jours à température ambiante et plusieurs mois à 4 °C. Ils sont détruits par la chaleur (un quart d’heure à 56 °C) ou la congélation (24 heures à −20 °C).
- L’oocyste
- L’oocyste coccidien est très résistant, même à l’eau de Javel (forme de résistance et de dissémination), c’est la forme que l’on retrouve dans le milieu extérieur (sol, plantes…) où il effectue sa maturation en quelques jours (de un à cinq) à température ambiante et en présence d’oxygène. Sa résistance lui permet de rester vivant pendant plusieurs mois dans le sol, mais il est détruit par la chaleur lors de la cuisson, la dessiccation ou la congélation (−30 °C). Il est le résultat de la reproduction sexuée du parasite chez le chat. C’est un ovoïde de 15 µm par 10 µm regroupant 2 sporocystes de 6 à 8 µm de diamètre, contenant 4 sporozoïtes chacun (un sporozoïte ressemble à un tachyzoïte).
Cycle de reproduction du parasite
Le cycle peut être direct, c’est-à-dire sans hôte intermédiaire (cycle monoxène ou court), ou indirect, passant par un ou plusieurs hôtes intermédiaires (cycle hétéroxène ou long). L’hôte définitif du parasite est principalement le chat, mais les autres félidés sont aussi concernés. Les hôtes intermédiaires sont tous les animaux à sang chaud : mammifères et oiseaux (le chat, hôte définitif, se contamine en dévorant des oiseaux ou des souris).
Les membres de la famille des chats (Felidae) sont les seuls hôtes définitifs connus pour les étapes sexuées de Toxoplasma gondii et représentent le principal réservoir de l'infection. Les chats sont d'abord infectés (étape 1 de la figure) en mangeant de la viande contenant des formes kystiques de T. gondii, ce qui aboutit à la formation, dans son intestin, de gamétocytes dont la fusion donne des oocystes, éliminés dans les selles. Ceux-ci peuvent survivre dans le milieu extérieur, où ils se transforment en sporocystes puis en sporozoïtes infectants, qui sont ingérés par des animaux tels que des rongeurs, des moutons ou des porcs. Le parasite quitte le tractus digestif et, au stade trophozoïte, gagne divers tissus, se multipliant dans les macrophages et survivant dans les muscles, le cœur, le cerveau sous forme de kystes contenant les bradyzoïtes, ce qui entretient l'immunité du sujet infecté.
L'humain peut être infecté de différentes façons : A) ingestion de viandes crues infectées contenant des formes kystiques de T. gondii (étape 2 de la figure) ; B) ingestion d'oocystes provenant de fèces de chat à partir de mains ou d'aliments contaminés (étape 3 de la figure ; contrairement à une idée reçue, la contamination ne se fait pas par contact direct avec les chats) ; C) transplantation d'organe ou transfusions sanguine ; D) transmission congénitale de la mère au fœtus ; E) inoculation accidentelle de tachyzoites.
Contamination initiale
Les oocystes sont présents sur les plantes ou la terre souillées par des déjections d’animaux (chats en particulier). De là, ils peuvent contaminer les aliments, les mains ou l’eau de boisson, puis être ingérés.
Cela dit, le germe de la toxoplasmose ne peut résister longtemps dans la nature, selon les rapports annuels de l'oms et des laboratoires pharmaceutiques, il peut résister de 18 à 32 heures dans des conditions parfaite de labo, il ne peut en aucun cas vivre plus de 3 à 5 heures dans les conditions habituelles de la nature. À cet effet, une bonne hygiène suffit à garder le germe loin des surfaces utilisées et différents aliments naturels de fruits et légumes ou une bonne cuisson par rapport aux différentes viandes préparés.[réf. nécessaire]
La présence des kystes dans la viande est fréquente : 80 % des ovins et des caprins adultes sont contaminés, le porc est généralement contaminé dans moins de 40 % des cas, les autres espèces animales peuvent toutes être contaminées mais dans des proportions inconnues.
Lorsque la viande est consommée crue ou insuffisamment cuite, les kystes ne sont pas détruits et s’installent dans l’organisme hôte. Les kystes ne passent pas la barrière placentaire, seuls les trophozoïtes ou tachyzoïtes passent, si la maladie se déclenche en cours de grossesse, et des cas de contamination par greffe d’organe ou transfusion sanguine ont été recensés.
Reproduction
Hôte intermédiaire
Chez l’hôte intermédiaire, les oocystes libèrent les sporozoïtes, lesquels libèrent les tachyzoïtes (ou trophozoïte) au niveau du tube digestif, et vont passer la barrière intestinale. Ils vont se reproduire dans les cellules de l'hôte (la pénétration se fait par un mécanisme actif et non par phagocytose), déclenchant une phase sanguine de dissémination ou septicémie : l’hôte développe la toxoplasmose.
La réponse immunitaire de l’hôte confine ensuite le parasite à l’intérieur des organes dans lesquels la réponse immunitaire est la plus faible : l’œil, le cerveau, les muscles. Les parasites s’y enkystent, les kystes contiennent de nombreux bradyzoïtes et sont en attente d’une éventuelle réactivation. Cette réactivation se produit lorsque les chairs contenant des kystes sont consommées par un nouvel hôte n’ayant pas encore développé la maladie ou immunodéprimé, ou lors d’une greffe d’organes contenant ces kystes ; la réactivation de bradyzoïtes en tachyzoïtes a été décrite chez l'animal, ce qui permet de comprendre en partie ce qui se passe chez l'immunodéprimé, mais les mécanismes exacts demeurent toujours inexpliqués chez ce type de patient.
Le , l'Institute for Advanced Biosciences révèle dans la revue Cell Host & Microbe sa découverte du mécanisme déployé par le parasite toxoplasma gondii afin de rentrer dans une cellule. Le parasite injecte dans la membrane plasmique d'une cellule, un complexe de protéines capable de former une porte par laquelle il s'engouffre. Toxoplasma gondii va alors pouvoir s'isoler dans la vacuole ainsi créée en faisant une rotation sur lui même qui provoque l'obturation du sas d'entrée. Le parasite peut alors se développer à l'abri.
Hôte définitif
Chez l’hôte définitif, le parasite ingéré (généralement en dévorant un rongeur ou un oiseau infecté) se localise dans le tube digestif, provoquant une coccidiose. Le parasite produit alors des oocystes par reproduction asexuée puis sexuée ; en effet, les trophozoïtes libérés se multiplient au niveau du tube digestif. Il va se produire une reproduction sexuée avec formation de microgamètes mâles et de macrogamètes femelles ; la fécondation conduit aux oocystes. Ces oocystes seront rejetés dans l’environnement de l’hôte avec ses déjections, mais les excréments ne sont généralement pas contaminants pendant les deux premiers jours qui suivent l'excrétion. Les oocystes nécessitent une maturation de quatorze jours pour devenir potentiellement pathogènes et résistent environ un an dans le milieu extérieur. Chez le chat par exemple, environ 2 % des individus disséminent des oocystes, sur des périodes allant de une à trois semaines. Des études montrent qu’ensuite l’infection ne se reproduit pas, même après de nouvelles expositions au parasite. Ce sont donc, en général, les jeunes chats qui excrètent le parasite. L'OMS précise que les chats n’excrètent des oocystes que pendant quelques semaines de leur existence, généralement lorsqu’ils sont chatons. Bien que l'agent pathogène ait été détecté sur la fourrure des chats, il n'a pas été retrouvé sous une forme infectieuse, et une infection directe consécutive à la manipulation des chats est généralement considérée comme très rare.
Formes de la maladie
Il existe trois formes cliniques de la maladie qui sont :
- La toxoplasmose acquise, chez une personne ayant des défenses immunitaires normales, en général inapparente ou sans gravité ;
- La toxoplasmose congénitale qui peut être à l’origine de fœtopathies graves, due à l'infection du fœtus d'une femme enceinte séronégative, non protégée car n'ayant jamais été en contact avec le toxoplasme ;
- La toxoplasmose de l’immunodéprimé, telles que les personnes atteintes du VIH au stade SIDA ou les personnes greffées et traitées par des médicaments immunodépresseurs.
Toxoplasmose acquise de l’immunocompétent
Lorsque la toxoplasmose se déclenche pour la première fois chez un individu, elle est inapparente (asymptomatique) dans près de 80 % des cas : il n’y a pas de poussée de fièvre ; des ganglions cervicaux sont perceptibles pendant une semaine environ.
Dans un peu moins de 20 % des cas, la maladie prend une forme dite « subaiguë » ; après une incubation silencieuse de quelques jours apparaissent des adénopathies cervicales, une fièvre prolongée à 38 °C, une fatigue intense (asthénie). Le taux des monocytes augmente et la maladie est très comparable, dans ses manifestations cliniques, à une mononucléose infectieuse. La guérison est relativement lente.
Enfin, dans de rares cas, surtout chez les patients immunodéprimés et les personnes au stade sida, la maladie prend une forme dite « aiguë », avec de la fièvre. Elle peut alors provoquer divers types de lésions : oculaires (choriorétinite), cardiaques, pulmonaires, voire entraîner des symptômes neurologiques. La durée de la phase de septicémie est plus longue ; les fluides corporels (l'urine, les larmes, le lait, la salive) contiennent assez de parasites pour qu'un comptage direct puisse être effectué. Ces cas sont dus (chez la souris de laboratoire) à une mutation d'une ou deux protéines kinases produites par le gène ROP18, lesquelles sous cette forme « anormale » perturbent la communication dans la cellule et favorisent la duplication du parasite, même chez des individus en bonne santé.
Dans tous les cas, les kystes formés persistent et sont indétectables ; l'immunité du sujet à de nouvelles attaques de la maladie est conférée par la présence d'immunoglobuline G (IgG).
Toxoplasmose et grossesse
On estime qu'un enfant sur 1000 naît infecté par le toxoplasme en France. En Suisse, un enfant sur 2300 naît infecté, mais seul un enfant sur 14000 présente une infection symptomatique.
Le risque de contamination du fœtus survient probablement lorsque la femme enceinte est en phase parasitémique, mais aussi au début de l'infection alors que la mère est asymptomatique : les parasites peuvent alors coloniser le placenta, puis, de là, parvenir au fœtus. Ce type de contamination ne survient que lorsque la mère contracte la maladie en cours de grossesse (on parle alors de toxoplasmose gravidique), bien que, très exceptionnellement, la réactivation de kystes puisse conduire à une transmission du parasite vers l'enfant[réf. nécessaire].
Le risque de passage de la barrière placentaire augmente au cours de la grossesse (il est faible au cours du premier trimestre (6 % à 13 semaines d'aménorrhée, et croît les mois suivants jusqu'à atteindre 72 % à 36 semaines d'aménorrhée), mais en parallèle, les conséquences sont d'autant plus graves que le fœtus est jeune, tant qu'il ne dispose pas d'un système immunitaire complet. La contamination vers la fin de la grossesse peut conduire à des formes bénignes ou à des formes latentes. Un tiers des mères qui ont fait une séroconversion en cours de grossesse donnent naissance à un enfant infecté.
La France et le Maroc[réf. nécessaire] font partie des rares pays au monde à recommander le dépistage systématique des femmes non-immunisées contre la toxoplasmose, avant et au début de la grossesse ; la surveillance est ensuite mensuelle chez les femmes séronégatives pour diagnostiquer rapidement une séroconversion. Cette attitude permet de déterminer la prévalence de l'immunité contre l'infection : elle est directement en rapport avec les habitudes alimentaires, et non au contact avec les chats. Cette séroprévalence diminue avec le temps (82 % en 1960, 66 % en 1982, 54 % en 1995 et 44 % en 2003), et les séroconversions en cours de grossesse diminuent (40 pour 1 000 femmes séronégatives en 1960, 13,2 pour 1000 en 1995).
Contamination au premier trimestre : avant 16 semaines
C'est au premier trimestre, et surtout avant dix semaines d'aménorrhée, que le risque de transmission materno-fœtale est le plus faible. Cependant, c'est pendant cette période que les conséquences d'une contamination sont particulièrement graves : elles peuvent notamment entraîner la mort in utero ou dans les mois qui suivent la naissance, ou bien provoquer des retards psychomoteurs graves, liés à l'action du parasite sur la formation du système nerveux central (modifications de l'aspect et du volume du crâne, par des calcifications intracrâniennes caractéristiques de la toxoplasmose congénitale, hydrocéphalie, microcéphalie, dilatation ventriculaire). Au niveau neurologique, on peut constater des convulsions, de l'hypertonie ou de l'hypotonie, une modification des réflexes, des troubles végétatifs ou encore des troubles oculaires (dans 80 % des cas, une choriorétinite pigmentaire).
Contamination au second trimestre : entre 16 et 28 semaines
Une atteinte cérébrale est toujours possible mais plus rare. On ne retrouve pas, au cours de la surveillance échographique, des dilatations ventriculaires lorsque la séroconversion survient après 24 semaines. Cependant on retrouve des calcifications intracrâniennes et une choriorétinite.
Contamination au dernier trimestre : après 28 semaines
Le risque est essentiellement ophtalmologique : choriorétinite pigmentaire (atteinte des pigments de la rétine). Ce risque persiste pendant plusieurs années, imposant une surveillance longue des enfants concernés. Les lésions oculaires sont généralement faciles à reconnaître mais il existe des formes cliniques qui peuvent égarer le diagnostic. Classiquement, on découvre une lésion jaunâtre qui peut être paramaculaire ou parapapillaire, et cette anomalie va évoluer vers une cicatrisation pigmentée.
Diagnostic de la toxoplasmose congénitale
Il repose sur une démarche en deux temps.
Diagnostic d'infection toxoplasmique acquise au cours de la grossesse
En l'absence habituelle de signe clinique chez la femme enceinte, le diagnostic repose en premier sur le sérodiagnostic qui doit être pratiqué au cours du premier trimestre.
Si le premier sérodiagnostic est négatif (IgG négatif, IgM négatif), la femme est non protégée ; il faut faire un sérodiagnostic tous les mois, le dernier sur sang maternel au moment de l'accouchement ou trois à quatre semaines après l'accouchement. S'il se positive au cours de la grossesse, c'est une séroconversion : le diagnostic de toxoplasmose acquise au cours de la grossesse est certain. Il faut dater l'infection et faire des examens complémentaires en fonction de l'âge de la grossesse.
Plus délicat, en cas de présence IgG et d'IgM lors de la première sérologie. La datation de la contamination repose alors sur la cinétique des anticorps et l'avidité des IgG. La présence d'une forte avidité (supérieure à 30 %) signe une toxoplasmose acquise depuis plus de 4 mois (donc avant la grossesse). Il est inutile de répéter les examens et on peut rassurer la patiente.
La faible avidité des IgG ne signifie pas que la toxoplasmose date de moins de quatre mois. Il faut faire un nouveau sérodiagnostic et c'est si le taux des IgG double que l'on peut poser le diagnostic de toxoplasmose acquise au cours de la grossesse. Le début de l'infection remonte deux mois avant le prélèvement. Si le taux reste stable, c'est une toxoplamose acquise avant la grossesse.
La présence d'IgG seule sans IgM ne nécessite aucun contrôle supplémentaire.
La présence d'IgM seule sans IgG est le plus souvent en rapport avec des IgM non spécifiques. Cependant il faut savoir que si les IgM sont le signe d'une infection récente (ils apparaissent en quelques jours, le pic est atteint en 2 - 3 mois et ils diminuent), ils peuvent persister plusieurs mois, voire plusieurs années ; plus d'un quart des individus gardent des IgM anti-toxoplasmiques plus de 2 ans.
Dès la séroconversion prouvée, la femme est mise sous spiramycine à la dose de 3 grammes trois fois par jour et jusqu'à la réalisation de l'amniocentèse. En cas de présence d'IgM au cours du premier prélèvement, on peut mettre la femme sous spiramycine en attendant le deuxième prélèvement.
Diagnostic de toxoplasmose congénitale au cours de la grossesse
Repose sur la recherche de toxoplasme dans le liquide amniotique par amniocentèse (la ponction fœtale est désuète) et la recherche mensuelle de signes (malformations cérébrales et cardiaques) à l'échographie et par IRM fœtale.
Amniocentèse
Recherche de toxoplasme par PCR. Cette amniocentèse sera effectuée systématiquement pour toute séroconversion avant 22 semaines mais pas avant 18 semaines et après un délai de quatre à six semaines après l'infection maternelle. La quantification du nombre de copies de PCR est un élément pronostic (la présence de plus de 100 copies par millilitre est un facteur de mauvais pronostic). Il n'existe pas de faux positif mais la valeur prédictive négative est de 87 %, ce qui veut dire qu'une fois sur dix la parasite est présent mais la PCR ne le détecte pas. La quantité de liquide amniotique prélevée est très importante, il faut au minimum 20 millilitres.
Aspect échographique : dépendant du terme de l'infection
Il est important de noter que des symptômes échographiques peuvent être absents alors que le fœtus est infecté : en effet, près de 80 % des fœtus infectés au premier trimestre seront symptomatiques à l'échographie, 20 % au deuxième trimestre et aucun si l'infection a eu lieu au troisième trimestre.
Au niveau du cerveau fœtal, on peut voir :
- une dilatation des ventricules latéraux débutant par les cornes occipitales, rapidement évolutive, bilatérale si sténose de l'aqueduc de Sylvius ou unilatérale si sténose du trou de Monro. Mais l'absence de dilatation n'a pas une bonne valeur prédictive négative car il existe des atteintes sévères même en l'absence d'envahissement de l'aqueduc de Sylvius (porencéphalie ou polymicrogyrie) ;
- des hyperdensités qui sont souvent mieux vues par la voie endovaginale (haute fréquence) de pronostic incertain mais souvent en rapport avec la choriorétinite.
Autres signes :
- épanchement péricardique et ascite, calcifications hépatiques, hyperéchogénicité intestinale ou placentamégalie ou placentite.
Aspects par IRM
Pas d'IRM avant 28 semaines, soit pas avant le début de l'apparition de la scissure de Rolando ++, ou, mieux, pas avant 32 semaines. Confirme l'atteinte multifocale. Recherche d'anomalie de la gyration type polymicrogyrie.
Traitement et surveillance de la toxoplasmose au cours de la grossesse
Selon les préconisations de l'OMS :
- Si la PCR est négative
On continue la spiramycine jusqu'à l'accouchement et on réalise une échographie une fois par mois. La recherche d'une toxoplasmose congénitale sera faite sur le nouveau-né par le dosage des IgG et des IgM du nouveau-né.
- Si la PCR est positive
La spiramycine est remplacée par la pyriméthamine 50 mg par jour (Malocide) et du sulfadiazine (Adiazine) 1,5 gramme deux fois par jour associée avec de l'acide folinique (Lederfoline) 50 mg une fois par semaine. La surveillance échographique se fera toutes les deux semaines et une surveillance de la toxicité des médicaments assurée par un hémogramme une fois par semaine ; la pyriméthamine entraîne une carence en acide folique avec anémie mégaloblastique, et parfois granulopénie et thrombopénie. La sulfadiazine s'accompagne d’un risque grave d'allergie cutanée et de thrombopénie, anémie hémolytique immuno-allergique, aplasie médullaire.
En 2007 est parue une méta-analyse de différentes études de cohortes ; cette étude montre que le traitement préventif de la transmission en cours de grossesse n'est efficace que s'il est prescrit moins de trois semaines après la séroconversion, et que les traitements curatifs (en cas de suspicion d'atteinte fœtale) ne semblent pas diminuer le risque d'atteinte fœtale.
Lorsqu'il existe des lésions visualisées en échographie, notamment du cerveau, une interruption médicale de grossesse peut être proposée.
Diagnostic de toxoplasmose congénitale chez le nouveau-né
Le diagnostic de la toxoplasmose congénitale se fait chez les enfants avec une PCR négative au cours de l'amniocentèse ou dans les séroconversions du troisième trimestre n'ayant pas subi une amniocentèse.
- Recherche des IgM au sang du cordon : si le dosage est négatif, la cinétique des IgG permettra de faire le diagnostic de toxoplasmose congénitale. Il faut vérifier la baisse du taux des IgG dont la demi-vie est de 3 semaines tout arrêt ou réascencion de la décroissance des IgG signe la toxoplasmose congénitale.
- Recherche des IgM au sang du cordon : IgM est positif, il faut refaire 72 heures après une recherche des IgM dans le sang périphérique du nouveau-né pour éliminer les quelques cas de transmission d'IgM maternelle au cours de l'accouchement. Si celle-ci est positive le diagnostic de toxoplasmose congénitale est confirmée. Si celle-ci est négative on se retrouve dans le schéma ci-dessous
Le nouveau-né bénéficiera d'une échographie transfontanellaire et d'un examen ophtalmologique.
Traitement de la toxoplasmose congénitale chez le nouveau-né.
C'est l'association de pyriméthanine 1 mg/kg/j pendant deux mois puis 0,5 mg/kg/j pendant dix mois (Malocide) avec de la sulfadiazine (Adiazine) 100 mg/kg/j pendant un an associé avec de l'acide folinique (Folinoral 25) 25 mg par semaine. La recherche d'une toxicité sanguine du traitement sera faite. La surveillance ophtalmologique devra durer plusieurs années.
Pronostic
Les deux critères de pronostics les plus sûrs sont la charge en toxoplasme dans le liquide amniotique et le terme de l'infection toxoplasmique : avant 20 semaines et surtout avant 10 semaines. La probabilité de retrouver des signes échographiques après une séro conversion supérieure à 24 semaines est inférieure à 5 %. Si une infection survient avant 10 semaines, il est possible d'avoir un bon pronostic avec le traitement (pyriméthanine 50 mg par jour (Malocide) + sulfadiazine (Adiazine) 1,5 gramme deux fois par jour) mais il faut bien avertir les parents sur l'incertitude du pronostic neurologique et oculaire. L'IMG est acceptée à la demande des parents. Le risque de choriorétinite serait augmenté s'il y a plus de 8 semaines entre la séroconversion et le début du traitement et par la présence de zone hyperdense cérébrale à l'échographie. Bien entendu devant tout signe de dilatation ventriculaire l'échographie, l'IMG est acceptée à la demande des parents.
En 1995, le rapport de l'AFSSAPS évalue à 600, en France, le nombre de naissances d'enfants porteurs d'une toxoplasmose congénitale ; 174 ont des séquelles dont 11 à type d'hydrocéphalie, les autres étant porteurs d'une choriorétinite.
Toxoplasmose de l’immunodéprimé
Deux cas peuvent se présenter, selon que le déficit immunitaire est acquis ou provoqué par des médicaments. Ces cas influent sur la manière dont la contamination survient et sur ses signes cliniques.
Déficit immunitaire acquis (cas du SIDA)
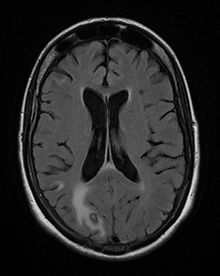
On décrit de rares cas où un sujet VIH+, sans immunité anti-toxoplasmique (pas de contact antérieur) contracte une toxoplasmose, mais le plus souvent il s'agit de patients immunisés contre la toxoplasmose, donc porteurs de kystes qui réactivent l'infection lors d'une baisse conséquente de leurs défenses immunitaires ; généralement, ils présentent une toxoplasmose cérébrale.
La toxoplasmose cérébrale est une maladie opportuniste dont la survenue chez les personnes séropositives marque l'évolution de l'infection par le VIH au stade de sida. Elle survient en règle générale chez des sujets séropositifs au VIH, ayant moins de 200 lymphocytes T CD4+, avec une sérologie toxoplasmique positive et ne recevant pas de prophylaxie spécifique. C'est alors que les bradyzoïtes libèrent les tachyzoïtes qui essaiment dans tout le corps via le système sanguin. En 2008 en France, la toxoplasmose cérébrale représentait 12 % des personnes qui découvraient leur séropositivité au VIH après le déclenchement d'une affection opportuniste.
Les symptômes de début peuvent être insidieux, céphalées d'installation récente ou réactivation de céphalées anciennes, avec ou sans fièvre. Trois situations sont possibles :
- il s'agit d'un (ou de plusieurs) abcès cérébral (cas le plus fréquent) donnant un tableau neurologique rapidement progressif. Les signes cliniques dépendent de la localisation de(s) l'abcès : hémiplégie ou hémiparésie, syndrome cérebelleux, aphasie, amputation du champ visuel, ou signes plus diffus à type de somnolence, désorientation, crises comitiales ;
- il s'agit d'un abcès médullaire (rare) donnant un tableau paraparétique ou paraplégique associé à des troubles sensitifs et/ou sphinctériens ;
- il s'agit d'une encéphalite toxoplasmique, plus fréquente chez les transplantés que chez les patients VIH.
Traitements curatifs
L'association de pyriméthamine (Malocide), de sulfadiazine (Adiazine) et d'acide folinique (pour la prévention des effets hématotoxiques) pendant 6 semaines est le traitement de référence. On utilise aussi en alternative le cotrimoxazole (Bactrim) ou l'atovaquone (Wellvone). Une attention particulière doit être portée aux interactions avec les antirétroviraux.
Traitements préventifs
La prophylaxie est recommandée en cas de présence d'anticorps anti-Toxoplasma gondii et si les lymphocytes CD4 sont inférieurs à 200 par millimètre cube de sang. Le cotrimoxazole est recommandé en prévention primaire avec l'avantage d'être aussi efficace pour la prophylaxie de la pneumocystose, autre maladie opportuniste du SIDA en association fréquente. Une association de pyriméthamine, sulfadiazine et acide folinique est recommandée en prévention secondaire.
Déficit immunitaire provoqué (cas des transplantés et des greffés)
Il peut s'agir ici soit de la réactivation de kystes résultant d'une contamination passée du receveur (par exemple lors d'une greffe de moelle osseuse), soit de l'introduction chez le receveur de kystes contenus dans le greffon (par exemple lors d'une greffe du cœur).
Au plan clinique, les manifestations dans ce cas sont celles d'une toxoplasmose aiguë disséminée.
Dans tous les cas où l'on s'apprête à provoquer un déficit immunitaire, il faut connaître si possible le statut immunitaire du patient vis-à-vis de la toxoplasmose avant la mise en place du traitement immunosuppresseur. De plus, il est indispensable de mettre en place une surveillance du patient ainsi que de suivre des mesures prophylactiques rigoureuses.
Professions à risque
Les professionnels en contact avec de la viande crue, les animaux ou les selles de félins contaminés, voire des objets portant le germe sont les plus exposés. Le risque est donc présent pour :
- les vétérinaires, éleveurs, gardiens d'animaux (félins) et assistants ;
- les employés d'abattoirs, de boucherie, de cuisine, les personnes préparant ou inspectant de la viande ;
- les agriculteurs ;
- les paysagistes, les jardiniers ;
- les techniciens de laboratoire ;
- les professionnels de santé en général ;
- les archéologues.
Précautions à prendre
Gardiens, éleveurs d'animaux
Il convient d'éliminer systématiquement les excréments des félins, de jeter la litière sèche sans la secouer. La destruction peut se faire par dépôt en décharge, incinération, ou en les enterrant à une bonne profondeur.
Les bacs ou plateaux de litière doivent être désinfectés (par étuvage à 70 °C pendant 10 minutes au moins) chaque jour, de même que les pelles, balais et autre articles de nettoyage. Les accessoires de nettoyage doivent être conservés dans la même zone que les animaux. Le port de gants de protection jetables est recommandé pour manier la litière et pour travailler dans un sol où il peut y avoir des excréments de félins. Les mains doivent être lavées après avoir enlevé les gants.
Les félins doivent être tenus à l'écart des autres animaux pour éviter les risques de contamination. Il ne faut pas donner de viande crue aux félins, sauf si elle a été congelée jusqu'à environ -18 °C (0°F).
Personnes en contact avec de la viande crue/légumes
Les mains doivent être abondamment lavées avec de l'eau et du savon, en utilisant des lavabos ou des éviers à commande fémorale. Il ne faut pas se toucher la bouche ou les yeux après avoir manipulé de la viande crue. Les surfaces et les outils utilisés (comptoirs, couteaux, machines…) doivent être nettoyés à l'eau savonneuse.
Agriculteurs, paysagistes, jardiniers
La terre peut être une source de contamination, en particulier aux endroits fréquentés par les chats (les excréments de chat sont fréquemment présents dans les sols). Il convient donc de bien se laver les mains après avoir travaillé la terre ou touché des animaux, le port de gants étant recommandé. Le port de gants ne doit pas dispenser de se laver les mains ensuite. En cas d'avortement d'une femelle, il ne faut pas toucher l'embryon à mains nues. Il doit être confié à un laboratoire avec des spécimens de sang et de placenta pour connaître son statut vis-à-vis du parasite. Ce qui subsiste doit être enterré à bonne profondeur ou être brûlé, en prenant soin de ne pas laisser d'animaux (chats, chiens, rongeurs) y accéder.
Les chats doivent être tenus à l'écart du fourrage, leurs excréments doivent en être éliminés. Les chats adultes ont plus de chances d'avoir déjà développé une résistance à la toxoplasmose ; on peut les laisser pénétrer dans les granges.
Personnels de laboratoire
Il est conseillé aux femmes enceintes de ne pas travailler sur des échantillons soumis pour analyse de Toxoplasma gondii.
L'exposition à des substances contaminées nécessite le port de vêtements de protection adaptés. Un vêtement souillé doit être identifié par un logo de risque biologique ; il doit être lavé selon les méthodes de désinfection requises.
La production et l'exposition à des aérosols de tissus animaux sont fortement déconseillées.
Professionnels de la santé
Il n'a pas été démontré que la toxoplasmose pouvait être transmise par l'urine ou les selles humaines contaminées. Cependant, il vaut toujours mieux porter des gants jetables pour travailler avec des personnes atteintes d'incontinence. Les mains et les ongles doivent être soigneusement lavés avec de l'eau savonneuse après avoir retiré les gants.
Femmes enceintes
La vaccination n'existant pas, la prévention est le meilleur traitement :
- ne consommer que de la viande bien cuite (cuisson à plus de 67 °C au cœur des viandes), en particulier les ovins ;
- lavage approfondi des salades et crudités, nettoyage des surfaces de travail ayant servi à préparer les légumes, et éviter de manger des crudités dont on ne connaît pas la préparation ;
- laver (et peler) les fruits et légumes avant de les consommer, avec de l'eau vinaigrée ; cuisson d'au moins une minute à 60 °C pour les végétaux ;
- porter des gants en cas de jardinage ou de nettoyage de la litière d'un chat et se laver les mains ;
- éviter si possible de s'occuper de la litière d'un chat, sinon la nettoyer quotidiennement et avec de l'eau bouillante.
Contrairement à une idée reçue, la contamination ne se fait pas par contact avec le chat : chez l'humain, elle se fait par ingestion. La propagation du parasite par le chat est assurée par défécation, les ookystes ne devenant cependant contaminants qu'après deux à cinq jours dans un milieu favorable (humide et oxygéné : terre, litière), et uniquement à la première contamination du chat. Le risque lié à la présence d'un chat est donc très limité et essentiellement lié à l'hygiène lors du nettoyage des excréments de l'animal. Les contacts, morsures ou griffures ne permettent pas la contamination.
En outre, seuls les chats qui chassent pour se nourrir peuvent être porteurs du parasite. Un chat d'appartement urbain, nourri avec des aliments industriels ne présente aucun danger de contamination de l'homme.
Les précautions suivantes ont une efficacité incertaine sur la destruction des toxoplasmes :
- la congélation : des oocytes sporulés ont été retrouvés 28 jours après une congélation à −21 °C ;
- salaison, condiments, fumaison, saumure, conservation sous vide, dessiccation, lyophilisation, désinfection par ultra-violets ou infrarouges, cuisson par micro-ondes (voir l'article Conservation des aliments).
Controverses
Troubles du comportement
Le parasite est capable de modifier le comportement de son hôte : les rats et les souris infectés ont moins peur des chats, certains des rats infectés n’évitent plus les zones marquées par l’urine des chats, soit parce qu’ils sont insensibles à l’odeur, soit parce qu’ils oublient leur crainte ancestrale du félin. Cet effet constitue un avantage pour le parasite, qui sera en mesure de se reproduire sexuellement si son hôte est mangé par un chat. Le mécanisme de ce changement de comportement n'est pas complètement élucidé, mais il semble que l'infection par la toxoplasmose augmente le niveau de dopamine dans le cerveau des souris infectées.
En 2007, à l'université Stanford (États-Unis), l'équipe d'Ajai Vyas a révélé que le parasite vecteur de la toxoplasmose se logeait dans l'amygdale cérébrale, zone cérébrale sensible aux odeurs et connue pour être liée aux sentiments de peur. Lorsque cette zone est contaminée, le rat devient insensible à l'odeur d'urine de chat et, devenu moins peureux, a davantage de risque d’être dévoré. C'est pendant cette digestion dans l’estomac du prédateur que le parasite se reproduit, puis les œufs sont libérés par les excréments, qu'un autre rat peut accidentellement avaler et le cycle biologique du toxoplasme se poursuit.
La découverte de modifications du comportement chez les rats et les souris infectés ont amené certains scientifiques à avancer l’hypothèse que le toxoplasme pourrait avoir des effets similaires chez les humains, même pendant la phase de latence considérée auparavant comme asymptomatique. Le toxoplasme est l'un de ces nombreux parasites qui risquent de modifier le comportement de leur hôte dans le cadre de leur cycle parasitaire. Les comportements observés, s’ils sont provoqués par le parasite, sont probablement dus à l'infection et à une discrète encéphalite, qui est liée à la présence de kystes dans le cerveau, ce qui peut provoquer ou induire la production d'un neurotransmetteur, éventuellement, la dopamine. Il s’agirait donc d’un mécanisme d’action similaire à celui des inhibiteurs de la recapture de la dopamine, des antidépresseurs et des stimulants.
Des corrélations ont été trouvées entre la toxoplasmose latente et certains traits de comportement :
- augmentation des comportements de prise de risque ;
- ralentissement des réactions ;
- sentiment d'insécurité et de doute.
Les preuves d’effets possibles sur le comportement humain, bien que cette hypothèse soit fascinante, restent relativement peu étayées. Il n'y a eu aucun essai clinique randomisé pour étudier les effets du toxoplasme sur le comportement humain. Bien que certains chercheurs aient trouvé des associations importantes de certains troubles du comportement avec l’infection par le toxoplasme, il est possible qu’un biais se soit introduit dans l’analyse statistique et que ces associations se bornent à refléter les facteurs qui prédisposent certains types de personnes à l'infection (les personnes qui présentent des comportements de prise de risques peuvent être plus enclines à prendre le risque de l'ingestion de viande mal cuite)[réf. souhaitée].
Ce parasite est associé au stéréotype de la femme à chats.
Des études ont trouvé une association entre la toxoplasmose et une augmentation du taux d'accident de voiture (risque doublé ou triplé par rapport aux personnes non infectées).
Cela pourrait être dû à l’augmentation des temps de réaction qui sont associés à l'infection. « Si nos données sont exactes cela signifie qu’un million de personnes chaque année meurent uniquement parce qu’elles sont infectées par le Toxoplasme » déclare le chercheur Jaroslav Flegr dans « The Guardian ».
Ruth Gilbert, coordonnateur médical de l’étude européenne multicentre sur la toxoplasmose congénitale déclarait sur BBC News Online : « Ces découvertes peuvent être dues au hasard ou à des facteurs sociaux et culturels associés à la toxoplasmose », « However there is also evidence of a delayed effect which increases reaction times ».
Rôle de la toxoplasmose dans les troubles mentaux
Plusieurs études ont montré des taux beaucoup plus élevés d’anticorps contre le toxoplasme chez les patients atteints de schizophrénie par rapport à la population générale.
La possibilité que la toxoplasmose soit une des causes de la schizophrénie a été étudiée scientifiquement depuis au moins 1953, mais ces études n’ont attiré l'attention des chercheurs américains qu'après que l'éminent psychiatre et avocat E. Fuller Torrey ait publié en 2003 une revue de cette littérature, rapportant que presque toutes les études ont révélé que les schizophrènes ont des taux élevés d'infection par le toxoplasme.
Un article de 2006 a suggéré que la prévalence de la toxoplasmose aurait des effets à grande échelle sur la culture d’un pays. Ce type d'études est séduisant, mais la méthodologie ne permet pas d’affirmer l’existence d’une relation de cause à effet entre infection a Toxoplasma gondii et trouble mental (il est possible, par exemple, que ce soit la schizophrénie qui augmente le risque d'infection par le toxoplasme plutôt que l'inverse). Cependant :
- certains psychotropes — tels que les phénothiazines et l'halopéridol, antipsychotiques utilisés pour traiter la schizophrénie, ou le valproate, stabilisateur de l'humeur utilisé pour traiter le trouble bipolaire — peuvent aussi arrêter la division du toxoplasme dans les cultures cellulaires ;
- l’infection par le toxoplasme provoque dans le cerveau des lésions des astrocytes, type de lésions qu'on rencontre également dans la schizophrénie.
De plus, selon Guillaume Fond, coauteur de deux nouvelles études qui viennent confirmer en 2015 ce lien entre toxoplasmose et troubles mentaux : « Les analyses génétiques ont montré que les gènes de susceptibilité associés à ces maladies — schizophrénie, trouble bipolaire, trouble obsessionnel compulsif et toxicomanie — sont impliqués dans le système immunitaire et non dans des fonctions cérébrales : tout porte donc à croire que des facteurs infectieux ou inflammatoires sont impliqués dans l’étiologie de ces maladies psychiatriques ».
La première de ces études s'intéresse à la prévalence de l'infection à Toxoplasma gondii dans les principaux troubles mentaux — schizophrénie, trouble bipolaire, trouble obsessionnel compulsif, toxicomanie et dépression majeure — par rapport à des témoins sains, et démontre un odds ratio significatif pour tous ces troubles à l'exception de la dépression majeure.
La seconde étude compare les résultats cliniques de l'administration d'un antipsychotique ou d'un stabilisateur de l'humeur connu pour avoir in vitro une activité antitoxoplasmique (TATA+) et d'un traitement sans activité antitoxoplasmique (Tata-) sur des patients atteints de trouble bipolaire ou de schizophrénie. Il en ressort une réduction de la durée des épisodes dépressifs sous TATA+ pour les patients atteints de trouble bipolaire séropositifs à Toxoplasma gondii par rapport à ceux traités par Tata-, mais pas de différence significative pour les patients bipolaires séronégatifs à Toxoplasma gondii, ni pour les patients schizophrènes positifs ou non à la toxoplasmose. Les chercheurs estiment en conclusion que les données sont suffisamment parlantes pour systématiser le dépistage de la toxoplasmose chez les patients atteints de trouble bipolaire, et utiliser un traitement avec activité antitoxoplasmique chez ceux dont le résultat de ce dépistage est positif, le valproate (Dépakine, Dépakote, Dépamide, Micropakine et génériques) étant le stabilisateur de l'humeur avec l'activité antitoxoplasmique la plus importante.
L’infection aiguë par le toxoplasme provoque parfois des symptômes psychotiques qui ne conduisent pas à la schizophrénie.
Recherche
Des chercheurs de l'Institute for Advanced Biosciences publient le dans la revue Nature Microbiology, une étude expliquant comment contrôler la reproduction du parasite à l'origine de la toxoplasmose.
Personnalités atteintes
- Martina Navrátilová (joueuse de tennis) s’est retirée de la compétition en 1982 à cause d'une mystérieuse maladie virale qui s’est révélée ultérieurement être une toxoplasmose.
- Arthur Ashe a été atteint de troubles neurologiques consécutifs à une toxoplasmose (et s’est révélé plus tard séropositif pour le VIH).
- François d'Orléans, fils aîné du Comte de Paris (prétendant orléaniste au trône de France). Atteint dans sa forme congénitale, comme sa sœur la princesse Blanche.
Voir aussi
Bibliographie
- Patrick Yéni (dir.), « Chapitre 15 : Infections chez les personnes séropositives pour le VIH », dans Prise en charge médicale des personnes infectées part le VIH, recommandations du groupe d'experts - Rapport, Paris, Ministère de la santé, de la jeunesse, des sports et de la vie associative / Flammarion, , 414 p. (ISBN 978-2-2570-0062-0, lire en ligne), p. 286 et suivantes
- Joanna Kubar, Un parasite à la conquête du cerveau. Le toxoplasme, EDP Sciences, 2017 (ISBN 978-2759819324)
Articles connexes
Liens externes
- (en) Toxoplasmosis : Recent advances, Open access book, (DOI 10.5772/2845, lire en ligne)
- Dossier sur la toxoplasmose et la femme enceinte
- Une fiche d'information sur la toxoplasmose chez la femme enceinte, sur Sante-AZ
- Régime grossesse et conseils anti-toxoplasmose, imagés avec aide-mémoire
- Prévention de la toxoplasmose en tant que risque professionnel
- Parasitologie : la toxoplasmose
- Choriorétinite toxoplasmique
- (en) The prevalence of Toxoplasma gondii, a single-celled parasite, accounts for some cultural differences
- (en) CDC factsheet: Toxoplasmosis
- Agence Française de Sécurité Sanitaire des Aliments - Rapport du groupe de travail Toxoplasma gondii de l'AFSSA « Toxoplasmose : état des connaissances et évaluation du risque lié à l'alimentation », décembre 2005, 212 pages
- Bulletin épidémiologique hebdomadaire, « Toxoplasmose chez les femmes enceintes en France : évolution de la séroprévalence et de l’incidence et facteurs associés, 1995-2003 », sur www.invs.sante.fr, Institut national de veille sanitaire, (consulté le )