Pneumopathie interstitielle diffuse idiopathique
| Symptômes | Pneumonie |
|---|
| Spécialité | Pneumologie |
|---|
| CIM-10 | J84 Autres maladies pulmonaires interstitielles |
|---|---|
| MeSH | D054988 |
Les pneumopathies interstitielles diffuses idiopathiques, aussi dénommées pneumopathies infiltrantes ou infiltratives diffuses, forment un groupe de formes rares de maladies, qui se caractérisent par une inflammation des poumons principalement localisée dans le tissu de soutien (interstitium) du poumon.
La cause n'est pas connue — d'où le qualificatif d'« idiopathique ». Les pneumopathies interstitielles diffuses idiopathiques appartiennent au très grand groupe des maladies interstitielles des poumons dans lequel on range près de 200 maladies identifiées. Le symptôme principal en est la dyspnée (difficulté à respirer).
La maladie débute par une inflammation des poumons, d'intensité variable, mais qui touche en premier lieu le tissu de soutien (interstitium). Là-dessus peut se greffer une cicatrisation du poumon, sous forme de fibrose. Dans certaines formes, la fibrose est au premier plan, et l'inflammation n'est qu'une manifestation d'accompagnement. Le pronostic, ou l'évolution de la maladie, et les possibilités de traitement dépendent en particulier de l'importance prise par l'inflammation ou la fibrose dans la forme de maladie considérée.
Classification
La classification des pneumopathies interstitielles diffuses idiopathiques se base sur une ligne définie en commun par l´American Thoracic Society (en) et l´European Respiratory Society (en), publiée en 2002. Selon cette classification, on distingue sept formes, qui se définissent par différents critères cliniques, radiologiques et pathologiques. Une huitième catégorie regroupe les formes non classifiables :
- Fibrose pulmonaire idiopathique
- Pneumonie interstitielle non spécifique
- Pneumonie à organisation cryptogène
- Pneumonie interstitielle aigüe
- Bronchiolite respiratoire avec maladie pulmonaire interstitielle
- Pneumonie interstitielle desquamative et
- Pneumonie interstitielle lymphoïde.
L'importance de cette nouvelle classification est avant tout la définition interdisciplinaire des diverses formes, qui précédemment, étaient généralement étudiées dans des publications indépendantes de pathologistes, de radiologues et d'internistes. Il a été clairement établi que l'on doit distinguer le type histopathologique du diagnostic clinique. Un diagnostic clinique sûr doit s'appuyer aussi bien sur des preuves cliniques, que radiologiques ou aussi histopathologiques. Certes, le degré d'évidence pour distinguer les classes est faible mais la classification fournit une bonne base pour des études futures, car elle donne des critères unifiés dans ce domaine.
Épidémiologie
Les données épidémiologiques sur les pneumopathies interstitielles diffuses idiopathiques ne sont pas très sûres. Des travaux américains sur le groupe supérieur de toutes les maladies pulmonaires interstitielles ont été parmi d'autres conduits au Nouveau-Mexique. Selon cette étude, la prévalence des pneumopathies interstitielles diffuses idiopathiques (PID) est de 80 cas pour 100 000 habitants pour les hommes et de 67 cas pour 100 000 habitants pour les femmes. Le diagnostic de fibrose pulmonaire[pas clair] ou de fibrose pulmonaire idiopathique contribue pour environ 45 % de tous les cas de maladies pulmonaires interstitielles. Selon cette étude, la prévalence de la fibrose pulmonaire idiopathique s'élève à 20 cas pour 100 000 habitants pour les hommes et à 13 cas pour 100 000 habitants pour les femmes. Comme cette étude a été conduite avant la publication de la nouvelle classification, la prédictivité de ces résultats reste sujette à caution. Une étude plus récente retrouve une prévalence supérieure, avec une probable augmentation dans les pays occidentaux. L'épidémiologie des autres formes de fibrose pulmonaire est beaucoup moins connue.
Bases anatomiques

Coloration à l'hématoxyline et à l'éosine (HE).
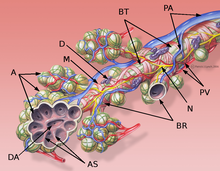
L'interstitium (tissu de soutien) du poumon est constitué de septums interalvéolaires, situés entre les parois des alvéoles pulmonaires. Ces dernières, siège de l'échange gazeux entre sang et air, forment le tissu proprement fonctionnel du poumon (parenchyme). L'interstitium et le parenchyme coopèrent étroitement au fonctionnement du poumon, et constituent une unité fonctionnelle. L'interstitium constitue l'armature de base du poumon et soutient l'architecture des alvéoles, c'est-à-dire de la barrière sang-air pendant le cycle de la respiration. Cet interstitium est constitué de cellules, avant tout spécialisées dans le soutien (fibroblastes), de protéines structurales qu'elles produisent, et en substances telles que le collagène, les fibres élastiques, les protéoglycanes ainsi que d'autres glycoprotéines.
La majeure partie de l’interstitium est formé par des fibres de collagène, qui forment jusqu'à 20 % de la masse sèche des poumons, en majorité du collagène de type I auquel on doit sans doute le rôle principal pour la conservation de la forme et l’élasticité des alvéoles. On ne trouve le type IV que dans les membranes basales des alvéoles et des vaisseaux sanguins. Les collagènes de types III et V ne sont présents qu’en faible quantité dans le tissu pulmonaire (5 à 10 %). Les fibres élastiques forment un réseau à connexions multiples dans l'interstitium du poumon. Elles sont la force motrice de l'expiration.
Les protéoglycanes sont responsables de la géométrie du tissu pulmonaire. Leur fonction exacte dans le fonctionnement du poumon n'est pas connue en détail. On trouve dans le poumon de l'acide hyaluronique, du sulfate de chondroïtine A et C, du sulfate de dermatane, de l'héparine et du sulfate d'héparine. En outre, parmi les glycoprotéines, on trouve de la fibronectine et de la laminine, qui apparaissent principalement dans les lames basales.
Pathogenèse
On désigne par pathogenèse les mécanismes qui contribuent à l’apparition d'une maladie. Dans les pneumopathies interstitielles diffuses idiopathiques, l'inflammation et la fibrose du tissu pulmonaire jouent un rôle capital. Elles ont dans les diverses formes une importance différente. Mais la pathogenèse n'est pas complètement clarifiée.
Inflammation
Dans la plupart des maladies pulmonaires interstitielles, ainsi que dans la plupart des formes de pneumopathies interstitielles diffuses idiopathiques, la réaction inflammatoire semble jouer un rôle capital. L'examen microscopique retrouve, surtout dans les débuts de la maladie, de grandes quantités de cellules liées à l'inflammation (macrophages, granulocytes et lymphocytes). Les zones fibrosées sont peu nombreuses. La fibrose pulmonaire semble être une conséquence de la réaction d'inflammation. Cette théorie est renforcée par le fait que ces maladies réagissent bien aux traitements anti-inflammatoires et anti-immunitaires. Par l’élimination de l'inflammation qui cause la fibrose pulmonaire, la progression vers cette dernière est éliminée.
Mais la fibrose pulmonaire idiopathique, et peut-être aussi la pneumonie interstitielle aiguë sont une situation à part. L'hypothèse qu'une réaction d'inflammation soit une condition pour l'apparition d'une fibrose pulmonaire ne semble pas tenir dans ces cas. La réaction d'inflammation joue ici apparemment un rôle secondaire, voire n'est qu'une réaction d'accompagnement de la fibrose pulmonaire.
Fibrose pulmonaire
La fibrose pulmonaire est une réaction pour laquelle une cicatrisation du tissu pulmonaire a lieu. Pour l'apparition de la fibrose pulmonaire, divers types de cellules jouent un rôle clef. Les plus importantes sont les fibroblastes, les cellules endothéliales et les cellules épithéliales des alvéoles. Après un dommage au tissu pulmonaire, dont la cause est inconnue dans le cas de la pneumonie interstitielle idiopathique, il se passe alors soit une inflammation et à la suite une activation des fibroblastes, soit une activation directe, c'est-à-dire sans inflammation antérieure. Ceci dépend du modèle que l'on utilise pour l’étude. L'activation des fibroblastes est initiée par diverses substances signal, par exemple les facteurs de croissance tels que le Transforming growth factor beta 1 (TGF-β1) et diverses interleukines relâchées par d'autres cellules, et par les fibroblastes eux-mêmes. Ceci conduit à une prolifération des fibroblastes, ainsi qu'à la néoformation de substance de base et de fibres de tissu conjonctif. Normalement, cette réaction est fortement régulée, c'est-à-dire qu'après la réparation d'un défaut ou d'une blessure, l'activité des fibroblastes est arrêtée : d'une part par la diminution des substances signal, d'autre part par la mort programmée (apoptose) des fibroblastes. Dans la fibrose pulmonaire, ces mécanismes de régulation ne fonctionnent pas de manière convenable. Ceci conduit à la constitution d'une trop grande quantité de tissu conjonctif. Les septums alvéolaires deviennent plus épais, ce qui conduit à des troubles des échanges gazeux ou de la diffusion (insuffisance respiratoire). En outre, le poumon perd de son élasticité et dans l'inspiration ne peut se dilater suffisamment qu'au prix d'un travail supérieur. Il apparaît une insuffisance respiratoire chronique restrictive. Les deux facteurs : perturbation des échanges gazeux et insuffisance respiratoire, conduisent au symptôme principal de la fibrose pulmonaire, la dyspnée. Dans les stades évolués de la fibrose, les fibroblastes peuvent envahir la lumière des alvéoles et y former du nouveau tissu conjonctif. Il se forme des zones fibreuses dans les alvéoles, que l'on appelle foyers fibrotiques. La structure du poumon dans ces domaines est détruite, ce qui conduit à une perte complète de la fonctionnalité.
Symptômes
Le symptôme majeur des pneumopathies interstitielles diffuses idiopathiques, comme celui de la plupart des maladies pulmonaires interstitielles est la dyspnée, qui, dans les premiers stades, n’apparaît qu'à l’effort musculaire. Comme il s'agit typiquement dans la fibrose pulmonaire idiopathique d'une restriction ventilatoire, les patients ont avant tout des difficultés à inspirer. Dans les stades avancés de la maladie, la dyspnée peut survenir même au repos, selon la forme de maladie, et dans les stades ultimes se transformer en insuffisance respiratoire. Une caractéristique des fibroses pulmonaires est également une toux sèche, donc sans expectoration.
En raison de la limitation fonctionnelle du poumon en ce qui concerne l'échange gazeux et l'élasticité, il peut survenir un manque d'oxygène dans le sang, ce que l'on appelle hypoxémie. Celle-ci peut se traduire sous forme de cyanose, une teinte violacée à bleuâtre de la peau, des muqueuses et des ongles. L'hypoxémie chronique peut se manifester par l'hippocratisme digital (doigts en baguette de tambour) et les ongles en sablier (basculement de l'ongle vers l'extrémité du doigt, si bien que le creux situé à la racine de l'ongle disparaît). A un stade plus avancé, le manque important d'oxygène peut provoquer des troubles de l'état de conscience.
Diagnostic
Anamnèse et examen clinique
Au début de l'examen, il convient de relever de manière fouillée les prodromes de la maladie (anamnèse). On y questionnera le patient entre autres sur les symptômes actuels, sur les maladies précédentes connues, sur les médicaments pris et les maladies dans la famille. Cette anamnèse a une haute importance, car elle permet d'exclure d'autres maladies et de poser un diagnostic provisoire.
Dans l’espace germanophone, il existe pour les maladies pulmonaires un questionnaire de Francfort, qui peut s'avérer utile. Ce questionnaire est rempli par le patient, et il prend en compte presque tous les points de vue importants du point de vue des maladies pulmonaires. Les symptômes des pneumopathies interstitielles diffuses idiopathiques ne sont pas spécifiques. La dyspnée que l'on retrouve dans toutes les formes d'IIP indique qu'il pourrait s'agir d'une maladie pulmonaire, mais elle peut être provoquée par de nombreuses autres maladies, comme des maladies cardiaques. Ceci est valable de manière semblable pour tous les symptômes mentionnés. Le diagnostic des pneumopathies interstitielles diffuses idiopathiques, ou d'un soupçon dans ce sens, ne peut donc jamais être obtenu uniquement par l'anamnèse.
L'examen clinique consiste en une inspection de l’ensemble de la surface du corps, la percussion de la cage thoracique, l'auscultation des poumons avec un stéthoscope. L'examen clinique pourra détecter des modifications typiques de la fibrose. On peut ainsi entendre à l’auscultation un cliquetis grésillant, accompagné de fins pétillements vers la fin de l'inspiration et de l'expiration. La percussion peut mettre en évidence aussi une position haute des poumons. Les symptômes déjà évoqués de cyanose, de doigts en baguette de tambour et d'ongles en sablier sont recherchés. Ce dernier ne permet cependant pas un diagnostic certain de fibrose pulmonaire idiopathique, mais peut rétrécir le champ des maladies possibles.
Examens complémentaires
En présence d'un soupçon de pneumopathies interstitielles diffuses idiopathiques, on doit appliquer un ensemble de procédés techniques d'examen, en particulier l'examen du fonctionnement du poumon ainsi que la radiographie thoracique. Pour l'évaluation de la fonction pulmonaire, la pléthysmographie pneumologique joue un rôle important. Une fibrose pulmonaire conduit à une diminution de la ventilation qui peut être découverte par cette méthode. Mais dans les premiers stades de la maladie, cette diminution peut être trop faible pour être mise en évidence. Une analyse des gaz du sang avant et après effort peut dès les stades précoces donner des indications sur la présence d'une IIP.
Les modifications fibrotiques peuvent en outre être rendues visibles sur les radiographies des poumons. Ici aussi, les modifications dans les stades précoces peuvent être trop faibles pour être détectées. Les signes typiques d'une fibrose pulmonaire sur le cliché radiographique sont des consolidations, des élargissements de bronches par traction, et des ombres laiteuses. Les consolidations proviennent de tissu fibrotique dans les alvéoles, et se présentent sur le cliché comme des surfaces claires, puisqu'elles sont plus riches en matière que les alvéoles remplies d'air. Les élargissements de bronches par traction sont provoqués par la traction qu'exerce sur elles le rétrécissement du tissu pulmonaire fibrosé. Les ombres laiteuses sont aussi des zones claires provoquées par la destruction de l’architecture du poumon.
Le scanner thoracique, dit à haute résolution permet l'identification de la plupart des cas des pneumopathies interstitielles diffuses idiopathiques avec une différenciation entre les diverses formes de la maladie. Les signes typiques de la fibrose sont en plus des élargissements de bronches par traction et des ombres laiteuses, l'aspect du poumon en nid d'abeilles (angl. honeycombing). Ce nom vient de l’aspect d'une structure du poumon analogue à celle d'un rayon de ruche. Ces nids d'abeille sont provoqués par la dégénérescence du tissu du poumon.
Si un diagnostic ou une différenciation n'est pas possible par cette méthode, il faut avoir recours à des méthodes diagnostiques invasives. La bronchoscopie avec lavage bronchoalvéolaire et biopsie transbronchique est faite en premier lieu. Si les résultats ne sont pas concluants, il faut procéder à une biopsie chirurgicale du poumon, qui reste l'examen de référence. Selon les recommandations de la conférence de consensus de 2002, il faut opérer sur au moins trois échantillons de lobes pulmonaires différents, d'une taille minimale de 2 cm.
Évolution
Les pneumopathies interstitielles diffuses idiopathiques peuvent être bénigne au point de ne présenter que quelques symptômes, mais elles peuvent connaître une aggravation progressive conduisant au décès.
Dans d'autres cas, l'évolution se fait parfois vers une détérioration brutale, après un palier relativement stable.
Les pneumopathies interstitielles diffuses idiopathiques ont en règle générale un mauvais pronostic, avec une espérance de vie comprise entre 2,5 et 3,5 ans.
Traitement
Traitement médicamenteux
Le traitement des pneumopathies interstitielles diffuses idiopathiques repose sur deux types de médicaments : glucocorticoïdes (comme la prednisolone), et immunosuppresseur, notamment l'azathioprine, le cyclophosphamide, sans preuve formelle d'efficacité ou des interférons gamma qui ont déçu. L'efficacité des médicaments dépend de la forme de fibrose dont souffre le patient. Alors que le traitement médicamenteux dans le cas de la fibrose pulmonaire idiopathique ou de la pneumonie interstitielle aigüe n'a qu'un effet nul ou très temporaire sur l'évolution de la maladie, les autres formes répondent bien mieux, si bien que l'on peut attendre une guérison, ou tout au moins un accroissement substantiel du temps moyen de survie.
La réponse différente au traitement contre l'inflammation est probablement due à un mécanisme différent des différentes formes. Dans le cas d'une fibrose pulmonaire idiopathique, la fibrose est l'élément majeur, et la réaction d'inflammation n'en est que l'accompagnement ou la conséquence. Pour les autres formes, inversement, c'est l'inflammation de l'interstitium pulmonaire qui détermine le devenir de la maladie, et qui n'est dépassée par la fibrose que dans les stades terminaux de la maladie.
Les substances qui pourraient inhiber la progression de la fibrose constituent un grand espoir dans le traitement des pneumopathies interstitielles diffuses idiopathiques. Un grand nombre de ce type de substances est actuellement (2008) en essai clinique, mais elles ne sont pas encore autorisées .
Transplantation du poumon
On peut envisager une transplantation du poumon quand les pneumopathies interstitielles diffuses idiopathiques en arrivent à un stade terminal, et ne réagissent pas aux médicaments. Pour les fibroses avancées du poumon, la transplantation augmente le temps de survie. La transplantation d'un seul poumon est aussi efficace que celle des deux poumons. Malheureusement, l'indication pour la transplantation n'est généralement pas posée à temps : plus de 30 % sont décédés en raison des temps d'attente.
Différentes formes
Fibrose pulmonaire idiopathique
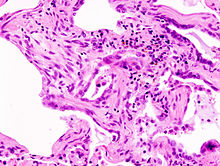
La fibrose pulmonaire idiopathique est la plus fréquente des pneumopathies interstitielles diffuses idiopathiques. Elle a en même temps le pronostic le plus sombre. Le temps moyen de survie après le diagnostic est de trois ans, et le taux de survie à 5 ans est de 20 à 40 %. Les patients au moment du diagnostic ont généralement plus de 60 ans, et les hommes sont plus touchés que les femmes.
Le diagnostic se fait après enquête étiologique négative grâce à la combinaison de critères scanographiques et éventuellement anatomopathologies (après biopsie chirurgicale pulmonaire). L'aspect histologique typique est celui d'une UIP (de l'anglais « Usual Interstitial Pneumonia ») ou PIC en français (pneumonie interstitielle usuelle) qui se caractérise par une fibrose disséminée, des amas de fibroblastes, une distorsion architecturale marquée dans les régions septales et pleurales avec une structure en nid d'abeilles du poumon. Le modèle de l'UIP est caractéristique mais pas spécifique, et se présente dans d'autres variétés. Sur le scanner haute résolution, on parle aussi dans les formes typiques de tableau de PIC avec association de réticulations (dessins de réseaux et de lignes), d'élargissement des bronches par tractions, d'opacités floues dites en verre dépolien général peu étendues, d'aspect en nid d'abeilles dans les bases et les régions périphériques sous pleurales (destruction irréversible de l'architecture normale du poumon). Ces modifications sont le plus souvent bilatérales mais asymétriques et dans les bases des poumons.
Le début de la maladie est sournois (conduisant bien souvent à un retard diagnostique) et se caractérise par une dyspnée croissante. On note d'autres signes évocateurs: des bruits de velcro (comme le scratch des chaussures) à l'auscultation, une toux sèche et tenace (signe variable)et souvent des doigts modifiés avec une forme dite en "baguette de tambour" (hypertrophie de l'extrémité digitale).
L'atteinte ne répond pas à une thérapie aux glucocorticoïdes à la différence d'autres types de pneumopathies interstitielles diffuses idiopathiques, même combinés avec des immunosuppresseurs. De multiples traitements ont été utilisés dans cette maladie sans succès. En 2012, la pirfénidone (Esbriet) a été le premier médicament à obtenir l'autorisation de mise sur le marché dans cette maladie. C'est le seul traitement médicamenteux, à ce jour, ayant prouvé une efficacité dans les formes légère à modérées de la FPI avec une réduction du risque de mortalité de 30% et un ralentissement de la dégradation de la fonction respiratoire. La seule mesure thérapeutique curative actuellement reste la transplantation pulmonaire quand l'état général du patient le permet.
Pneumonie interstitielle non spécifique
La pneumonie interstitielle non spécifique est, parmi les pneumopathies interstitielles diffuses idiopathiques, la deuxième forme la plus fréquente, et celle qui a le plus de variantes. Les patients ont généralement entre 50 et 60 ans, et sont ainsi plus jeunes en général que ceux de la fibrose idiopathique. Les hommes et les femmes sont également touchés.
Elle ne montre pas de localisation typique. Les modifications sont, bien plus, homogènes sur l'ensemble du poumon et généralement réparties symétriquement. Le type histologique est dénommé NSIP. Il existe deux sous-groupes de la NSIP, un sous-type cellulaire et un sous-type fibrotique. Dans le premier, le tableau histologique est dominé par des cellules inflammatoires, dans le second se distinguent en plus des zones marquées de fibrose. Le cliché radiographique est riche en variantes, comme le type histologique. À côté d'ombres laiteuses, on trouve aussi des micronodules et des nid d'abeilles. Dans les stades évolués, on ne peut plus reconnaître la structure normale des poumons sur les radiographies ou sur les tomodensitométries, car elle est détruite par les élargissements de bronches par traction, les kystes et les consolidations.
La symptomatologie ne diffère que peu de celle de la fibrose pulmonaire idiopathique. Elle montre néanmoins une évolution moins brutale, progresse plus lentement, et a un meilleur pronostic. Cependant, le pronostic dépend du sous-type, étant meilleur pour la variété cellulaire que pour la fibrotique, car elle répond mieux au traitement anti-inflammatoire. Dans l'ensemble, le traitement médicamenteux est plus prometteur que dans le cas d'une forme idiopathique. Comme les modifications morphologiques de la pneumonie interstitielle non spécifique sont variées, le diagnostic réserve au médecin les plus grandes difficultés, par rapport aux autres pneumopathies interstitielles diffuses idiopathiques. Ceci est en particulier vrai pour le sous-type fibrotique.
Pneumonie à organisation cryptogène (COP)
La pneumonie à organisation cryptogène (idiopathique) désigne un tableau de maladie dont les propriétés cliniques, radiologiques et pathologiques sont relativement caractéristiques. Il n'y a aucune différence entre sexes et l'âge moyen des patients varie entre 50 et 60 ans. Les non-fumeurs sont environ deux fois plus atteints que les fumeurs de cigarette, sans explication trouvée.
Le type histologique est désigné sous le nom de pneumonie organisante est caractérisé par l'apparition de tissu granulomateux qui remplit les bronchioles et les alvéoles. Le parenchyme du poumon n'est pas détruit par ces transformations. Ce type n'apparaît que rarement sous la forme idiopathique. Souvent, d'autres causes apparaissent responsables de ces altérations, comme des connectivites, ou des maladies infectieuses ou toxicologiques. Une histologie similaire apparaît aussi dans la bronchiolite oblitérante. C'est pourquoi la COP a été désignée comme pneumonie organisante de la bronchiolite oblitérante (BOOP). Pour éviter les confusions avec le tableau clinique de la bronchiolite oblitérante, qui a son profil propre, cette dernière dénomination a été abandonnée. Sur les clichés radiographiques et tomodensitométriques, ce tissu granulomateux apparaît comme des zones de consolidation, qui sont localisées dans le domaine entourant les bronches (péribronchial) ou juste sous la plèvre (subpleural). Autour des consolidations peuvent apparaître des ombres laiteuses.
La maladie commence d'habitude avec des symptômes généraux, comme le malaise, la fièvre, la perte de poids et la toux sèche. Ces symptômes s'aggravent pendant un à trois mois. La COP se laisse bien traiter avec des glucocorticoïdes, et possède un bon pronostic. Souvent, la maladie reprend après l'interruption du traitement. Ceci s'appelle une récidive. Les récidives peuvent être traitées à nouveau par des glucocorticoïdes.
Pneumonie interstitielle aigüe
Contrairement aux autres pneumopathies interstitielles diffuses idiopathiques, la pneumonie interstitielle aigüe possède une évolution aigüe. Elle se caractérise par la survenue subite des symptômes et débouche couramment sur une détérioration chronique de la respiration (insuffisance respiratoire). Cette forme a le plus mauvais pronostic. Dans la moitié des cas, l'évolution est fatale, la plupart des décès survenant entre un et deux mois après le début de la maladie.
Avant sa survenue, on constate souvent une infection des voies respiratoires supérieures, accompagnée de sensation générale de maladie, de courbatures, de fièvre et de frissons. Puis le patient ressent en quelques jours une dyspnée, qui ne se manifeste au début qu'à l'effort. Dès le début, il existe un manque d'oxygène dans le sang (hypoxémie). Par ailleurs, l'auscultation fait clairement entendre un cliquetis grésillant, qu'il faut interpréter comme signe de consolidation dans le cadre d'une diminution de la ventilation. L'hypoxémie provoque en quelques semaines une dyspnée au repos, qui peut dégénérer en insuffisance respiratoire. À ce stade, il faut faire respirer de l'oxygène au patient, et éventuellement le placer sous ventilation mécanique.
Le type histologique est un dommage alvéolaire diffus (DAD), que l'on ne peut pas distinguer des modifications pathologiques liées au syndrome de détresse respiratoire aiguë (SDRA) de l’adulte. La seule différence tient dans le contexte, le SDRA survenant avant tout dans le cadre d'une septicémie ou d'un choc, la cause de pneumonie interstitielle aigüe n'est pas connue.
Louis Virgil Hamman et Arnold Rice Rich ont décrit en 1944 de tels cas, qui ont été plus tard englobés sous l'appellation de syndrome de Hamman-Rich, correspondant vraisemblablement à cette forme de pneumopathie interstitielle.
Bronchiolite respiratoire avec maladie pulmonaire interstitielle et pneumonie interstitielle desquamative
Les maladies désignées sous le nom de Bronchiolite respiratoire avec maladie pulmonaire interstitielle (RB-ILD) et pneumonie interstitielle desquamative (DIP) sont des maladies d'apparence semblable, mais que l'on peut distinguer. Ces deux maladies apparaissent ches les fumeurs, exclusivement pour la RB-ILD, et la plupart du temps pour la DIP. L'âge moyen de début de la maladie se situe entre 40 et 50 ans, et les hommes sont environ deux fois plus touchés que les femmes. La RB-ILD est la variante symptomatique de la bronchiolite respiratoire, une inflammation des bronchioles, que l'on détecte en général par hasard chez les fumeurs. Le type histologique des variantes asymptomatique et symptomatique est désigné comme bronchiolite respiratoire (RB).
La forme desquamative est considérée par certains experts comme une variante évoluée de la RB-ILD. Ceci peut néanmoins être mis en doute, puisque cette première, contrairement à la RB-ILD apparaît à l'occasion aussi chez les non-fumeurs, et aussi, en raison des différences morphologiques substantielles (voir infra). La classification de consensus prévoit, en raison de ce doute, une séparation entre les deux variantes. Le concept de DIP a été introduit en 1969 par Liebow et Carrington, sous l'hypothèse fausse qu'il s'agissait pour ces amas de cellules d'exfoliations ou de desquamations de cellules de l'épithélium alvéolaire. Néanmoins l'appellation de DIP a été conservée dans la classification actuelle, en particulier parce que la DIP apparaît rarement, et on ne l'a pas remplacée par la désignation mieux adaptée de pneumonie à macrophages alvéolaires. Le type histologique de la DIP est aussi désigné comme DIP.
L'apparence histologique des deux formes est caractérisée par de nombreuses accumulations de macrophages pigmentés en brun dans le poumon. Dans la RB-ILD, ils sont localisés de préférence dans la lumière des bronchioles, tandis que dans la DIP, ils sont de façon prédominante dans celles des alvéoles. Dans la DIP, une fibrose peu marquée est caractéristique. La distribution des modifications morphologiques est différente entre les deux maladies. Tandis que dans la RB-ILD elles sont plutôt localisées dans les lobes supérieurs des poumons, dans la DIP, la localisation est subpleurale, avec une prédominancce dans les lobes inférieurs. Ce type de localisation se voit particulièrement bien à la tomodensitométrie à haute résolution. Dans la RB-ILD, on perçoit des nodules centrilobulaires, tandis que les ombres laiteuses sont caractéristiques de la DIP.
La symptomatique clinique est caractérisée par un lent développement de la dyspnée et de la toux sèche d'irritation. Environ la moitié des patients développent des doigts en baguette de tambour. Les deux formes répondent bien aux glucocorticoïdes et ont un bon pronostic. Ce n'est que rarement que la DIP provoque une insuffisance respiratoire conduisant à une haute létalité.
Pneumonie interstitielle lymphoïde
La forme lymphoIde survient de préférence chez les femmes, avec un sommet vers la 50e année. Dans la forme idiopathique, elle est la plus rare des pneumopathies interstitielles diffuses idiopathiques. Il est bien plus courant de la rencontrer dans le cadre de maladies auto-immunes ou de déficit immunitaire.
Le type histologique est désigné comme le diagnostic clinique par LIP, et se caractérise par une infiltration des septums alvéolaires par des lymphocytes et des macrophages, ainsi que par une formation péribronchiale de tissus lymphoïdes associé aux muqueuses. Les modifiations sont distribuées de manière diffuse dans tout le poumon. À la tomodensitométrie à haute résolution, les ombres laiteuses sont caractéristiques.
Les patients n'ont que de faibles symptômes et souffrent avant tout de dyspnée et de toux. Dans les formes secondaires, ce sont les symptômes de la maladie causale qui sont au premier plan. Dans de rares cas, la LIP peut évoluer en une fibrose pulmonaire, ou un lymphome non-hodgkinien. En l’absence de ces complications, la LIP a un bon pronostic. Le traitement consiste en l'administration de glucocorticoïde, dont l'efficacité dans cette forme d'IIP reste empirique.
Chez les animaux
Le groupe des pneumopathies interstitielles diffuses idiopathiques chez les animaux a jusqu'à présent été peu étudié. C'est pourquoi aucun animal modèle approprié pour les études fondamentales n'a encore été identifié : la fibrose pulmonaire induite par la bléomycine ches les rongeurs n'est une maladie semblable que par ses symptômes, mais ne remplit pas les conditions d'un modèle adéquat.
On trouve ce genre de maladie chronique-idiopathique chez certaines races de chiens terriers (West Highland White Terrier, Staffordshire Bull Terrier, Scottish Terrier). La fibrose pulmonaire idiopathique canine survient avant tout chez des individus âgés, et correspond à la COP chez l'homme. Chez les chats, la littérature ne mentionne que peu de cas décrits. Selon une étude récente, ils correspondraient à la forme humaine de fibrose interstitielle pulmonaire et sont probablement dus à un défaut des pneumocytes de type II
Chez les oiseaux, il n'existe qu'un seul cas rapporté, chez une amazone à front bleu.

UIP : pneumonie interstitielle usuelle — IPF : Fibrose pulmonaire idiopathique — AIP : Pneumonie interstitielle aigüe — NSIP : Pneumonie interstitielle non spécifique
DIP : Pneumonie interstitielle desquamative — RB-ILD : Bronchiolite respiratoire avec maladie pulmonaire interstitielle
BIP : Pneumonie interstitielle bronchiolitique — BOOP : Bronchiolite oblitérante avec pneumonie organisante — COP : Pneumonie interstitielle cryptogène
LIP : Pneumonie interstitielle lymphoïde — LPD : Maladies lymphoprolifératives
GIP : Pneumonie à cellules géantes — Hartmetallfibrose : Fibrose des métaux durs.
Historique
La première description d'une maladie interstitielle remonte à 1892, et vient du médecin canadien William Osler. Il a déjà reconnu la multiplicité des manifestations cliniques, et attira l'attention sur la nécessité, et la difficulté, d'une classification plus fine de ces maladies.
L'interniste Louis Virgil Hamman et le pathologiste Arnold Rice Rich ont décrit en 1944 quatre cas de patients atteints d'une fibrose interstitielle diffuse. On nomma ce tableau clinique syndrome de Hamman-Rich. Ce concept a été ensuite un certain temps utilisé pour toutes les maladies où survenait une fibrose diffuse du poumon d'origine inconnue, bien qu'il s'agisse dans les cas décrits d'évolutions aigües. Probablement, les auteurs ont décrit ce qui correspond actuellement à une pneumopathie interstitielle aiguë.
La première classification histologique des pneumopathies interstitielles diffuses idiopathiques est due aux deux pathologistes Averill Abraham Liebow et Charles B. Carrington (1969). La classification d'alors distinguait cinq types histologiques, qui ont été rassemblés sous le concept global de pneumopathies interstitielles diffuses idiopathiques. Le syndrome de Hamman-Rich a été rangé comme variante aigüe de la pneumonie interstitielle usuelle. En 1997, la classification de Liebow-Carrington a été développée en 1997 parAnna-Luise A. Katzenstein, puis en 1998 en collaboration avec Jeffrey L. Myers, et ajustée à l’état actuel de la recherche. La cause de la pneumonie à cellules géantes a été entretemps trouvée. Elle est déclenchée par l'inhalation de poussières métalliques, et maintenant désignée comme fibrose des métaux durs. La pneumonie interstitielle lymphoïde a été rangée dans les maladies lymphoprolifératives
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Idiopathische interstitielle Pneumonie » (voir la liste des auteurs).
Sources
- (de) J. Müller-Quernheim, Interstitielle Lungenerkrankungen., Stuttgart, Thieme, (ISBN 3-13-132281-0)
- (de) H. Schweisfurth et coll., « Wie werden interstitielle Lungenerkrankungen in Deutschland diagnostiziert? », Pneumologie, vol. 57, , p. 373-382 (lire en ligne)