Myopathie de Duchenne
| Causes | Mutation |
|---|---|
| Symptômes | Faiblesse musculaire (en), cardiomyopathie et amyotrophie |
| Traitement | Corticoïde, chirurgie, ventilation artificielle, physiothérapie, thérapie génique et ergothérapie |
|---|---|
| Médicament | Eteplirsen, déflazacort et ataluren |
| Spécialité | Neurologie |
| OMIM | 310200 |
|---|---|
| DiseasesDB | 3985 |
| MedlinePlus | 000705 |
| MeSH | D020388 |
| Patient UK | Duchenne-muscular-dystrophy |
| Myopathie de Duchenne | |
| Référence MIM | 310200 |
|---|---|
| Transmission | Récessive à l'X |
| Chromosome | X p21.2 |
| Gène | DMD |
| Empreinte parentale | Non |
| Mutation | Délétion, duplication |
| Mutation de novo | 23 % |
| Anticipation | Non |
| Incidence | 1 sur 3 500 naissances de garçons - 1 sur 100 000 naissances de filles |
| Pénétrance | complète |
| Maladie génétiquement liée | Aucune |
| Diagnostic prénatal | Possible |
| Liste des maladies génétiques à gène identifié | |
|
modifier |
|
La myopathie de Duchenne (DMD) est la plus grave des manifestations en rapport avec un déficit de la dystrophine qui permet aux muscles de résister à l'effort : sans elle, les fibres musculaires dégénèrent. C'est donc une maladie évolutive.
La maladie peut toucher tous les muscles dont le muscle cardiaque. Cette cardiomyopathie est la principale responsable de la mortalité de cette maladie. Quand le diaphragme est atteint par la maladie cela entraîne un arrêt respiratoire ce qui peut être une autre cause de mortalité.
Elle doit son nom à Guillaume Duchenne, qui en fit la description en 1858.
Les maladies en rapport avec les anomalies de la dystrophine s'appellent des dystrophinopathies.
Maladies incluses
- Myopathie de Becker
- Cardiomyopathie en rapport avec une anomalie de dystrophine.
Autres noms de la maladie
- Dystrophie musculaire de Duchenne et Becker
- Myopathie de Duchenne et Becker
- Dystrophinopathie
Étiologie
La maladie est due à une mutation du gène DMD situé au niveau du locus 21.2 du chromosome X codant une protéine appelée dystrophine.
Les remaniements génétiques responsables des anomalies de fonctionnement du gène sont des délétions (responsables de 65 % des myopathies de Duchenne et 85 % des myopathies de Becker) et des duplications (responsables de 6 % des myopathies de Duchenne). Le reste des remaniements génétiques comprennent des micro délétions, des substitutions impliquant un unique nucléotide, des insertions et des mutations lors de l'épissage (splicing mutations).
Ces mutations du gène entraînent soit un déficit complet de la production de dystrophine (myopathie de Duchenne), soit une altération de cette dernière devenant moins fonctionnelle (myopathie de Becker).
Cependant, près de 50 % des myopathies de type Duchenne conservent de rares fibres musculaires synthétisant la dystrophine.
Histoire
Cas notables
- Alfredo ("Dino", "Alfredino") Ferrari (né en janvier 1932 à Modène), le fils d'Enzo Ferrari est décédé le 30 juin 1956 à Modène à l'âge de 24 ans.
- Le rappeur Darius Weems avait la maladie et a utilisé sa notoriété pour sensibiliser et financer le traitement et Il est décédé à l'âge de 27 ans.
Incidence
L'incidence est estimée de 1 sur 4 000 à 1 sur 3 500 naissances de garçons. Seuls les garçons sont atteints (sauf quelques exceptions rares, 1 femme sur 50 000 000) et les femmes sont transmettrices. Elles peuvent être exceptionnellement atteintes (nécessite d'être homozygote sur le gène).
Description
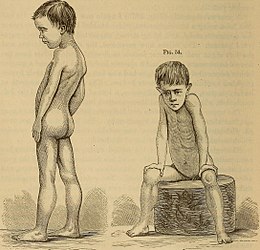
Elle se manifeste essentiellement par une faiblesse musculaire symétrique touchant plus les muscles proximaux que distaux due à une dégénérescence du tissu musculaire, elle-même due à une mutation du gène de la dystrophine.
- échelle de l'organisme : faiblesse musculaire
Diagnostic
Le diagnostic est souvent réalisé après l'âge de 2 ou 3 ans, c’est-à-dire après l'apparition des premiers signes cliniques. On peut réaliser :
- une biopsie musculaire ;
- une prise de sang (taux de CPK) ;
- un électrocardiogramme.
Un des premiers signes avant-coureurs correspond au signe de Gowers : le jeune enfant a du mal à se remettre debout et doit se propulser à l'aide de ses bras et du sol ou en s'appuyant sur son propre tronc. Ce signe clinique est dû à une insuffisance de la ceinture pelvienne et des muscles glutéaux comme le grand fessier.
Clinique
Souvent il existe une histoire familiale de maladie récessive liée à l'X. La présence de fasciculations musculaires ou de trouble de la sensibilité exclut le diagnostic de myopathie.
Myopathie de Duchenne
- Début de la symptomatologie avant 5 ans.
- Vers 3 ans : troubles de la marche :
- difficulté à courir, à sauter, marcher ;
- difficulté à monter les escaliers (aide des membres supérieurs) ;
- signe de Gowers ;
- façon de marcher : recurvatum, dos projeté en arrière, élargissement du polygone de sustentation (écarte les pieds) ;
- difficulté à tenir debout sur 1 pied.
- 5-6 ans : problème de locomotion s'aggrave.
- Vers 10 ans :
- perte de la marche donc l'enfant se déplace en fauteuil roulant ;
- les déformations apparaissent : début d'équins, flexum des coudes, genoux, hanches, scoliose ;
- atteinte du diaphragme ;
- cardio-myopathie.
- Apparition de faiblesse musculaire symétrique touchant plus les muscles proximaux que distaux.
- Hypertrophie apparente des mollets souvent présente en rapport avec une augmentation de la composante non musculaire des muscles.
- À la fin, l'enfant est tétraplégique complet.
Myopathie de Becker
- Apparition de faiblesse musculaire symétrique touchant plus les muscles proximaux que distaux mais conservation de l'activité musculaire des muscles responsables de la flexion de la nuque
- Hypertrophie apparente des mollets souvent présente
- Parfois simple faiblesse du muscle quadriceps de la cuisse ou présence de crampe lors de l'activité musculaire
- Perte de la marche (si atteinte importante) pas avant 16 ans
Cardiomyopathie
Une cardiomyopathie peut apparaître entre 20 et 40 ans, évoluant rapidement vers l'insuffisance cardiaque congestive. Cette cardiomyopathie DMD dépendante n'a pas de caractéristique particulière.
Biologique
La valeur de la créatine kinase sanguine ou CPK est constamment augmentée dans les myopathies en rapport avec une anomalie de la dystrophine. En fonction de la pathologie le taux peut varier :
- 100 % des personnes atteintes de myopathie de Duchenne ont, au minimum, un taux multiplié par 10 par rapport à la normale ;
- 100 % des personnes atteintes de myopathie de Becker ont, au minimum, un taux multiplié par 5 par rapport à la normale ;
- La plupart des malades de cardiomyopathie ont une augmentation des CK totales.
Électromyographie
L'électromyographie n'est pas utile pour le diagnostic. Elle permet de distinguer :
- les atteintes primitives musculaires ;
- les atteintes secondaires par lésion du nerf moteur.
Biopsie musculaire
La biopsie montre des lésions non spécifiques de la maladie. Elle n'est pas utile au diagnostic de la maladie de Becker, alors que la coloration à l'antidystrophine permet de montrer l'absence de la protéine dans un tissu sain pour la maladie de Duchenne.
Génétique
Il s'agit d'une mutation récessive sur le chromosome X, ce qui explique que la maladie touche principalement les garçons. Les femmes sont conductrices mais peuvent manifester aussi, dans de rares cas, la maladie (voir schémas de Transmission récessive liée à l'X).
Évolution
Elle se fait vers une aggravation progressive : la quasi-totalité des garçons atteints sont en fauteuil roulant à l'âge de 12 ans. L'espérance de vie, du fait de l'aggravation des troubles respiratoires, est en moyenne d'à peu près 25 ans en 2002. Elle a quasiment doublé en 30 ans grâce à la prévention (prise en charge multidisciplinaire : orthopédique, respiratoire, nutritionnelle, cardiaque, etc.), l'information et l'essor de la ventilation assistée et de la trachéotomie : elle est passée de 25 ans en 1981 à 41 ans en 2011 selon une étude menée en France. Les causes de décès se sont également modifiées avec une progression des décès d’origine cardiaques de 8 % à 44 %. Aujourd'hui, environ 30 % des causes de décès sont cardiaques, avec un fort déclin de la mortalité par insuffisance respiratoire grâce à l'utilisation de la ventilation invasive et de la physiothérapie respiratoire. Actuellement, les infections, l'hémorragie pulmonaire et l'insuffisance rénale sont également des causes de décès.
L'atteinte cardiaque est possible avec fibrose du muscle cardiaque et est détectée à l'échocardiographie dans environ la moitié des cas évolués. Le pronostic dépend essentiellement de l'altération de la fonction systolique.
Diagnostic différentiel
La myopathie de Duchenne est à différencier de la dystrophie musculaire de Becker sévère et de la dystrophie musculaire des ceintures.
Traitement
Le traitement par corticoïdes améliore, à moyen terme (deux ans) la forme musculaire. Il réduit le risque de survenue d'une atteinte cardiaque ainsi que la mortalité globale. Elle est donnée préférentiellement de manière journalière plutôt que de façon discontinue.
L'atteinte respiratoire peut être traitée par une mise sous ventilation mécanique, permettant une prolongation de l'espérance de vie de plusieurs années. Elle peut être aidée par une chirurgie de correction des anomalies de la statique du rachis.
La mise systématique sous périndopril, un inhibiteur de l'enzyme de conversion, dès l'enfance, avant toute atteinte cardiaque, diminue la mortalité globale.
Prise en charge multidisciplinaire
Une prise en charge multi-disciplinaire précoce, coordonnée et au long cours du patient permet une augmentation de son espérance de vie. Les domaines concernés sont :
- la gestion des troubles neuromusculaires : par un neurologiste ou un physiatre pour établir le diagnostic et monitorer la maladie ;
- la réhabilitation avec un masseur-kinésithérapeute ;
- l'endocrinologie notamment lors de la puberté ;
- la nutrition ;
- la pneumologie pour maintenir la fonction pulmonaire ;
- la cardiologie pour prévenir et dépister une éventuelle cardiomyopathie ;
- l'orthopédie : dépistage d'une scoliose et prévention des raideurs articulaires ;
- la santé osseuse par un spécialiste des maladies neuromusculaires pour suivre la fragilité osseuse ;
- l'aide psychosociale : travailleur social pour orienter le patient mais aussi la famille vers une aide psychologique absolument nécessaire ;
- le suivi psychologique : un psychologue spécialisé en neuropsychologie, un psychologue clinicien ou encore un psychiatre sont en charge d'assurer un suivi psychologique indispensable en présence d'une telle pathologie, en accompagnant l'enfant et ses parents dans la recherche de sens et leurs questionnement face à la maladie, par exemple en réalisant un travail de psychoéducation chez ces derniers oui encore à travers de la remédiation cognitive ;
- la gestion des soins de première ligne et les urgences : aide à maintenir une bonne santé au long cours ;
- éducation et soutien lors des périodes de transition : aide à l'éducation, à l'indépendance, à l'accès au logement ou encore au développement de liens sociaux.
Voies de recherche
En thérapie génique, des expériences ont commencé sur des souris, des chercheurs espérant qu'en introduisant le gène codant la dystrophine dans le corps d'un individu, cette protéine pourra être créée normalement par l'individu atteint. Cependant, la dystrophine ainsi synthétisée pourrait éventuellement provoquer une réaction immunologique de la part de l'organisme, rendant ainsi le bénéfice beaucoup moins net.
Une autre voie prometteuse est la technique du saut d'exon (partie d'ADN codante). Elle consiste à faire épisser (ou « sauter ») l'exon muté en ajoutant dans la cellule des brins d'oligo-nucléotides anti-sens, qui vont masquer les sites d'épissage des exons entourant la partie mutée. Le résultat est une dystrophine rétrécie de quelques acides aminés, néanmoins fonctionnelle.
En 2014, des chercheurs français annoncent les succès d'une thérapie génique sur le modèle canin de la maladie.
Quatre ans plus tard, mi-2018 un traitement de thérapie génique testé sur trois enfants aux Etats-Unis leur a permis de retrouver jusqu'à au moins 38 % du niveau normal de dystrophine selon Forbes, permettant à l'un d'entre eux de monter rapidement un escalier alors qu'il devait antérieurement le monter une marche à la fois (selon une vidéo présentée par un investisseur de la société Sarepta Therapeutics de Cambridge, dans le Massachusetts). Les deux autres suivent un traitement similaire proposé par deux autres entreprises (Solid Biosciences ; Pfizer) et l'un de ces deux patients se porte bien selon Derek Lowe sur le blog In the Pipeline, publié par l'AAAS.
Le 17 mars 2021, un petit garçon reçoit pour la première fois une première dose de la thérapie génique GNT 0004 à l'hôpital Trousseau à Paris.
Mode de transmission
Le mode de transmission est dit récessif et lié au gène DMD du chromosome X. Cela signifie que la maladie se déclare chez les individus n'ayant pas d'allèle fonctionnel pour ce gène. Les hommes n'ayant qu'un seul chromosome X, ils ne possèdent qu'un seul allèle : tous les hommes porteurs d'une mutation délétère de ce gène sont donc atteints. Les femmes ont deux chromosomes X : les femmes portant une mutation ne sont pas atteintes car elles possèdent un deuxième allèle non muté. Cependant, dans de très rares cas, certaines femmes développent la maladie en plus d'être porteuses de celle-ci. La maladie ne se développe pas chez les femmes de la même manière que chez les hommes.
Conseil génétique
Évaluation du risque
Les hommes porteurs étant tous atteints, il est impossible qu'un allèle muté soit transmis par un père indemne à sa descendance. En revanche les femmes porteuses ont un risque de 50 % de transmettre l'allèle muté à leur descendance : les fils d'une femme porteuse ont 50 % de risque d'être atteints et les filles ont 50 % de risque d'être conductrices. À noter que le taux de néo-mutation est élevé (estimé entre 23 % et 33 %). Cela signifie que dans 2/3 des cas, les mères d'enfant atteint sont porteuses, et dans 1/3 des cas la mutation n'est pas héritée mais est survenue lors de la production d'un gamète parental. Une mutation ne peut être transmise par un homme indemne, ce qui est à prendre en compte lors de l'évaluation du risque des apparentés. Par exemple, la tante maternelle d'un enfant atteint a un risque d'être porteuse estimé à 22 %, tandis que la tante paternelle a un risque très proche de 0 % : celui de la population générale.
Annexes
Bibliographie
- Histoire des myopathies, Éditions Payot, Paris, 1998 de François Delaporte et Patrice Pinell
- Genetics: aspects théoriques et pratiques, Pr D. Schorderet, IRO_EPFL, polycopié édition 07, p. 2c-5
Liens externes
- Orphanet
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number:310200 [1]
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number:300377 [2]
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number:302045 [3]
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number:300376 [4]
- (en) GeneTests: Medical Genetics Information Resource (database online). Copyright, University of Washington, Seattle. 1993-2005 [5]