Acide γ-aminobutyrique
| Acide γ-aminobutyrique | ||
| ||
 | ||
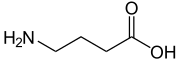
| Structure du GABA. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 4-aminobutanoïque | |
| No CAS | 56-12-2 | |
| NoECHA | 100.000.235 | |
| No CE | 200-258-6 | |
| PubChem | 119 | |
| FEMA | 4288 | |
| Propriétés chimiques | ||
| Formule |
C4H9NO2 [Isomères] |
|
| Masse molaire | 103,119 8 ± 0,004 6 g/mol C 46,59 %, H 8,8 %, N 13,58 %, O 31,03 %, |
|
| pKa | 4,0459 | |
| Propriétés physiques | ||
| T° fusion | 203 °C (décomposition)[réf. souhaitée] | |
| Solubilité | 1 300 g·L-1 dans l'eau à 25 °C[réf. souhaitée] | |
| Précautions | ||
| Directive 67/548/EEC | ||
|
Symboles : Xi : Irritant Phrases R : R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. S36 : Porter un vêtement de protection approprié. |
||
| Écotoxicologie | ||
| DL50 | 12 680 mg·kg-1 (souris, peroral)[réf. souhaitée] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
|
modifier |
||
L'acide γ-aminobutyrique, souvent abrégé en GABA (de l'anglais gamma-aminobutyric acid), est le principal neurotransmetteur inhibiteur du système nerveux central chez les mammifères et les oiseaux. Chez les insectes, il est présent dans tout l'organisme. C'est un neuromodulateur reconnu comme étant inhibiteur chez l'adulte mais excitateur lors du développement embryonnaire humain. Il joue un rôle important chez l'adulte en empêchant l'excitation prolongée des neurones. Il possède par ailleurs un rôle neurotrophique, c'est-à-dire qu'il favorise la croissance de certains neurones.
Les effets inhibiteurs du GABA contrebalancent les effets excitateurs du glutamate. Un déséquilibre entre ces deux neurotransmetteurs est impliqué dans l'épilepsie et l'ischémie cérébrale. Sa formule brute est C4H9NO2.
Localisation
Le GABA serait impliqué dans au moins 30 % des synapses du cerveau. Le second neurotransmetteur inhibiteur est la glycine, qui elle, est plus particulièrement localisée dans la moelle spinale.
Deux types de neurones GABAminergiques se rencontrent :
- les neurones courts qui sont des interneurones ; ils représentent la majorité des neurones GABAminergiques ;
- les neurones longs comme les cellules de Purkinje du cervelet ou les neurones striato-nigraux, impliqués dans la modulation de la transmission dopaminergique nigro-striée. Des neurones contenant du GABA ont été détecté dans l'aire tegmentale ventrale (ATV) du mésencéphale. L'ATV se projette sur le cortex préfrontal via la dopamine et le GABA. De même, on trouve des projections des noyaux du raphé via la sérotonine et le GABA.
Le GABA a été surtout détecté dans des neurones non pyramidaux tels que les cellules granulaires ou stellaires, dans les couches II à IV du cortex. Il a été postulé que les interneurones GABAminergiques exerceraient une influence modulatrice sur le corps cellulaire et le segment initial des axones des cellules pyramidales (glutaminergiques) pour maintenir une activité soutenue de celles-ci dans la maintenance de la mémoire de travail.
Métabolisme du GABA
Le GABA est synthétisé à partir de l'acide glutamique par une enzyme la GD (Glutamate décarboxylase) ou AGD (Acid Glutamique Decarboxylase) [GAD en anglais (Glutamic Acid Decarboxylase, ou Glutamate Decarboxylase)] et est catabolisé par une autre enzyme : la GABA transaminase (GABA-T).
Les métabolismes du GABA et du glutamate (ou acide glutamique) sont intimement liés. Le glutamate vient lui-même de la glutamine et de l'alpha-cétoglutarate, issu du cycle de Krebs (voir figure 1). Le glutamate est ensuite décarboxylé en GABA sous l'influence de la glutamate-décarboxylase (GAD) et de son cofacteur, le phosphate de pyridoxal, dérivé de la vitamine B6.
Les molécules de GABA sont stockées dans des vésicules synaptiques, par l'intermédiaire de transporteurs VGat (vesicular GABA transporter), formés par des protéines transmembranaires. L'arrivée d'un potentiel d'action dans l'extrémité de l'axone ouvre les canaux calciques sensibles au voltage. L'influx de Ca++ provoque par exocytose, la libération du GABA dans la fente synaptique.
Le GABA libéré dans la fente peut suivre plusieurs voies :
- soit être capté par des récepteurs GABAminergiques postsynaptiques et contribuer à la transduction du signal neuronal ;
- soit être recyclé indirectement par une cellule gliale ;
- soit être recyclé directement par un neurone GABAminergique.
Le GABA exerce donc son effet sur ses récepteurs ou est recapté par des transporteurs membranaires spécifiques. Quatre types de transporteurs à haute affinité pour le GABA ont été décrits : GAT-1 à GAT-4. Les transporteurs GAT-1 et -4 sont plus exprimés au niveau des neurones, GAT-2 au niveau des cellules gliales et GAT-2 et 3 au niveau des reins et du foie.
Le GABA recapturé par les neurones ou les cellules gliales est transformé en succinate, qui rentre dans le cycle de Krebs (assurant la synthèse de l'ATP). Puisque ce sont des enzymes mitochondriales (comme la GABA transférase GABA-T) qui assurent la dégradation du GABA, ce sont elles qu'il faut inhiber pour provoquer une augmentation de la teneur des tissus en GABA et donc une augmentation de l'activité des neurones inhibiteurs.
Enzymes et transporteurs, cibles thérapeutiques
Les propriétés inhibitrices du système nerveux central du GABA sont utilisées dans certains traitements de l'épilepsie. Cette maladie neurologique se caractérise par des décharges soudaines d'influx nerveux anormaux dans le cerveau. Un type de traitement vise à diminuer l'excitation neuronale en augmentant la concentration de GABA, ce qui peut se faire en inhibant les enzymes de dégradation GABA-T ou les transporteurs de recyclage GAT :
- le valproate et la vigabatrine (Sabril), inhibiteur de la GABA-T qui dégrade le GABA ;
- la tiagabine (Gabitril), inhibiteur des transporteurs neuronaux et gliaux du GABA,
ou en augmentant la synthèse de GABA, par une supplémentation en vitamine B6, cofacteur de la GAD (enzyme assurant la synthèse du GABA). C'est un traitement des convulsions néo-natales qui s'avère souvent insuffisant et nécessite l'adjonction d'autres molécules anti-convulsivantes.
Les récepteurs du GABA et leur rôle physiologique
À ce jour, deux types de récepteurs de ce neurotransmetteur ont été identifiés :
- une famille de récepteurs ionotropes (ou récepteurs-canaux), perméables aux anions (chlorure et hydrogénocarbonate principalement), nommée GABAA ;
- une famille de récepteurs métabotropes nommée GABAB.
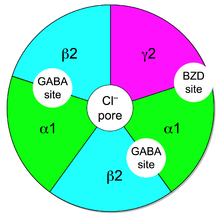
Les récepteurs ionotropes GABAA sont formés de 5 sous-unités glycoprotéiques, entourant un pore laissant entrer le chlore lorsque le GABA se fixe sur leur site de liaison. L'entrée de ces anions Cl−hyperpolarise le neurone postsynaptique et l'inhibe, en rendant le passage d'une vague de potentiel d'action plus difficile :
GABA → récepteur GABAA → entrée de Cl− → hyperpolarisation → ↓potentiel d'action
Les 5 sous-unités de chaque récepteur sont puisées dans un groupe de 19 sous-unités clonées de type α, β, γ, δ, ε, π, ρ et θ. Chaque sous-unité peut comporter plusieurs isoformes : pour α, on a de α1 à α6, pour β on a de β1 à β4, pour γ de γ1 à γ3, pour ρ de ρ1 à ρ3. La plupart des récepteurs pentamériques des mammifères sont formés de deux alpha, deux bêta et un gamma ou delta.
Ces sous-unités des récepteurs GABAA sont elles-mêmes formées de 4 hélices transmembranaires avec leurs extrémités N- et C-terminales toutes les deux extracellulaires (fig. 3 gauche).
En prenant en compte en plus les variants obtenus par épissage alternatif, on obtient un nombre considérable de variants, que l'on classe en trois groupes :
- les récepteurs GABA-A1 à GABA-A6 sont constitués de sous-unités α, β, γ, par exemple le type GABA-A1 est constitué de α1, β2, γ2, selon la stœchiométrie 2α1 2β2 γ2 ;
- les récepteurs GABA-A0 sont constitués de sous-unités α β δ, ou α β ε. Ils sont sensibles à la bicuculline mais insensibles aux benzodiazépines ;
- les récepteurs GABA-A0r ou GABA-C sont constitués par l'association de ρ1, ρ2, ρ3. Ils ont une affinité pour le GABA dix fois supérieure à celle des autres récepteurs GABAA mais sont insensibles à la bicuculline et aux benzodiazépines.
La transmission GABAminergique ordinaire est assurée par des récepteurs GABAA situés sur un neurone postsynaptique et comportant une sous-unité gamma. Mais l'importance d'une inhibition GABAminergique constamment active, dite tonique, s'est imposée depuis une décennie. Le plus souvent cette inhibition tonique est assurée par des récepteurs contenant des sous-unités delta, récepteurs non présents au niveau des synapses mais dans les environs (dits récepteurs extrasynaptiques). Il a été montré que les récepteurs contenant les sous-unités β3 et δ sont hautement sensibles au GABA et à l'éthanol. Le renforcement par l'alcool, d'une manière dépendante de la dose, ressemble à l'effet subjectif de l'intoxication alcoolique. Une étude sur des coupes de cerveau de rats a montré que l'alcool augmente l'inhibition tonique médiée par les récepteurs GABAA extrasynaptiques (α6β3δ) dans les cellules en grain du cervelet. Une étude comportementale associée suggère que l'alcool affecte la coordination motrice en augmentant l'inhibition tonique des cellules granulaires du cervelet.
Les récepteurs GABAB sont des récepteurs couplés à une protéine Gi/o, constitués par sept hélices transmembranaires. Ils ont d’abord été mis en évidence sur les terminaisons présynaptiques où leur stimulation se traduit par une diminution de la libération de neuromédiateur. Ils sont aussi présents au niveau somatodendritique où leur stimulation se traduit par une augmentation de la conductance potassique, associée à une hyperpolarisation.
Les récepteurs GABA, cibles thérapeutiques
Les récepteurs GABAA sont la cible des anxiolytiques de la famille des benzodiazépines qui potentialisent (augmentent) l'effet inhibiteur du GABA sur le système nerveux central. À l'inverse, certaines bêta-carbolines diminuent l'effet inhibiteur du GABA et ont des actions « excitatrices » (convulsivantes, anxiogènes ou pro-mnésiantes) opposées à celles des benzodiazépines.
Les sites de liaison des benzodiazépines sur les récepteurs GABAA sont topographiquement distincts de ceux du GABA. Ces sites, dits allostériques, sont reconnus par des substances actives qui vont moduler l'action du GABA. En général, la liaison de ces substances modulatrices augmente la fréquence et la durée d'ouverture du canal chlore et donc renforce l'action inhibitrice du GABA. Outre les benzodiazépines, on connaît les sites modulateurs allostériques des barbituriques, de l'alcool et des neurostéroïdes. Ces substances ont toutes des propriétés sédatives, anxiolytiques, anticonvulsivantes, antiépileptiques et myorelaxantes.
Il existe deux sites de liaison du GABA sur les récepteurs GABAA situés à l'interface entre les sous-unités α et β. Le site de liaison des benzodiazépines est situé à l'interface entre les sous-unités α et γ.
La présence de la sous-unité γ est indispensable pour la reconnaissance des benzodiazépines. Les effets anxiolytiques, sédatifs et myorelaxants de ces molécules sont assurés par les récepteurs GABAA1, -A2, -A3 et -A5. Par contre, le zolpidem (Stilnox), d'une famille proche des benzodiazépines, ayant une forte affinité pour la sous-unité α1 (et aucune pour α4, α6, δ et ε) et interagissant avec des résidus amino-acyls différents, possède une grande affinité pour les seuls récepteurs GABAA1.
La molécule de GABA ne peut pas traverser la barrière hémato-encéphalique, donc le rôle de neurotransmetteur ne peut être accompli que par le GABA présent et relargué par les neurones et pas par celui apporté par l'alimentation.
GABA et microflore intestinale
En 2016 a été découverte une espèce de bactérie (intestinale) très spécialisée, baptisée KLE1738. Bien qu'en étant éloignée, elle semble dépendre totalement de la biochimie du cerveau pour sa survie, en ce qu’elle ne consomme que le GABA (molécule toxique au-delà d’une certaine dose) pour assurer son métabolisme.
On ne lui connaît à ce jour pas d’autre aliment.
Son activité pourrait en partie expliquer comment chez l'humain (ou d'autres espèces) le microbiome intestinal peut affecter l'humeur.
Des taux bas de GABA ont déjà été liés à la dépression et aux troubles de l'humeur ; en 2011, on avait déjà montré qu’une variété de lactobacille (Lactobacillus rhamnosus) pouvait fortement modifier l'activité du GABA dans le cerveau de souris de laboratoire et modifier leur réponse au stress, et chez les souris chirurgicalement privées du nerf vague (qui connecte directement l’intestin au cerveau) - qui a laissé l'intestin au cerveau - suggérant qu'il joue en quelque sorte un rôle dans l'influence des bactéries intestinales peuvent avoir sur le cerveau.
Un nouveau domaine scientifique est ouvert, parfois dénommé Gut–brain axis pour les anglophones), qui cherche maintenant si d'autres bactéries intestinales qui consomment ou produisent du GABA, pour notamment tester (chez l’animal au moins, dans un premier temps) les effets de leur présence sur le cerveau et le comportement, pour peut-être développer de nouveaux traitements contre des troubles de l'humeur (dépression, anxiété, certaines formes d’agressivité…).
GABA et diabète
En 2016, selon les chercheurs de l'INSERM, le GABA pourrait induire la régénération des cellules bêta du pancréas produisant de l'insuline. Ceci serait utile surtout dans le diabète de type 1, caractérisé par une perte progressive de ces cellules. Cette étude a depuis été contredite par une publication d' indiquant que les résultats n'étaient pas reproductibles.
GABA et luminosité
Il a été découvert chez deux espèces d'insectes (une demoiselle et une sauterelle) un pic de production de GABA à la période de transition du jour vers la nuit, lumière vers obscurité.