Maladie à virus Ebola
| Causes | Virus Ebola transmis par contact direct |
|---|---|
| Transmission | Transmission par contact (d) et haemocontact transmission of pathogen (d) |
| Incubation min | 2 j |
| Incubation max | 21 j |
| Début habituel | Après 2 jours à 3 semaines d'incubation |
| Symptômes | fièvre soudaine, asthénie, myalgie, arthralgie, céphalée, diarrhée, vomissements, douleurs abdominales soudaines, conjonctivite, exanthème, état de choc, œdème cérébral, coagulopathie, infection bactérienne secondaire, pharyngite, ulcérations, hémorragies multiples |
| Complications | Hypovolémie |
| Diagnostic | ARN viral ou anticorps sanguins |
|---|---|
| Différentiel | Paludisme, choléra, fièvre typhoïde, méningite, autre fièvre hémorragique (fièvre de Lassa...) |
| Prévention | Coordination et sécurité sanitaire, acceptation du risque de la viande de brousse, anthropologie et représentation de l'infection et des informations fournies. |
| Traitement | Symptomatique |
| Pronostic | 25-90% de mortalité |
| Spécialité | Infectiologie |
| CISP-2 | A77 |
|---|---|
| CIM-10 | A98.4 |
| CIM-9 | 065.8 |
| DiseasesDB | 18043 |
| MedlinePlus | 001339 |
| eMedicine | 216288 |
| MeSH | D019142 |
La maladie à virus Ebola, également appelée fièvre hémorragique Ebola ou fièvre d’Ebola (en anglais : Ebola virus disease ou EVD), est la maladie provoquée par le virus Ebola, qui touche les primates et d'autres animaux tels que le porc. Il s'agit d'une fièvre hémorragique virale aiguë accompagnée d'une atteinte sévère de l'hémostase et du système immunitaire conduisant à une grave immunodépression. Présentant un tableau clinique identique à celui des affections à virus Marburg, la maladie à virus Ebola est réputée plus grave et le plus souvent mortelle chez l'homme, avec un taux de létalité atteignant parfois 90 % lors des flambées épidémiques. Ces dernières surviennent principalement dans les villages isolés d'Afrique centrale et d'Afrique de l'Ouest, à proximité des forêts de feuillus humides tropicales et subtropicales. Aucun facteur de prédisposition à l'infection n'a été identifié ; toutefois, les personnes de 20 à 30 ans semblent particulièrement sensibles au virus.
Il n'existe pas encore de vaccin ni de traitement spécifique homologué, bien que plusieurs d'entre eux soient localement en cours d'essais cliniques sous le contrôle de l'OMS contre l'épidémie apparue en Afrique de l'Ouest en 2014, tels que le cAd3-ZEBOV, le VSV-EBOV, le favipiravir (Avigan), ou encore le brincidofovir. La prise en charge des personnes atteintes repose avant tout sur des soins palliatifs intensifs. Le virus se transmet à l'homme à partir d'animaux sauvages et circule ensuite au sein des populations humaines par contact avec les fluides corporels de personnes présentant les symptômes de la maladie (à l'issue de la période d'incubation), voire par voie entérale, mais pas par aérosols (voie aérienne). Des chercheurs pensent que des chauves-souris frugivores de la famille des ptéropodidés constituent le réservoir naturel du virus Ebola, bien que les porcs aient été également impliqués dans la transmission d'un virus de même type.
L'épidémie qui a sévi en Afrique de l'Ouest en 2014 et 2015 a été provoquée par un virus très semblable à celui identifié lors de précédentes épidémies en République démocratique du Congo, en République du Congo et au Gabon, une première étude ayant d'abord fait penser à une mutation de ce virus, à 97 % identique à celui que l'on retrouve en République démocratique du Congo. Elle avait provoqué au , selon les données recueillies par l'OMS à partir des informations communiquées par les autorités des dix pays concernés, la mort de 11 323 personnes sur 28 646 cas recensés, soit une létalité globale de 39,5 % ; si la remontée d'informations s'est par la suite progressivement fiabilisée, l'OMS avait cependant averti le 14 août 2014 que « les équipes opérant sur les sites de l'épidémie constatent des signes évidents que les données rapportées sur le nombre de cas et de morts sous-évaluent largement l'ampleur de l'épidémie ».
Une nouvelle épidémie frappe la République démocratique du Congo en 2019, faisant plus de 2 000 morts.
En 2021, plusieurs cas sont à nouveau détectés dans la région de Nzérékoré, au Sud-Est de la Guinée.
Agent infectieux
Comme le virus Marburg, le virus Ebola appartient à la famille des Filoviridae (filovirus), de l'ordre des Mononegavirales (mononégavirus). Il a été décrit pour la première fois en 1976 par David Finkes. Les Filoviridae sont des virus à ARN de forme filamenteuse, d'où leur nom. Le génome du virus Ebola contient sept gènes qui codent neuf protéines différentes.
Le genre Ebolavirus regroupe cinq espèces différentes :
- ebolavirus Zaïre, identifiée au Zaïre en 1976 (la souche découverte en 2014 appartient à cette espèce) ;
- ebolavirus Soudan, identifiée au Soudan en 1976 ;
- ebolavirus Reston, identifiée dans le secteur de Reston aux États-Unis en 1989 ;
- ebolavirus Forêt de Taï (anciennement appelée Ebola-Côte d'Ivoire), identifiée dans le parc national de Taï en Côte d'Ivoire en 1994 ;
- ebolavirus Bundibugyo, identifiée à Bundibugyo, en Ouganda en 2008.
Les deux premières (Zaïre et Soudan) sont responsables de la quasi-totalité des cas humains. Le virus philippino-américano-africain (Reston) semble être transmissible aux humains (par contact de fluides, comme les autres souches, et aéroporté) mais sans donner de signes cliniques.
Le virus Ebola peut être linéaire ou ramifié, long de 0,8 à 1 μm mais pouvant atteindre 14 μm par concatémérisation (formation d'une particule longue par concaténation de particules plus courtes), avec un diamètre constant de 80 nm. Il possède une capside nucléaire hélicoïdale de 20 à 30 nm de diamètre constituée de nucléoprotéines NP et VP30, elle-même enveloppée d'une matrice hélicoïdale de 40 à 50 nm de diamètre constituée de protéines VP24 et VP40 et comprenant des stries transversales de 5 nm.
Action pathogène
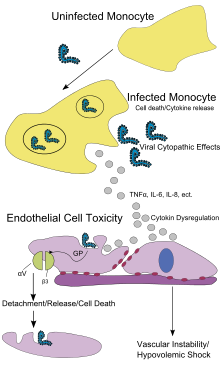
Comme les autres filovirus, le virus Ebola attaque l'ensemble de l'organisme en y provoquant une coagulation intravasculaire disséminée (CIVD) croissante qui dégrade rapidement l'hémostase et le fonctionnement des organes vitaux. L'infection vise en priorité les cellules endothéliales, les phagocytes mononucléaires — monocytes, macrophages, cellules dendritiques, mastocytes — et les hépatocytes. Elle s'accompagne par ailleurs de la rapide neutralisation de certaines populations de lymphocytes T par un effet superantigène.
L'entrée du virus dans les cellules repose sur la protéine NPC1, codée par un gène en 18q11 dont la mutation provoque la maladie de Niemann-Pick type C, une maladie lysosomale caractérisée par l'accumulation de cholestérol non estérifié et de glycolipides dans les lysosomes. Dans les cellules normales, la protéine NPC1 agit avec la protéine NPC2 pour transporter les grosses molécules hydrophobes à travers le système endosome-lysosome ; il a été observé que, lorsque cette protéine n'est pas fonctionnelle, ni le virus Ebola ni le virus Marburg ne peuvent entrer dans la cellule, cette dernière demeurant donc indemne malgré la présence des virus dans son environnement. Une étude complémentaire a montré que le deuxième domaine lysosomal de la protéine NPC1 se lie directement à la glycoprotéine de l'enveloppe virale de ces virus.
Une fois le virus dans la cellule, il sécrète la glycoprotéine soluble sGP et la glycoprotéine structurelle GP. La réplication du virus sature la biosynthèse des protéines dans les cellules infectées et notamment celles du système immunitaire de l'hôte. La glycoprotéine GP forme un complexe trimérique liant le virus aux cellules endothéliales qui tapissent l'intérieur des vaisseaux sanguins, tandis que la glycoprotéine sécrétée sGP forme un dimère qui interfère avec les granulocytes neutrophiles, un type de leucocytes, permettant au virus d'échapper au système immunitaire de l'hôte par inactivation précoce des neutrophiles. Ces leucocytes inactivés servent alors de transporteurs du virus à travers l'ensemble de l'organisme pour notamment contaminer les ganglions lymphatiques, le foie, les poumons et la rate. La présence des particules virales et les dommages causées aux cellules par leur éclosion provoquent la libération de cytokines — TNFα, IL-6, IL-8, etc. — qui sont les molécules de signalisation cellulaire provoquant fièvre et inflammation. L'atteinte des cellules épithéliales par effet cytopathique conduit à la perte de l'intégrité vasculaire, aggravée d'une part par la glycoprotéine virale qui réduit l'efficacité des intégrines responsables de l'adhérence des cellules au sein des structures intercellulaires, et d'autre part par les atteintes hépatiques, responsables de la coagulopathie.
Symptômes et évolution

Les premiers signes de la maladie apparaissent au bout d'une incubation de deux jours à trois semaines, le plus souvent entre 4 et 9 jours. Il s'agit de symptômes non spécifiques rappelant ceux de la grippe : fièvre soudaine, asthénie, myalgie, arthralgie, céphalée, diarrhée, vomissements et douleurs abdominales soudaines. D'autres symptômes initiaux peuvent parfois accompagner ce tableau : conjonctivite, irritation de la gorge, exanthème, insuffisance rénale et insuffisance hépato-cellulaire, avec éventuellement, dès le début de l'affection, état de choc, œdème cérébral, coagulopathie et infection bactérienne secondaire. À ce stade, des hémorragies internes et externes peuvent déjà être observées chez certains patients.
Les symptômes hémorragiques apparaissent généralement quatre à cinq jours après l'infection, comprenant pharyngite, ulcérations buccales et labiales, saignement des gencives et des yeux (conjonctivite hémorragique), et rejets de sang par la bouche (hématémèse), le nez (épistaxis), l'anus (méléna), l'urine (hématurie) ainsi que par saignements vaginaux. On peut également observer des lésions hépatiques, une augmentation du taux sérique de transaminases, une insuffisance médullaire — baisse de la numération leucocytaire (leucopénie) et plaquettaire (thrombopénie) — et une protéinurie.[réf. nécessaire]
En phase terminale de la maladie, on observe habituellement normothermie (absence de fièvre), obnubilation, anurie, état de choc, tachypnée, arthralgie et atteinte oculaire. La coagulopathie est souvent accompagnée d'insuffisance rénale, de lésions hépatiques, d'une atteinte du système nerveux central et d'un choc terminal avec défaillance polyviscérale entraînant la mort.[réf. nécessaire]
Le virus peut également se manifester sous forme d'une virose aiguë accompagnée de malaise et d'une éruption maculo-papuleuse (en). Les femmes enceintes perdent généralement leur fœtus avec des saignements abondants. Le taux de létalité varie de 25 à 90 % selon le type de virus et les conditions de prise en charge, la plupart des morts résultant dans ce cas de la déshydratation consécutive aux atteintes gastriques.
Les sujets touchés par le virus demeurent contagieux tant que le virion est présent dans leur sang, leurs sécrétions, leurs organes et leur sperme ; le virus Ebola a été observé dans le liquide séminal 61 jours après l'apparition des symptômes de la maladie. Une transmission par le sperme sept semaines après le rétablissement clinique du patient a été constatée et une autre cinq mois après le rétablissement.
Le mode d'exposition au virus semble influer sur la sévérité et la rapidité d'évolution de la maladie. Ainsi, lors de l'épidémie de 1976 au Zaïre, déclenchée au Yambuku Mission Hospital (YMH) par la réutilisation d'aiguilles de seringues contaminées par un patient à qui l'on avait injecté de la chloroquine pour traiter ce qu'on pensait être une crise de paludisme, la durée moyenne d'incubation était de 6,3 jours en cas de contamination par injection contre 9,5 jours en cas de contamination par contact, lorsque le mode de contamination avait pu être déterminé. De plus, le taux de létalité s'établissait respectivement à 100 % (85 morts sur 85 patients) et 80 % (119 morts sur 149 patients).
Enfin, il convient de noter que certains individus infectés par le virus Ebola demeurent asymptomatiques ; la cause de cette absence de manifestation pathologique chez ces personnes n'est pas connue.
Diagnostic
Le diagnostic différentiel d'une maladie à virus Ebola doit être évalué par rapport au paludisme, la fièvre typhoïde, la shigellose, le choléra, la leptospirose, la peste bubonique, la rickettsiose, la fièvre récurrente, la méningite, une hépatite et d'autres fièvres hémorragiques virales (fièvre de Lassa, fièvre hémorragique à syndrome rénal (FHSR), fièvre Congo-Crimée, Virus Marburg, etc.).[réf. nécessaire]
Le diagnostic d'une maladie à virus Ebola peut être établi notamment par titrage immunoenzymatique (ELISA) afin de détecter les anticorps anti-Ebola ou les antigènes viraux, par amplification génique précédée d'une transcription inverse (RT-PCR) afin de détecter l'ADN dérivé de l'ARN viral, par microscopie immunoélectronique afin d'observer les particules virales dans les tissus et les cellules, et par immunofluorescence indirecte afin de détecter les anticorps antiviraux. Il existe des kits diagnostiques pouvant dépister l'ARN viral au lit du patient. Ces tests peuvent néanmoins être négatifs au tout début de la maladie.
Les échantillons prélevés sur de tels patients représentent un risque biologique extrême et ne doivent être analysés que dans le cadre d'un confinement adapté en conséquence.[réf. nécessaire]
Prise en charge et prévention
Il n'existe pas de traitement homologué contre la maladie à virus Ebola. La prise en charge des cas graves consiste en des soins palliatifs intensifs destinés à maintenir la fonction rénale et l'équilibre électrolytique tout en limitant les hémorragies et l'état de choc. La nature particulièrement infectieuse et contagieuse de l'agent pathogène implique de prendre d'emblée les mesures prophylactiques appropriées, d'abord par l'instauration d'une zone de quarantaine autour des régions sujettes à des flambées épidémiques, puis au sein des centres de soin afin de limiter les contaminations nosocomiales et la transmission aux personnels soignants. La manipulation du virus est réglementée et ne doit être entreprise qu'au sein de laboratoires P4, ou BSL-4, conçus pour prévenir les risques de contamination.[réf. nécessaire]
Survie du virus hors d'un hôte
Le virus Ebola peut survivre hors d'un hôte et demeurer infectieux pendant plusieurs jours à température ambiante ou à 4 °C, aussi bien dans un liquide que sur une matière sèche (par exemple sur une couverture, des vêtements). Il peut demeurer infectieux sur une période indéterminée à −70 °C ainsi que par lyophilisation. [réf. nécessaire]
Il peut être inactivé par chauffage à 60 °C pendant 30 à 60 minutes, par ébullition pendant 5 minutes ou par exposition aux rayons γ ou ultraviolets. Il est sensible à certains agents chimiques tels que les détergents comme le laurylsulfate de sodium, le paraformaldéhyde, le formaldéhyde, l'acide acétique à 3 % (pH 2,5), l'acide peracétique, la β-propiolactone, le Triton X-100 à 0,25 %, le glutaraldéhyde 2 %, le désoxycholate de sodium, l'éther diéthylique, le méthanol, les désinfectants phénoliques, les solvants lipidiques et l'hypochlorite de sodium (eau de Javel).
Prévention en milieu hospitalier
Les symptômes initiaux d'une maladie à virus Ebola n'étant pas spécifiques, il n'est pas toujours possible d'identifier rapidement les patients qui en sont atteints. C'est la raison pour laquelle les personnels soignants doivent appliquer en permanence les précautions d'usage à tous les patients, et ce indépendamment du diagnostic :
- hygiène des mains ;
- hygiène respiratoire ;
- port d'un équipement de protection individuel, en cas de risque d'éclaboussures ou d'autres contacts avec des matières infectées ;
- sécurité des injections et des rites funéraires.
En présence d'une infection à virus Ebola suspectée ou confirmée, les personnels soignants doivent de surcroît éviter tout contact avec le sang ou les fluides biologiques du patient et toute exposition directe à l'environnement susceptible d'être contaminé. Les contacts rapprochés — à moins d'un mètre — avec ces patients requièrent le port d'une protection faciale (masque chirurgical et lunettes de protection), d'une blouse à manches longues et de gants.[réf. nécessaire]
Le Conseil Supérieur de la Santé belge a publié en 2014 un document dans lequel il définit, pour les hôpitaux belges, la prise en charge des patients chez qui une infection par le virus Ebola ou le virus Marburg est envisagée, suspectée ou confirmée.
Déclenchement des épidémies
Le déclenchement des épidémies n'est pas entièrement compris. Si les chauves-souris frugivores de la famille des ptéropodidés constituent vraisemblablement le réservoir naturel du virus Ebola, on a retrouvé des éléments génétiques de filovirus dans le génome de certains petits rongeurs, de chauves-souris insectivores, de musaraignes, de tenrecidés voire de marsupiaux, ce qui tendrait à prouver une interaction de plusieurs dizaines de millions d'années entre ces animaux et les filovirus. La contamination des primates à partir de ces animaux pourrait survenir par contact ou par consommation d'aliments souillés, et la contamination de l'homme pourrait elle-même résulter de contacts avec des primates contaminés ou par des animaux porteurs du virus.
Transmission interhumaine
Au cours d'une épidémie à virus Ebola, la maladie se transmet entre humains avant tout par contact direct avec les fluides biologiques et les tissus organiques issus de patients présentant les symptômes de la maladie à un stade avancé ou par contacts directs avec les dépouilles. Le rôle de la transmission par voie aérienne (aérosols) dans la diffusion interhumaine du virus a été étudié intensivement depuis des décennies, notamment pour évaluer les risques liés au bioterrorisme dans la mesure où une à dix particules virales aérosolisées suffiraient à contaminer un humain. Ce mode de transmission n'a cependant jamais pu être mis en évidence au cours d'une épidémie, bien que des expériences en laboratoire sur des primates non humains indiquent que ce mode de contamination existe dans les conditions expérimentales très particulières de ces études.
Ainsi, seule la transmission par contact direct avec la matière organique provenant d'un animal contaminé ou d'une personne présentant les symptômes de la maladie a été observée dans le milieu naturel. [réf. nécessaire]
Traitements expérimentaux
L'élaboration d'un traitement contre cette maladie fait l'objet de recherches actives, motivées notamment par les risques d'une utilisation du virus Ebola à des fins de bioterrorisme. Les pistes sont variées et souvent prometteuses sur les modèles animaux, mais demeurent encore au stade expérimental et peu d'entre elles ont atteint le stade d'essai clinique sur des patients humains. La difficulté majeure, outre le fait de concevoir des traitements et des protections qui soient efficaces sans effets indésirables rédhibitoires, réside dans la nécessité de développer des molécules qui soient transportables et stockables sur les zones d'épidémies, essentiellement en Afrique équatoriale ; cette problématique concerne notamment les traitements envisagés à base d'acides nucléiques, tels que les petits ARN interférents, qui sont des molécules fragiles. [réf. nécessaire]
Essais cliniques en Afrique de l'Ouest
Plusieurs traitements expérimentaux ont été ou sont prévus d'être testés contre l'épidémie sévissant encore en Afrique de l'Ouest en 2015 :
- Favipiravir (Avigan) — Deux études publiées au printemps 2014 avaient indiqué qu'un antiviral, le favipiravir, un inhibiteur de l'ARN polymérase ARN-dépendante développé contre divers virus à ARN et notamment celui de la grippe, s'est montré efficace sur des souris, et ce même lorsqu'il était administré six jours après l'exposition de ces rongeurs au virus Ebola. Développé par la société japonaise Toyama Chemical, filiale de Fujifilm basée à Tokyo, il fait partie des traitements envisageables pour agir contre l'épidémie d'Afrique de l'Ouest. Les premiers résultats chez l'être humain s'avèrent décevant.
- Brincidofovir (CMX001) — Développé par la société Chimerix, basée à Durham en Caroline du Nord, cet antiviral expérimental s'est montré efficace sur des modèles animaux contre les cytomégalovirus, les adénovirus, le virus BK, le virus de la variole et le virus de l'herpès. Son action contre le virus Ebola était inattendue dans la mesure où il était connu pour agir contre les virus à ADN bicaténaire mais pas contre les virus à ARN monocaténaire. Il est administré depuis janvier 2015 à des patients volontaires à Monrovia, au Liberia.
Traitements envisagés pour des essais cliniques
D'autres médicaments sont également sur les rangs pour une éventuelle utilisation sur le terrain en Afrique de l'Ouest compte tenu de l'ampleur des besoins :
- TKM-Ebola — Une étude avait montré en 2010 l'intérêt de petits ARN interférents pour limiter l'expression de l'ARN polymérase ARN-dépendante du virus Ebola en administrant des ARN interférents ciblant cette enzyme ainsi que la protéine VP24 associée à l'enveloppe virale et la protéine VP35, cofacteur de l'ARN polymérase, à quatre macaques rhésus pendant sept jours consécutifs suivant leur exposition au virus : ces singes ont tous les quatre été protégés de l'évolution létale de la maladie. Baptisé TKM-Ebola, ce traitement expérimental, développé par la société canadienne Tekmira Pharmaceuticals basée à Vancouver, était le seul à avoir été testé sur des humains au commencement de l'épidémie de 2014 et a fait l'objet, de la part de la FDA américaine, d'une levée partielle de la suspension des essais cliniques le 7 août, permettant son utilisation éventuelle comme traitement dans le cadre de l'épidémie sévissant en Afrique de l'Ouest. Les résultats chez l'être humain n'ont, cependant, pas démontré d'intérêt de ce type de traitement.
- BCX4430 (immucilline A) — Développé par la société BioCryst Pharmaceuticals, basée à Durham en Caroline du Nord tout comme la société Chimerix qui a développé le brincidofovir, il serait actif contre le virus Ebola et le virus Marburg, et son développement pour une utilisation chez l'homme a été accéléré afin de combler l'absence de traitements disponibles pour lutter contre l'épidémie de maladie à virus Ebola en Afrique de l'Ouest.
L'administration de plasma de malades guéris s'avère également décevant.
Autres axes de recherche
Une combinaison d'anticorps monoclonaux, le REGN-EB3, ainsi que l'anticorps monoclonal MAb114, sont les seuls, en 2020 à avoir démontré une baisse de la mortalité.
Jusque là l'absence de traitement existant conte la maladie à virus Ebola a poussé à tester un grand nombre d'autres antiviraux par rapport à leur action éventuelle contre le virus Ebola, y compris des composés naturels tels que la scytovirine (en) et la griffithsine ainsi que des composés synthétiques tels que la 3-déazaneplanocine A (DZNep), le FGI-103, le FGI-104, le FGI-106, le dUY11 et le LJ-001. Diverses autres substances actives ont également été testées, parfois en dehors de tout protocole, comme ce fut le cas pour la lamivudine, ou 3TC, un antiviral normalement utilisé contre le VIH, administré contre le virus Ebola par un praticien libérien, avec certains résultats. Le virus Ebola utilisant un canal calcique endosomique pour pénétrer dans la cellule hôte après macropinocytose, des recherches préliminaires sur des souris, publiées en , ont montré que la tétrandrine, un inhibiteur calcique présent dans une herbe médicinale de la médecine traditionnelle chinoise, pourrait présenter un potentiel thérapeutique contre la maladie à virus Ebola. L'association artésunate-amodiaquine semble également diminuer la mortalité de la maladie à virus Ebola. Ont également été testées les molécules JK-05 et Triazavirin (en).
Par ailleurs, les recherches, commencées dès la fin du XXe siècle, avaient notamment exploré les axes suivants :
- une étude publiée en 2013 a souligné l'intérêt d'un vaccin protégeant à la fois contre la rage et contre la maladie à virus Ebola développé conjointement par le NIAID et l'université Thomas Jefferson à Philadelphie, dans la mesure où cette approche est susceptible de traiter à la fois les victimes humaines et le réservoir animal du virus Ebola ;
- un mélange de trois anticorps monoclonaux anti-Ebola chimériques de souris et d'homme (anticorps c13C6, h-13F6 et c6D8) produits dans des cellules CHO (cellules d'ovaires de hamsters de Chine) et de Nicotiana benthamiana (une espèce de tabac) a été testé en 2012 avec de bons résultats sur des macaques rhésus. Baptisé ZMapp, ce cocktail, développé par la société californienne Mapp Biopharmaceutical basée à San Diego, a été administré pour la première fois à un humain le 31 juillet 2014 au Liberia pour traiter Kent Brantly, un médecin américain travaillant pour l'organisation caritative chrétienne Samaritan's Purse qui avait développé les symptômes de la maladie depuis le 22 juillet ; sa consœur Nancy Writebol, également contaminée par le virus Ebola, a quant à elle reçu deux doses de ce traitement expérimental les 3 et 4 août. Les deux Américains ont été rapatriés les jours suivants à l'Emory University Hospital d'Atlanta pour être suivis en relation avec les CDC. À la suite de la couverture médiatique internationale offerte à ce traitement, des voix se sont élevées pour en réclamer l'utilisation à plus large échelle, poussant les autorités américaines à en autoriser l'utilisation au Liberia le 11 août alors que Barack Obama avait indiqué quatre jours plus tôt que cette option était prématurée ; l'OMS a autorisé le 12 août l'utilisation de médicaments expérimentaux dans le cadre de cette épidémie sous certaines conditions, ouvrant la voie à une compétition entre firmes pharmaceutiques sur ce nouveau marché. Les deux patients américains traités au « ZMapp » purent quitter l'hôpital guéris le 21 août, tandis que le prêtre espagnol Miguel Pajares, âgé de 75 ans, qui avait également reçu ce traitement expérimental, mourait le 12 août à l'hôpital Carlos III de Madrid, où il avait été rapatrié cinq jours plus tôt du Liberia, pays dans lequel il avait contracté la maladie en effectuant une mission pour le compte d'une ONG. Très difficile à produire et en rupture de stock depuis octobre 2014, ce traitement, utilisé ponctuellement en Occident, n'a pas joué de rôle direct pour combattre l'épidémie en Afrique de l'Ouest, en dépit de la très forte médiatisation dont il a fait l'objet à l'été 2014. En 2016, une étude ne parvient toutefois pas à démontrer la supériorité de ce traitement par rapport à une prise en charge standard ;
- une étude plus ancienne avait montré en 2003 l'intérêt de la protéine de nématode anticoagulante c2 recombinante (rNAPc2) comme inhibiteur du facteur VIIa et du facteur tissulaire pour prolonger la survie de macaques rhésus infectés ;
- une étude de 1999 indiquait déjà que des inhibiteurs de l'adénosylhomocystéinase, notamment dérivés de la 3-déazaneplanocine A, se sont montrés efficaces pour traiter des souris exposées au virus Ebola.
Vaccins
Plusieurs vaccins sont à l'étude à l'occasion de l'épidémie de 2014 en Afrique de l'Ouest :
- cAd3-ZEBOV — Des études publiées en 2010 et en 2006 ont montré l'intérêt de vaccins conçus à partir d'adénovirus affectant des chimpanzés dans le matériel génétique desquels le gène de la glycoprotéine du virus Ebola a été inséré. Le groupe britannique GlaxoSmithKline, qui avait acquis cette technologie grâce au rachat en 2013 de la société helvétique Okairos basée à Bâle et spécialisée dans les vaccins ciblant les lymphocytes T, avait annoncé le 10 août son intention de commercialiser un vaccin sur ce principe dès 2015. Les essais cliniques de ce vaccin ont commencé en à Oxford et à Bethesda dans le Maryland, puis se sont poursuivis en octobre au Mali. En , il est évalué par GSK en vue de la phase III d'essai clinique pour tenter de contenir l'épidémie d'Afrique de l'Ouest.
- VSV-EBOV — Des résultats encourageants sur des modèles animaux (cobaye, souris, macaque rhésus) avaient été obtenus en 2006 avec un vaccin expérimental constitué d'une forme recombinante atténuée du virus de la stomatite vésiculaire — un rhabdovirus — exprimant la glycoprotéine GP du virus Ebola : quatre macaques sur huit avaient survécu après avoir reçu ce traitement 20 à 30 minutes après l'exposition au virus Ebola. Développé par des chercheurs du Laboratoire national de microbiologie (en) du Canada, le VSV-EBOLA stimule une réponse immunitaire dirigée contre la glycoprotéine du virus Ebola et procure donc une protection contre ce dernier. Certains indices laissent également penser que ce vaccin pourrait présenter une action curative sur des patients déjà infectés par le virus. Produit par la société Merck & Co, basée à Whitehouse Station (en) dans le New Jersey, le VSV-EBOV a fait l'objet d'un essai clinique à Genève, en Suisse, au cours duquel des patients ont fait état de douleurs articulaires, mais devrait faire l'objet de tests complémentaires en Afrique de l'Ouest. Fin l'OMS diffuse depuis Genève un communiqué de presse et la revue médicale internationale The Lancet publie éditorial et article annonçant des résultats préliminaires de l'étude, débutée le , prometteurs, avec une efficacité vaccinale de 70 à 100 %.
- r-VSV Zebov - Le , l'OMS annonce que, lors d'une phase de test, 100% des personnes vaccinées et qui auraient été en contact avec des malades d'Ebola n'auraient pas développé la maladie eux-mêmes.
D'autres pistes de recherche de vaccin, préalables à l'épidémie, comprennent :
- un vaccin lyophilisé — donc transportable et stockable — protégeant efficacement les souris a été annoncé en 2011, dans lequel la glycoprotéine virale GP est fusionnée avec un anticorps monoclonal reconnaissant un épitope sur cette protéine pour conduire à la formation de complexes immuns Ebola (EIC) ; ces derniers sont administrés en même temps qu'un agoniste de récepteurs de type Toll tel que l'acide polyinosinique-polycytidylique pour en maximiser l'effet ;
- un vaccin à ADN a été proposé dès 1998 sous la forme de plasmides codant la nucléoprotéine virale NP ainsi que les glycoprotéines sGP et GP.
Histoire
Les deux premières épidémies recensées par l'OMS ont eu lieu en 1976, au Soudan (151 morts pour 284 cas) et au Zaïre (280 décès pour 318 cas). Un cas mortel est identifié au Zaïre en 1977. De nouvelles contaminations surviennent au Soudan en 1979 : 22 décès pour 34 cas. En 1989, une épidémie touche les singes d'une animalerie de Reston, États-Unis. Elle ne fait aucune victime humaine. Le même type d'épidémie est observé en 1992 en Italie, et en 1996 aux États-Unis[réf. nécessaire].
D'autres contaminations humaines massives surviennent dans les années 1990, en 1994 au Gabon (31 décès pour 52 cas) et en Côte d'Ivoire (un cas, non mortel), en 1995 au Zaïre (254 décès pour 315 cas), en 1996 au Gabon (deux épidémies successives, causant respectivement 21 décès pour 31 cas, de janvier à avril, et 45 décès pour 60 cas, de juillet à décembre). Une infirmière ayant soigné des malades atteints au Gabon meurt de fièvre hémorragique Ebola en Afrique du Sud, la même année[réf. nécessaire].
En 2000, le virus touche pour la première fois l'Ouganda (224 décès pour 425 cas) ; il y revient en 2007 dans la région du lac Albert (37 morts pour 149 cas, soit un taux de létalité inhabituellement bas de 25 %, peut-être en raison d'une souche moins virulente), 2011 (1 cas mortel, à 35 km de la capitale), 2012 (dans le district de Kibale, dans l'ouest du pays : 17 morts pour 24 cas) et 2013 (4 morts pour 7 cas). Une épidémie touche de nouveau le Gabon en 2001-2002 (53 décès pour 65 cas), ainsi que la République du Congo voisine (44 décès pour 59 cas en 2001-2002, 128 décès pour 143 cas de janvier à , 29 décès pour 35 cas en novembre-, 10 décès pour 12 cas en 2005). La République démocratique du Congo est également touchée en 2007 (187 morts pour 264 cas), 2008 (dans le Kasaï-Occidental, 14 décès pour 32 cas) et 2012 (dans la Province orientale, 29 décès pour 54 cas).[réf. nécessaire]
Début 2014, l'Afrique de l'Ouest est le théâtre de l'épidémie de maladie à virus Ebola la plus meurtrière depuis la découverte des premiers cas en 1976. D'abord localisée dans le sud de la Guinée, notamment dans les préfectures de Gueckédou, Macenta et Kissidougou, l'épidémie se propage rapidement au Liberia puis dans un deuxième temps à la Sierra Leone. Des cas de maladie à virus Ebola survenus en Sierra Leone lors d'une épidémie de fièvre de Lassa entre 2006 et 2008 et identifiés montrent que le virus était déjà présent dans la région. En juillet 2014, un décès lié au virus survient au Nigéria, il s'agit d'un homme en provenance du Liberia et mort peu après son débarquement à l'aéroport de Lagos. Au , on dénombrait 660 décès pour plus de 1 100 cas de fièvre hémorragique.
Le , l'OMS fait état de « chaînes de transmission non détectées » à la suite d'une recrudescence de nouveaux cas en Guinée après plusieurs semaines de faible activité virale. Le , l'OMS diffuse un nouveau bilan de l'épidémie de fièvre hémorragique faisant état de 932 décès en Afrique de l'Ouest. Le , les États-Unis annoncent le premier cas de contraction du virus sur le sol américain, ce malade décède des suites de la maladie le . Un membre de l'équipe de soin affectée à ce patient contracte la maladie, il s'agit du premier cas non importé sur le sol américain. Le , un premier cas confirmé est également déclaré en Espagne, qui est également le premier cas en Europe.
- Cet article est partiellement ou en totalité issu de l'article intitulé « Virus Ebola » (voir la liste des auteurs).
Voir aussi
Bibliographie
- Amy Maxmen, « La première bataille gagnée contre Ebola », Pour la science, hors-série no 113, , p. 38-44
Articles connexes
- Virus Ebola
- Vaccin contre le virus Ebola
- Fièvre hémorragique de Marbourg
- Liste d'épidémies liées au virus Ebola
- Épidémie de maladie à virus Ebola en Afrique de l'Ouest
- En littérature, le roman de Paule Constant, Des chauves-souris, des singes et des hommes (2016)
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- ICD9Data.com
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (cs + sk) WikiSkripta
- Virus Ebola, Fiche Technique Santé-Sécurité : Agents Pathogènes, sur le site de l'Agence de la santé publique du Canada.
- « Mawah – Le jour où Ebola est arrivé dans notre village », un scroll doc sur l’histoire de la première apparition d’Ebola dans un petit village en plein cœur du Liberia, basé sur le documentaire "survivre à Ebola" de Carl Gierstorfer, diffusé part arte en
- Avis relatif à la conduite à tenir autour des cas suspects de maladie Ebola, sur le site du Haut Conseil de la santé publique
- Maladie à virus Ebola - Information aux voyageurs sur le site de l'ECDC.
- (en) RAPID RISK ASSESSMENT Outbreak of Ebola virus disease in West Africa, 3e mise à jour, 1er août 2014, sur le site de l'ECDC.
- (en) Outbreak of Ebola in West Africa: ECDC assesses the risk, sur le site de l'ECDC.