Virus d'Usutu
Usutu virus
| Domaine | Riboviria |
|---|---|
| Règne | Orthornavirae |
| Embranchement | Kitrinoviricota |
| Classe | Flasuviricetes |
| Ordre | Amarillovirales |
| Famille | Flaviviridae |
| Genre | Flavivirus |
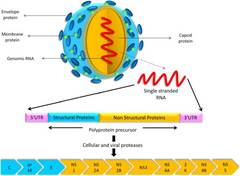
Le virus d'Usutu, Usutu virus ( USUV), est une espèce de virus à ARN, d'origine africaine et considéré comme « émergent ». Il fait partie de la famille des Flaviviridae (qui comprend environ 70 virus pathogènes pour certains animaux, dont l'espèce humaine). Dans ce groupe il s'inscrit dans le complexe de l'encéphalite japonaise.
À ce jour il touche principalement des espèces de passereaux (merle noir, mésanges, moineau domestique, rouge-gorge, étourneau sansonnet) et quelque rapaces (dont des chouettes). En Europe c'est le merle noir Turdus merula qui semble en être la principale victime (par centaines voire milliers par foyers lors des pics d'épizootie). Expérimentalement, il se montre très peu pathogène chez des poulets inoculés, et il ne semble pas contagieux de poulet à poulet (le poulet n'est donc pas une bonne « espèce-sentinelle » pour la détection d'éventuelles épizooties causées par ce virus chez les oiseaux sauvages). Aucun cas de transmission ni de maladie n'a été rapporté à ce jour chez les animaux domestiques (hormis oiseaux en cages).
Les souches d'USUV circulant en Europe sont génétiquement proches les unes des autres. Ce virus étant un arbovirus, il est véhiculé par des arthropodes et sans doute principalement par des moustiques Culex (plus précisément moustiques du Complexe Culex pipiens). Des oiseaux constitueraient le réservoir du virus. Ce virus pourrait être devenu endémique en Allemagne. Certains éco-épidémiologistes estiment qu'il pourrait bientôt devenir une menace pour le continent asiatique.
Il peut être rarement et sporadiquement pathogène pour l'espèce humaine, il constitue alors une impasse épidémiologique. L'infection est plus grave chez les personnes immunodéprimées (chez lesquelles il cause alors des troubles neurologiques).




(A) Tissu de cerveau de merle non infecté par l'USUV.
(B) Cerveau de merle infecté par l'USUV, montrant un groupe de neurones positif (en rouge).
(C) Tissu cardiaque de merle non infecté par l'USUV.
(D) Tissu cardiaque de merle infecté par l'USUV, montrant que les cellules marquées positives sont localisées dans l'endocarde (en rouge).
(E) Foie de merle infecté par l'USUV : les cellules de Kupffer disséminées sont infectées (en rouge).
(F) Cellules pulmonaires de merle infectées, les cellules USUV-positives sont diffuses (en rouge).
Histoire écoépidémiologique
Il a été formellement identifié pour la première fois en Afrique du Sud en 1959, dans le Swaziland sur le bord de la rivière Usutu (d'où son nom).
Ce virus étant source de zoonose et transmissible par des moustiques hématophages courants, il fait l'objet d'un suivi écoépidémiologique ; c'est-à-dire qu'il est à la fois recherché chez les animaux sauvages ou d'élevage et l'espèce humaine. On cherche dans le même temps à mieux comprendre son cycle de développement.
Pour des raisons encore mal comprises, il a été noté qu'après des foyers infectieux provoquant d'importantes mortalités, le nombre d'oiseaux trouvés malades ou positifs au virus chute de façon spectaculaire, comme en Autriche après 2004. Une hypothèse est qu'une immunité collective se développe rapidement chez les oiseaux survivants.
Pour tester cette hypothèse, des sérologies de 442 oiseaux sauvages de 55 espèces a priori vulnérables au virus ont été analysées en Autriche durant 4 ans consécutifs (de 2003 à 2006). À ce lot ont été ajoutés des échantillons sanguins prélevés chez 86 rapaces provenant de centres de soins (collectés avant, pendant et après le pic de mortalité).
En 2003 et 2004, moins de 10 % des oiseaux testés étaient séropositifs au virus. En 2005 et 2006, ils étaient plus de 50 %. Près des 3/4 des hiboux et rapaces diurnes testés présentaient des anticorps avant le moment du pic saisonnier de transmission en 2005, montrant qu'ils avaient déjà été exposés au virus les années précédentes ; Ce suivi a aussi montré d'importantes variations annuelles et saisonnières (et l'existence de nouvelles infections dans la saison en cours chez des oiseaux déjà porteurs d'anticorps).
Selon les auteurs, une immunité collective est une explication plausible à la diminution significative de la mortalité des oiseaux après 2006 en Autriche.
Pathogénicité
Elle est avérée chez l'oiseau. Certaines espèces y semblent nettement plus sensibles, ou momentanément plus sensibles : ainsi en Autriche après un pic de mortalité les oiseaux semblent avoir développé une immunité, ou les variants du virus en circulation sont devenus moins virulents.
La pathogénicité est encore mal cernée pour l'espèce humaine (hormis en cas de déficience immunitaire).
Ce virus n'a pas causé de problèmes de santé publique, mais les virologues le jugent préoccupant et à surveiller à cause de sa pathogénicité potentielle pour l'espèce humaine, mais surtout en raison de similitudes en termes éco-épidémiologiques avec d'autres arbovirus régulièrement sources d'épidémies dans certains pays émergents (comme la fièvre du Nil occidental).
Occurrence
Dans le monde animal, seuls des cas de mortalité chez des animaux isolés avaient été repérés dans les années 1990.
Puis (depuis 1996) plusieurs phénomènes de mortalité massive d'oiseaux ont pu lui être attribués, après un premier foyer chez des oiseaux sauvages (merles principalement) dans les provinces italiennes de Florence et Pistoia en Toscane.
Répartition géographique
L'USUV a été signalée dans plusieurs pays Africains, dont le Sénégal, la République centrafricaine, le Nigeria, l'Ouganda, le Burkina Faso, la Côte d'Ivoire et le Maroc.
Puis un cas a été identifié pour la première fois hors de l'Afrique en 2001 (où le virus a causé une mortalité importante chez des merles à Vienne ).
En Europe
Chez l'espèce humaine, mi-2018, seuls 26 cas d’infection avaient été rapporté pour l'Europe entière. Ce nombre est indiscutablement sous-estimé précise Yannick Simonin, car il n'existe pas de test de détection dans le commerce, et les symptômes de l'infection sont encore mal connus des médecins.
Chez le animaux, ce virus y a été repéré depuis les années 1990 lors de mortalités anormales d'oiseaux (Hongrie, Suisse, Italie, Espagne, Allemagne) ou par détection sérologique lors de contrôles de routines (Autriche, Royaume-Uni, Italie, Hongrie, République Tchèque, Pologne) puis Croatie.
Mais à l'heure actuelle, une centaine de cas seulement ont été confirmés positifs pour l'USUV.
Il a d'abord été responsable d'une mortalité subite et importante de merles en 1996 en Toscane, avant d'être repéré en Europe centrale.
En Autriche il a ensuite attiré l'attention en décimant des groupes de merles (mais des sérologies positives ont été signalées chez plusieurs espèces d'oiseaux migrateurs sauvages) avec des foyers détectés en 2003 (92/177), en 2004 (11/224), en 2005 (4/103) et en 2005.
En Hongrie, une surveillance aviaire passive a été mise en place en 2003, qui a détecté 1 cas chez des merles en 2005 puis 6 détections en 2006.
En Allemagne il a été trouvé chez des oiseaux captifs, en 2011, des populations de merles sont décimées (dans le Sud-ouest du pays près de Weinheim) avec 72 cas d'USUV formellement confirmés. Des oiseaux sauvages captifs de jardins zoologiques (Mannheim et Heidelberg) meurent aussi. Des analyses faites dans des moustiques d'Allemagne montrent que ce virus de pays chaud peut y survivre l'hiver et réinfecter les oiseaux la saison suivante. L'USUV pourrait être devenu endémique dans certaines régions d'Allemagne et il présente des caractéristiques qui pourraient lui permettre de devenir un pathogène résident en Europe
En Suisse, une mortalité massive d'oiseaux captifs et sauvages (plus d'une centaine de passeriformes et de strigiformes) est signalée jusqu'en 2008. Aucune mortalité massive n'a été démontrée depuis lors.
En Belgique, en , un bouvreuil (Pyrrhula pyrrhula) de trois ans maintenu en captivité toute sa vie et un pic épeiche (Dendrocopos major), adulte sauvage ont été trouvés porteurs de signes neurologiques d’encéphalopathie virale non suppurative. Ils ont été trouvés dans la vallée de la Meuse entre les villes de Namur et de Huy à 4 km l’un de l’autre et à 5 jours d’intervalle. Une nécrose et une dégénérescence cérébrale ont été observées dans leurs cerveaux et cervelet, avec preuve sérologique d'infection par le virus d'Usutu (antigène et ARN détectés par immunohistochimie et PCR). À ce jour c’étaient les cas les plus occidentaux repérés en Europe. Depuis 2009 le CERVA et l'Institut Royal des Sciences Naturelles (IRSNB) sont mandatés par l'Agence Fédérale pour la Sécurité de la Chaîne Alimentaire (AFSCA) pour une surveillance de ce virus dans la faune aviaire sauvages.
En France où le réseau SAGIR assure une veille éco-épidémiologique, le virus n'a été détecté qu'à partir de 2013 (chez une vingtaine de merles trouvés morts en quelques jours dans une même commune du Haut-Rhin avec hépatomégalie et splénomégalie). Chez l'animal sauvage, ce virus a été formellement diagnostiqué par des analyses moléculaires pour la première fois (chez les merles noirs toujours) en 2015. Le bilan à l'automne 2018 montre une circulation de l’infection plus précoce et plus largement distribuée comparée aux autres années ; sa présence étant certifiée sur le centre-ouest de la France et les espèces impactées étant principalement des Merles noirs et des chouettes de parcs zoologiques.
Il a été repéré chez l'espèce humaine en France pour la 1ère fois en 2016, chez un patient de 39 ans, hospitalisé trois jours à Montpellier pour une paralysie faciale selon l'Inserm, relayé par un article de la revue scientifique Emerging Infectious Diseases publié en .
Épidémiologie
Seulement deux cas humains ont été identifiés et décrits en Afrique, en 1981 en Centrafrique puis en 2004, l'un bénin et l'autre grave.
Le premier cas humain détecté hors de l'Afrique a été signalé en 2009 chez une femme en Italie, en état de déficience immunitaire et touchée par une encéphalite.
Un autre cas a été trouvé chez une italienne ayant subi une transplantation hépatique, et fin 2011 un autre patient italien immunodéprimé présentant des troubles neurologiques et ayant subi une transfusion sanguine. Ceci a incité à contrôler les donneurs de sang dans certains pays, avec un suivi qui a permis en Allemagne de trouver un donneur de sang asymptomatique (1 cas pour 4 200 prélèvements sanguins analysés, ce qui montre une faible prévalence chez l'espèce humaine). En Italie la prévalence est plus élevée : quatre donneurs de sang ont été testés positifs (sur 359 testés) pour les anticorps spécifiques à l'USUV.
En 2013, trois malades respectivement âgés de 29, 56 et 61 ans, victimes d'encéphalites ou de méningoencéphalites ont été signalés comme infectés, à Zagreb (ou aux environs de la ville) en Croatie ; Leurs symptômes étaient : maux de tête, fièvre, ridigités, de la nuque notamment, tremblement des mains, Hyperréflexie.
Des études de séroprévalence faites chez de donneurs de sang en bonne santé ont montré que les infections humaines avaient été sous-estimées : la prévalence était de 0,02 % en Allemagne (donnée 2012) puis de 1.1% en Italie.
Écoépidémiologie
Les vecteurs connus de l'USUV sont respectivement principalement des moustiques ornithophiles du genre Culex (moustiques piqueurs les plus communs en Europe de l’Ouest. Les hôtes constituant le réservoir épidémiologique seraient des oiseaux. Mais les moustiques vecteurs s'attaquent aussi à certains mammifères (ex : rongeurs (dont en Afrique chez Praomys sp.) et chevaux) et aux humains ...) qui - comme l'espèce humaine - ne seraient que des hôtes accidentels ; ce sont les oiseaux infectés jouent le rôle d'« hôtes d'amplification » des populations virales.
Une étude faite en 2008-2009 sur les moustiques et oiseaux d'Emilie-Romagne a détecté l'USUV chez 89 moustiques de l'espèce Culex pipiens et chez 2 Aedes albopictus. Et douze espèces d'oiseaux sauvages, principalement des pies européennes (Pica pica), (Corvus cornix) et Geais (Garrulus glandarius), étaient infectées ou avaient été en contact avec le virus . Culex pipiens semble être le vecteur principal et Aedes albopictus pourrait être secondairement impliqué dans le cycle du virus .
Le cycle de développement de ce virus a d'abord été assimilé à celui du virus du Nil occidental (WNV), mais les données récentes laissent penser que le virus d'Usutu dépend moins que lui des moustiques du genre Culex car il est susceptible d'infecter aussi le moustique tigre Aedes albopictus qui en devient alors un nouveau vecteur. l'USUV semble aussi plus urbain que le WNV, et ciblerait surtout les merles.
En Afrique le virus est fréquemment trouvé chez des moustiques, et principalement chez 4 espèces d'oiseaux : Bycanistes sharpei, Andropadus virens, Turdus libonyanus et Turdus merula. Les habitudes migratoires de ces 4 espèces ne semblent pas pouvoir expliquer la diffusion récente du virus. On l'a donc recherché chez d'autres espèces qui pourraient être porteuses saines et contribuer en Europe à diffuser le virus. Ce dernier a été trouvé chez plusieurs espèces d'oiseaux migrateurs, dont Sylvia communis, Sylvia curruca, Sylvia borin, Falco tinnunculus, circus aeruginosus, Delichon urbica, Acrocephalus scirpaceus, Ficedula hypoleuca, et Hirundo rustica.
Des co-circulations de ce virus avec le WNV existent (via le même vecteur : le Culex ; des co-infections seraient donc possibles et probables. Elles peuvent compliquer le diagnostic et la symptomatologie. En outre comme ces deux virus sont assez proches, une « immunités croisée » pourrait être possible (c'est-à-dire qu'un organisme ayant survécu à une infection par l'un des deux virus serait en quelque sorte plus ou moins durablement vacciné contre le second, ce qui peut aussi compliquer les modèles épidémiologiques ou éco-épidémiologiques).
En 2013 une étude faite dans des parcs zoologiques d'Europe centrale a conclu à une faible prévalence du virus chez les oiseaux détenus par les parcs testés.
Symptômes et signes cliniques d'infection
Chez les oiseaux infectés, post mortem aucune lésion macroscopique significative n'est visible.
Des pertes de plumes au niveau du cou et de la tête ont parfois été signalées.
L'autopsie montre des organes généralement congestionnés, avec des foyers de nécrose, de gliose, et des infiltrats inflammatoires surtout constitués de cellules lymphoïdes et d’histiocytes. Une observation plus attentive du point de vue macroscopique peut mettre en évidence une splénomégalie et une hépatomégalie.
Durant l’évolution de la maladie les signes sont « non spécifiques » : immobilité, plumage ébouriffé, anorexie, yeux à demi fermés. Puis des signes neurologiques graves apparaissent incoordination, incapacité de voler, mouvements anormaux et saccadés, torticolis et nystagmus).
Génétique
Ce virus est génétiquement et antigéniquement proche du virus du Nil occidental (WNV).
Une analyse génomique a été publiée 2001, permettant des comparaisons avec les génomes de souches sud-africaines, de même pour des souches trouvées chez des chiroptères.
En 2016 de premières données concernant la reconstruction de l'arbre phylogénétique du virus d'Usutu ont été publiées.
Les souches isolées en Autriche, Hongrie et Suisse au début des années 2000 présentent 99,9 % d'identité entre elles , ce qui évoque une origine commune et une expansion récente et rapide. Par contre des souches d'USUV isolées en Espagne ou en Italie se sont montrées génétiquement plus proches de souches sud-africaines.
Les données génétiques disponibles sont stockées dans la banque de données GenBank.
Références
Référence biologique
- (en) Référence ICTV : Usutu virus (consulté le )
Voir aussi
Article connexe
Liens externes
- Ressource relative au vivant :
- Ressource relative à la santé :
- Une zoonose émergente ou silencieuse : l’infection par le virus Usutu
Bibliographie
- Yannick Simonin, « En France, les moustiques transmettent aussi le virus Usutu », The Conversation, [lire en ligne]
- Ashraf, U., Ye, J., Ruan, X., Wan, S., Zhu, B., & Cao, S. (2015). Usutu virus: an emerging flavivirus in Europe. Viruses, 7(1), 219-238.
- Bakonyi, T., Erdélyi, K., Brunthaler, R., Dán, Á., Weissenböck, H., & Nowotny, N. (2017). Usutu virus, Austria and Hungary, 2010–2016. Emerging microbes & infections, 6(10), e85.
- Blázquez AB, Escribano-Romero E, Martín-Acebes MA, Petrovic T, Saiz JC. (2015) Limited susceptibility of mice to Usutu virus (USUV) infection and induction of flavivirus cross-protective immunity. ; Virology. 2015 Aug;482:67-71. doi: 10.1016/j.virol.2015.03.020. Epub 2015 Mar 30 ; PMID 2582753
- Cadar D, Becker N, Campos Rde M, Börstler J, Jöst H, Schmidt-Chanasit J. -2014) Usutu virus in bats, Germany, 2013. Emerg Infect Dis. 2014 Oct;20(10):1771-3. doi: 10.3201/eid2010.140909. PMID 25271769
- Calzolari M, Bonilauri P, Bellini R, Albieri A, Defilippo F, Tamba M, et al. (2013) Usutu Virus Persistence and West Nile Virus Inactivity in the Emilia-Romagna Region (Italy) in 2011. PLoS ONE 8(5): e63978. doi:10.1371/journal.pone.0063978
- Johnson, N., Wakeley, P.R., Mansfield, K.L., McCracken, F., Haxton, B., Phipps, L.P., Fooks, A.R., 2010. Assessment of a novel real-time pan-flavivirus RT-polymerase chain reaction. Vector Borne and Zoonotic Diseases 10, 665–671.
- Martín-Acebes, M. A., Blázquez, A. B., Cañas-Arranz, R., Vázquez-Calvo, Á., Merino-Ramos, T., Escribano-Romero, E., ... & Saiz, J. C. (2016). A recombinant DNA vaccine protects mice deficient in the alpha/beta interferon receptor against lethal challenge with Usutu virus. Vaccine, 34(18), 2066-2073 (résumé).
- Nikolay B, Weidmann M, Dupressoir A, Faye O, Boye CS, Diallo M, Sall AA. (2014), Development of a Usutu virus specific real-time reverse transcription PCR assay based on sequenced strains from Africa and Europe ; J Virol Methods. 2014 Mar;197:51-4 ; Epub 2013 Sep 13 ; Doi:10.1016/j.jviromet.2013.08.039. PMID 24036076
-
 (en) B. Nikolay, M. Diallo, C.S. Boye et A. A. Sall, « Usutu virus in Africa », Vector Borne and Zoonotic Diseases, vol. 11, no 11, , p. 1417–1423 (ISSN 1530-3667, PMID 21767160, DOI 10.1089/vbz.2011.0631).
(en) B. Nikolay, M. Diallo, C.S. Boye et A. A. Sall, « Usutu virus in Africa », Vector Borne and Zoonotic Diseases, vol. 11, no 11, , p. 1417–1423 (ISSN 1530-3667, PMID 21767160, DOI 10.1089/vbz.2011.0631). - Poidinger, M., Hall, R.A., Mackenzie, J.S. (1996). Molecular characterization of the Japanese encephalitis serocomplex of the Flavivirus genus. Virology 218, 417–421
- Rubel F, Brugger K, Hantel M, Chvala-Mannsberger S, Bakonyi T, Weissenböck H, Nowotny N. (2008) Explaining Usutu virus dynamics in Austria: model development and calibration. Prev Vet Med. 2008 Jul 15; 85(3-4):166-86. Epub 2008 Mar 7.
- Vazquez A, Jimenez-Clavero M, Franco L, Donoso-Mantke O, Sambri V, Niedrig M, Zeller H, Tenorio A. (2011), Usutu virus: potential risk of human disease in Europe. Euro Surveill. 2011 Aug 4;16(31). pii: 19935. Review. ; PMID 21871214 (résumé).
- Weissenböck H, Kolodziejek J, Url A, Lussy H, Rebel-Bauder B, et al. (2002) Emergence of Usutu virus, an African mosquito-borne flavivirus of the Japanese encephalitis virus group, central Europe. Emerg Infect Dis 8: 652–656. doi: 10.3201/eid0807.020094
- Ziegler, U., Fast, C., Eiden, M., Bock, S., Schulze, C., Hoeper, D., ... & Luehken, R. (2016). Evidence for an independent third Usutu virus introduction into Germany. Veterinary Microbiology, 192, 60-66.