Vaccin bilié de Calmette et Guérin
| Maladie à traiter | |
|---|---|
| Date de découverte |
1921 |
| Formule brute |
Bactéries vivantes |
| Catégorie de grossesse |
Catégorie C (d)
|
|---|
Le vaccin bilié de Calmette et Guérin, le plus souvent dénommé vaccin BCG, est un vaccin contre la tuberculose.
Il est préparé à partir d'une souche atténuée de bacille tuberculeux bovin (Mycobacterium bovis) vivant qui a perdu sa virulence sur l'homme par culture spéciale sur des milieux artificiels pendant des années. Ce bacille proche de Mycobacterium tuberculosis, responsable de la tuberculose humaine, confère une antigénicité croisée suffisamment forte pour devenir un vaccin effectif pour la prévention de la tuberculose humaine. Il a également été utilisé en médecine vétérinaire.
Depuis les arrêts d'approvisionnement par Sanofi, le BCG est en France produit par le groupe MEDAC, avec des pénuries périodiques (dont une en 2020).
Historique
Contexte
Le développement du vaccin BCG s'est fait dans un cadre de pensée et une pratique influencés par la vaccination antivariolique qui recourait alors à un microorganisme animal (cow-pox) pour se prémunir d'une affection humaine (variole ou smallpox en anglais). L'agent de la tuberculose bovine, Mycobacterium bovis, qui peut induire des infections tuberculeuses chez l'homme, fut ainsi utilisé dans l'espoir de trouver un vaccin contre la tuberculose humaine. L'inoculation de Mycobacterium bovis à des humains dans l'Italie de la fin du XIXe siècle eut des conséquences désastreuses. Dans les années 1920, le Conseil de la recherche médicale tentera de mettre au point son propre vaccin, sans succès.
Avant le vaccin mis au point par Calmette et Guérin, Emil Adolf von Behring avait développé un vaccin contre la tuberculose bovine qu'il croyait être la cause des tuberculoses pulmonaires humaines (via l'ingestion de lait de vaches porteuses de Mycobacterium bovis). Ce vaccin, constitué de bacilles de type humain vivants et desséchés, s'avérera inefficace et même dangereux. Il n'en inspira pas moins les travaux de Calmette qui, en 1908, partageait les vues de Berhring quant à l'étiologie de la tuberculose humaine ainsi qu'il s'en expliqua à un Congrès international. Saturnin Arloing avait déjà conduit des travaux très aboutis dans le domaine de la vaccination contre la tuberculose bovine. À l'Institut Pasteur de Nantes, Gustave Rappin suivait aussi depuis 1894 une piste prometteuse, à des fins tant préventives que thérapeutiques ; n'aboutissant pas avant 1924, ces efforts seront éclipsés par ceux de Calmette et Guérin, tandis que leur simple souvenir aura sans doute eu à pâtir des prises de position ultérieures de Rappin lui-même.
En 1888, Pavlovsky réussit à ensemencer la surface de tranches de pommes de terre, milieu riche en amidon, avec des parcelles de culture du Bacille de la tuberculose (humaine) sur gélose glycérinée. En 1893, Sander montre que l'apport d'air accélère la croissance des cultures ; comme terrain de nutrition, la pomme de terre lui paraît devoir être préférée à la gélose glycérinée, et aux milieux d'origine animale.
En 1903, von Behring avance au congrès de Cassel que la tuberculose, quel que soit le siège de ses lésions, serait presque sans exception d'origine intestinale (contredisant ainsi la Baumgarten-Tangl law (en)).
En 1890, Grancher et H. Martin réussissent à vacciner quelques lapins par l'inoculation à virulences croissantes de cultures de tuberculose aviaire, tout d'abord affaiblies par le vieillissement. A. Möller obtient des résultats positifs d'immunisation (sur lui-même et sur des animaux) en se servant des cultures de tuberculose humaine, mais modifiées par un passage préalable sur l'orvet. Friedmann obtient une vaccination active chez des bovidés au moyen des bacilles tuberculeux de la tortue.
Invention du vaccin
À son retour d'Indochine (où il essaya la tuberculine en traitement du lupus tuberculeux et une forme cutanée et muqueuse de la lèpre), et après un court séjour à Paris, Albert Calmette prend la responsabilité du nouvel Institut Pasteur de Lille en 1895. Rejoint par le vétérinaire Camille Guérin en 1897, il y entame ses recherches sur la tuberculose (mécanisme de l'infection bacillaire, immunité antituberculeuse) en 1900 .
« Calmette et Guérin font ingérer des cultures de tuberculose d'origine bovine, humaine, aviaire et phléolique à des chevreaux, à des chèvres et boucs adultes par différents procédés : introduction directe de cultures dans les voies digestives, ou contamination du lait d'alimentation. Leur conclusion est que dans l'immense majorité des cas, la tuberculose se contracte non par l'introduction des bacilles dans les voies aériennes, mais par l'ingestion de produits bacillifères ».
Nocard leur fournit une culture de Mycobacterium bovis isolée d'une vache tuberculeuse en 1902.
En 1905-1906, ils constatent que de jeunes bovins guéris d'une tuberculose expérimentalement provoquée ne sont pas réinfectés. En 1906 les comptes-rendus hebdomadaires des séances de l'Académie des Sciences publient un article de Calmette et Guérin intitulé Sur la vaccination contre la tuberculose par les voies digestives. Cette même année, les annales de l'Institut Pasteur publiaient leur mémoire – le troisième ainsi nommé – intitulé Origine intestinale de la tuberculose pulmonaire.
Le , le journal Le Matin fait état des travaux de Calmette et Guérin ; le quotidien, qui évoque d'abord la possibilité prochaine du développement d'un vaccin destiné aux bovins, rapporte la conviction de Calmette que ce vaccin trouvera vite une utilisation en médecine humaine.
En 1908, une observation - ainsi peut-être qu'une indication du chercheur norvégien Kristian Feyer Andvord (en) – les met sur la voie de la découverte. Afin de rendre émulsifiable une culture glycérinée de la souche Nocard, ils y ajoutent de la bile de bœuf ; ils s'aperçoivent que les cultures faites ainsi perdent de leur virulence. Ils cultivent l'agent de la tuberculose bovine – Mycobacterium bovis – sur des tranches de pommes de terre immergées dans de la bile de bœuf stérile. En 1909, Calmette dépose sur le bureau de l’Académie des sciences une note décrivant le « bacille tuberculeux bilié ».
En 1912, après 96 mises en culture successives, ils parviennent à modifier la souche initiale qui devient inoffensive sur les bovins (elle reste pathogène pour le cheval). Ce bacille partiellement atténué prend alors le nom de « bilié Calmette-Guérin » (BCG).
En 1913, le vaccin est testé sur de jeunes bovins et des singes de différentes espèces.
Les recherches deviennent difficiles à poursuivre pendant la Première Guerre mondiale : Lille est alors occupée par les Allemands ; les vaches sont réquisitionnées pour nourrir les troupes d'occupation ; Calmette autopsie les animaux et les déclare sains.
En 1919, Albert Calmette reconstitue à l'Institut Pasteur de Paris une équipe de travail (Camille Guérin, Auguste Boquet et Léopold Nègre) sur le bacille tuberculeux (Boquet, Nègre et Jean Valtis auront la responsabilité de la préparation du vaccin BCG jusqu'en 1928, date d'arrivée de Guérin à Paris). Les expériences de vaccination des bovidés avec la souche biliée, entreprises en 1912, furent reprises entre 1921 et 1927. Conçu à l'origine pour un usage vétérinaire, le vaccin est testé par Henri Vallée en 1921 dans une ferme expérimentale modèle à Fécamp : Vallée procède par injections intraveineuses ou par insertion sous la peau ; il n'obtient pas un taux de protection à 100 %.
Premiers essais
La toute première inoculation humaine, en intraveineuse sur un homme adulte, en montre l'innocuité.
Le vaccin est aussi essayé sur des nouveau-nés le à la crèche de la maternité de l'hôpital de la Charité, à Paris. Le pédiatre Benjamin Weill-Hallé et le Dr Raymond Turpin vaccinent d'abord un nouveau-né dont la mère était morte de la tuberculose quelques heures après l'accouchement et qui était appelé à vivre dans un milieu contaminé. La santé de l'enfant étant établie après une période d'observation de six mois, la vaccination est étendue à d'autres nouveau-nés de l'hôpital de la Charité, d'abord de 1921 à 1922 puis de 1922 à 1924. Les résultats de ces vaccinations sont présentés devant l'Académie de médecine par A. Calmette, C. Guérin et leurs collaborateurs le . Le premier , l'Institut Pasteur créée le premier centre de production et de distribution gratuite de BCG ; le vaccin est distribué gratuitement aux médecins qui en font la demande ; en échange ceux-ci s'engagent à retransmettre un certain nombre d'informations.
Le vaccin a aussi été testé sur des singes anthropoïdes sur le site de l'Institut Pasteur établi en Guinée, à Kindia, dont Calmette fut un temps directeur. C'est en 1922 qu'est signée une convention entre l'Institut Pasteur et le gouvernement général de l'Afrique-Occidentale française fondant en Guinée française l'établissement auquel sera donné le nom de Pastoria. La direction de l'établissement, qui couvre 35 ha, est confiée au vétérinaire-commandant R. Wilbert en 1923 ; Maurice Delorme en devient l'assistant en 1925. À partir de 1937 une production de vaccin BCG se fait sur place.
Premières campagnes
La vaccination se développe à partir de 1924, notamment dans les dispensaires. Calmette distribue alors sa souche à de très nombreux bactériologistes, qui la repiquent de nouveau, donnant ainsi naissance à des centaines de souches « filles ». Cette même année 1924, les ministères de la Défense nationale et des Colonies décident que les laboratoires de Tananarive, Saïgon et Dakar devront procéder à la vaccination de la population infantile et des troupes indigènes. Si les vaccinations débutent effectivement dès 1924-1925 à Madagascar et en Indochine, l'Institut Pasteur de Brazzaville ne commence les premiers essais de vaccination qu'en .
Benjamin Weill-Hallé et Raymond Turpin effectuent des vaccinations à l’École de puériculture de Paris. Entre 1925 et 1927, Couvelaire vaccine à Baudelocque : 305 nouveau-nés.
Entre et la Compagnie des mines de Béthune vaccine 850 enfants. En 1927, Calmette publie une étude faite sur 21 200 enfants vaccinés qui conclut à l'efficacité du vaccin. Ces publications de l'année 1927 rencontrent très rapidement des critiques, en France d'abord où le Dr José Lignières remet en question l'innocuité totale du BCG, mais aussi à l'étranger avec le Britannique Greenwood et le Suédois Arvid Wallgren qui soulignent, eux, la fragilité des preuves statistiques de Calmette (Wallgren fut cependant un promoteur actif du BCG en Suède).
Une adoption par les autres pays contrastée
Dès 1925, au Canada, le Conseil de la recherche médicale met en place l'Associate Committee for research on tuberculosis and BCG pour étudier tant l'utilisation humaine que vétérinaire. F. A. Baudouin initie des essais cliniques en 1925. Armand Frappier y conduit également des recherches.
En 1927, Petroff affirme avoir réussi à isoler d'une culture BCG une variante virulente. Les travaux de Petroff reçoivent un écho important et suscitent de nombreuses études en Europe (on objectera aux résultats de Petroff une possible contamination accidentelle ; le décès de Petroff de tuberculose apportera un argument à cette hypothèse). Entre 1927 et 1941, la Fondation Rockefeller, en lien avec l'Henry Phillips Institute et l'université de Pennsylvanie, conduit un programme en Jamaïque ; y est notamment étudié un vaccin expérimental élaboré à partir de bacilles tués par la chaleur (contrairement au BCG qui est un vaccin dit vivant, c'est-à-dire atténué). D'abord effectuée sur des malades mentaux, après que son innocuité ait été testée sur des cobayes, l'essai clinique est étendu à 11 000 personnes de Kingston.
À partir de 1927, Olaf Scheel et Johannes Heimbeck de l'hôpital de l'école d'infirmière Ullevaal Hospital à Oslo, conduisent deux programmes de vaccinations distincts chez des élèves infirmières (respectivement jusqu'en 1936 et 1939). C'est la première fois que le vaccin était proposé en injection à des adultes. Ces études, critiquées pour n'avoir pas recouru à des groupes de contrôle, ont été d'une très grande importance : c'est sur la base de leurs résultats que le programme norvégien de vaccination BCG d'après guerre fut conçu ; il servit de référence à d'autres pays.
La vaccination ne se développe que lentement en France dans les années 1920 (en Scandinavie en revanche elle se généralise plus facilement). Elles sont à ce moment surtout le fait des dispensaires et des services hospitaliers.
En 1928, Ludwik Rajchman le directeur d'une agence sanitaire de la Société des Nations convie à Paris une conférence au sujet du BCG. Présidée par Émile Roux, elle organise son travail autour de trois commissions, clinique, vétérinaire, bactériologique. La conférence confirme sans hésitation l'innocuité du vaccin. Concernant son efficacité en revanche, elle est moins affirmative ; d'après ses conclusions le vaccin engendre seulement « un certain degré d’immunité ». La commission, qui a accordé toute son attention aux arguments d'ordre statistique développés par Greenwood, assortit son avis de recommandations devant guider ultérieurement la recherche. Est notamment recommandée l'introduction, lors des essais, de groupes de contrôle. La même année, une commission vétérinaire internationale, comprenant l'Italie, les Pays-Bas, l'Autriche, la Pologne, l'Allemagne et la France, préconise d'étendre la vaccination BCG au bétail.
En 1930, éclate le drame de Lübeck : sur 251 enfants vaccinés, 72 enfants meurent d'une tuberculose généralisée, 131 autres développent une tuberculose clinique avec guérison et 41 ne présentent aucun symptôme mais font une conversion tuberculinique. Le gouvernement allemand intente un procès contre l'Institut Pasteur. Le procès s'ouvre fin 1931. Léopold Nègre démontre que le BCG n'est pas en cause : une erreur a été commise par le laboratoire qui a préparé le vaccin sur place : il a été accidentellement contaminé. Le tribunal exonère le BCG et conclut à une contamination accidentelle. À l'époque, en l’absence de connaissances génétiques, la question d'un retour à la virulence ne peut toutefois être exclu.
Le , une circulaire du ministre de la Santé publique rappelle « le grand intérêt » de la vaccination par le BCG.
En 1933, les recommandations officielles portant sur la lutte contre la tuberculose bovine n’instituent pas l'obligation de la vaccination BCG. Celle-ci est laissée à la discrétion des éleveurs.
Lancement d'études épidémiologiques
En 1935 est créée la Commission du BCG de l'institut Pasteur dont Antoine Marfan est le directeur (Calmette est décédé en 1933). Cette même année, en réponse aux objections formulées par la commission internationale en 1928, Calmette conçoit, avec l'aide du statisticien Yves Biraud, un programme randomisé avec groupe de contrôle en Algérie, dans la Kasbah. C'était une entreprise alors novatrice, qui ne sera surpassée en taille d'échantillon que par l’essai sur la streptomycine après la deuxième guerre mondiale. En 1935 toujours, Aronson et Palmer organisent les premiers essais, au hasard, du BCG dans des réserves indiennes aux États-Unis et en Alaska (R. G. Ferguson (en), directeur de la ligue antituberculeuse de la Saskatchewan, conduit des campagnes de vaccination entre 1933 et 1943 chez des enfants aborigènes et des infirmières).
Dans les années 1940, Jörgen Lehmann (en) met en évidence l'activité antituberculeuse de l'acide para-aminosalicylique, qui ne commencera véritablement à être utilisé qu'à compter de 1948.
Le réel développement d'après-guerre (mais ni aux États-Unis, ni en Grande-Bretagne, ni aux Pays-Bas)
En 1944, la Suède légifère.
En 1946, la Croix-Rouge danoise organise la vaccination par le BCG en Pologne, Autriche, Hongrie et Yougoslavie ; l’année suivante, elle étend son action aux zones d’occupation américaine et britannique en Allemagne.
En 1947, la Norvège rend la vaccination obligatoire pour les personnes testées négatives à la tuberculine.
En lien avec l'UNICEF (décision de Lake Success du ), les organisations de la Croix-Rouge danoise, norvégienne et suédoise fondent l'International Tubercolisis Campaign ou Joint Enterprise, un programme qui se propose d'aider tout pays européen à mener une vaccination pédiatrique de masse et qui s'étendra ensuite à d'autres parties du monde. L'OMS apporte une aide technique.
En , le premier congrès international du BCG, organisé à l'Institut Pasteur, admet que le vaccin occasionne une immunité « relative ».
En 1949, le Joint Enterprise, le Danish Statens Seruminstitut et l'OMS coordonnent leurs efforts pour étudier différentes questions soulevées à l'occasion des campagnes de vaccination généralisées.
Après la guerre, des études de grande ampleur sont menées, suivant des méthodologies distinctes, en Grande-Bretagne et aux États-Unis.
En 1950, la vaccination est rendue obligatoire en France.
Dans les années 1950 est mise en évidence l'activité antituberculeuse de l'isoniazide, qui commence à être utilisée à partir de 1952.
En 1974, le vaccin BCG est intégré par l'UNICEF dans son programme de vaccination infantile.
Le BCG réévalué
En 1997, dans un document mettant en avant la Stratégie DOTS, l'OMS attribue l'échec de la lutte mondiale contre la tuberculose à plusieurs raisons, dont une « confiance exagérée dans le BCG », avec ainsi des moyens de lutte moindre mis en oeuvre (dépistage, traitement), sans pour autant remettre en cause l'efficacité du vaccin.
Nouveaux vaccins antituberculeux
Le premier nouveau vaccin utilise un vecteur viral présentant l'antigène 85A porté par la souche Ankara de la vaccine (code de ce vaccin MVA85A). Cette première tentative a déçu dans un essai conduit en Afrique du Sud chez les enfants. Deux autres vaccins mettant en œuvre des souches de mycobactéries modifiées génétiquement sont en cours d'étude : VPM1002 et MTBVAC. Les premières évaluations ont été faites chez des enfants pour améliorer la protection vaccinale.
La société GlaxoSmithKline a développé un vaccin antituberculeux constitué d'une protéine recombinante :M72. Cette protéine est dérivée de deux antigènes immunogéniques de Mycobacterium tuberculosis (Mtb32A et Mtb39A). On associe à cette protéine antigénique un système adjuvant dénommé AS01. Ce candidat vaccin est connu sous son nom de code M72/AS01E. L'étude de phase II a montré une innocuité acceptable et l'apparition d'immunité humorale et cellulaire aussi bien chez des volontaires sains que chez des personnes atteintes du VIH .
Un essai portant sur des personnes porteuses de Mycobacterium tuberculosis mais ne présentant pas de symptômes de la maladie, montre que les personnes vaccinées ont une probabilité plus faible de développer une tuberculose .
Mode d'action
Le BCG est un germe injecté vivant. Son efficacité est basée sur le principe de l'immunité de surinfection, c'est-à-dire qu'il n'a d'efficacité que tant qu'il reste vivant dans l'organisme (généralement tapi dans un ganglion lymphatique). Il s'agit d'une immunité à médiation cellulaire. Cela explique que le vaccin peut « ne pas prendre ». Dans ce cas, les tests restent négatifs, et une nouvelle vaccination s'impose[réf. nécessaire]. Cela explique aussi que les tests peuvent devenir négatifs (disparition du BCG vivant dans l'organisme). Il faut alors vacciner de nouveau.
Modalités d'administration
En 1921, Benjamin Weill-Hallé procéda à la vaccination par voie orale. Ce mode d'administration a les faveurs des médecins français jusqu'après l'instauration de l'obligation vaccinale en 1950 alors que les pays scandinaves préconisent dès avant la Seconde Guerre mondiale l'administration par voie sous-cutanée, voire intradermique. La voie intradermique est initiée par le Professeur Arvid Wallgren en 1927 à Göteborg. En 1939, le Dr Sol Roy Rosenthal envisage l'administration du BCG par multi-ponction en raison de l’incidence élevée des réactions indésirables avec la voie intradermique. La voie sous-cutanée occasionnait de nombreux abcès froids qui devaient être aspirés ou traités chirurgicalement ; à compter de 1935, ce mode d'administration est délaissé.
En France, la vaccination se pratique actuellement plutôt par scarification (chez les nourrissons) ou par voie intradermique.
Sous sa forme fraîche, le vaccin est très fragile car sensible à la lumière et à la chaleur. Conditionné sous forme desséchée, il se conserve plusieurs mois à +4 °C mais doit être utilisé dans les 24 heures de sa mise en suspension.
L’article 9 du décret du prévoyait : « les sujets soumis à la vaccination obligatoire et qui vivent dans un milieu comportant un risque de contamination, devront, avant la vaccination, être mis à l’abri de la contamination pendant une durée de 2 mois. » Inapplicable en pratique, cette disposition fut ensuite abrogée.
Efficacité
D'après une méta-analyse de 2014, le BCG conserve une efficacité importante contre la maladie, et souligne l'importance de vacciner les enfants dès la naissance. D'après cette même méta-analyse, il n'existe pas de différence d'efficacité entre les différentes souches de BCG.
Si on étudie l'évolution de la régression de la tuberculose depuis le XIXe siècle dans de nombreux pays, on constate objectivement qu'elle a régressé avant la découverte des antituberculeux, ou de la vaccination. Les épidémiologistes l'interprètent essentiellement par l'amélioration des conditions d'hygiène et nutritionnelles.
Innocuité
Les taux d'effets indésirables varient selon la souche du vaccin, la dose et la méthode d'immunisation, ainsi que l'âge du vacciné.
Les effets indésirables sont plus fréquents chez les plus jeunes vaccinés et sont généralement associés à une mauvaise technique d'administration et surtout une dilution insuffisante. Le vaccin actuel est administré par injection intradermique, et non pas intramusculaire. En France, le flacon BCG comprend 10 à 20 doses de vaccins.
Les effets indésirables du BCG sont habituellement localisés (bécégite), bénins et ne nécessitent pas de traitement :
- apparition d'un érythème, d'une papule ou d'une ulcération au point de ponction, avec cicatrice dans les suites ;
- ulcération cutanée persistante ;
- adénite inflammatoire (inflammation du ganglion axillaire du côté du bras vacciné), parfois importante ou suppurée (fréquence : 0,2 à 4,0 pour 1 000 vaccins) ;
- formation de cicatrices chéloïdes inesthétiques ;
C'est lorsqu'il préexiste un déficit immunitaire que s'observent des complications plus graves.
- Bécégite disséminée : la bécégite disséminée est une complication très grave, parfois mortelle, survenant dans un tiers des cas chez des enfants présentant un déficit immunitaire combiné sévère (DICS) ; le nombre total de bécégites disséminées est estimé à une douzaine de cas par an en France. La bécégite s’observe le plus fréquemment chez des enfants vaccinés avant l’âge de six mois, voire d’un an.
Une enquête parrainée par l'Union internationale contre la tuberculose et les maladies respiratoires, a permis de répertorier 10 371 complications à la suite de 1,5 milliard de vaccinations par le BCG chez des adultes et des enfants.
Réglementation vaccinale
En France
En France, le vaccin est d'abord rendu obligatoire, par voie de circulaire, en 1947 pour certains groupes professionnels (élèves infirmières ou assistantes sociales, étudiants en biologie et en médecine et pupilles de l’État). En 1949 des projets de loi, gouvernementaux puis parlementaires évoquent la généralisation de l'obligation. Celle-ci intervient en 1950 (Loi no 50-7 du ). De 1950 à 2007 pour les enfants scolarisés. L’obligation de vaccination par le BCG chez l’enfant et l’adolescent a été suspendue officiellement au cours de l'été 2007 (décret no 2007-1111 du ), au profit d’une recommandation de vaccination d'une population plus ciblée.
Saisi le par le directeur général de la santé sur l'opportunité du maintien de l'obligation vaccinale chez les professionnels de santé, le Haut Conseil de la santé publique (HCSP) recommande le la levée de l’obligation de vaccination par le BCG pour les professionnels et étudiants des carrières sanitaires et sociales mentionnés aux articles L.3112-1, R.3112-1 C et 2 du Code de la santé publique, accompagnée d’un maintien du test tuberculinique comme test de référence lors de prise de poste. Le HCSP recommande une vaccination par le BCG, au cas par cas, après évaluation des risques par le médecin du travail uniquement pour les professionnels de santé très exposés tuberculino-négatifs. Une évaluation de l'impact épidémiologique de la suspension de l’obligation vaccinale par le BCG et mesure de la couverture vaccinale a été faite par l'INVS (publication 2012).
Recommandations vaccinales
Selon l'avis du CSHPF du , les enfants à risque élevé de tuberculose et relevant donc d'une recommandation forte de vaccination, sont les suivants :
- enfants nés dans un pays de forte endémie tuberculeuse
- enfants dont au moins l'un des parents est originaire d'un de ces pays
- enfants devant séjourner au moins un mois d'affilée dans l'un de ces pays
- enfants ayant des antécédents familiaux de tuberculose (collatéraux et ascendants directs)
- enfants dans toute situation jugée par le médecin à risque d'exposition au bacille tuberculeux, notamment enfants vivants dans des conditions de logement défavorables ou socio-économiques défavorables ou précaires ou en contact régulier avec des adultes originaires d'un pays de forte endémie
- enfants résidant en Île-de-France ou en Guyane
Le CSHPF recommande également la vaccination de tout enfant dont les parents sont demandeurs, sauf contre-indication.
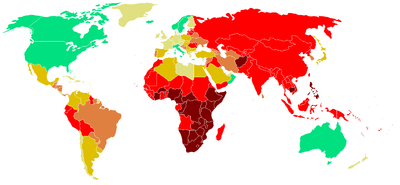
Les zones géographiques à forte incidence tuberculeuse sont, d'après l'OMS :
- l'Afrique, en particulier subsaharienne ;
- l'Asie, y compris les pays du Proche et du Moyen-Orient ;
- les pays d'Amérique centrale et du Sud ;
- les pays d'Europe centrale et de l'Est, y compris les pays de l'ex-URSS ;
- dans l'Union européenne : la Bulgarie, l'Estonie, la Hongrie, la Lettonie, la Lituanie, la Pologne, le Portugal, la Roumanie.
- les enfants à risques de tuberculose, tels que définis par le CSHPF, représentent 14 % de l'ensemble des enfants et environ les trois quarts des cas de tuberculose au même âge.
Contre-indications
Du fait qu'il s'agit d'un germe vivant, le vaccin est contre-indiqué chez les personnes immuno-déprimées, y compris les personnes porteuses du VIH ou celles traitées par corticoïdes ou autres immuno-dépresseurs, ainsi qu'aux personnes porteuses d'affections malignes.
Chez la femme enceinte, le vaccin est déconseillé, même en cas de risque de tuberculose. Dans cette situation, la surveillance radiologique de la future mère permet de détecter des lésions pulmonaires débutantes, et d'introduire après des prélèvements bactériologiques un traitement antituberculeux si nécessaire. Le but est d'éviter une contamination du nouveau né. Cet enfant sera à vacciner dès sa naissance par le BCG
Le site d'injection ne doit pas être porteur d'eczéma.
Enfin, le vaccin est illogique chez les personnes traitées par médicaments antituberculeux.
Effets protecteur contre certaines formes graves d'autres maladies
Plusieurs études expérimentales, sur le modèle animal ou humain, ont mis en avant un rôle immunomodulateur des mycobactéries notamment des études ciblant les mécanismes immunitaires de développement des troubles atopiques dans le cadre de l'«Hypothèse hygiéniste». Il a été postulé puis démontré que l'exposition précoce à Mycobacterium tuberculosis ou à des mycobactéries non-tuberculeuses comme Mycobacterium vaccae diminue le risque d'atopie. Le BCG est lui même utilisé comme adjuvant immunologique.
On a aussi remarqué que des« vaccins vivants » autres que le BCG (dont le vaccin contre la rougeole ou celui, oral, contre la polio) provoquent chez l'enfant des changements métaboliques et épigénétiques durables qui améliorent la réaction du système immunitaire inné face à d'autres infections que la tuberculose. Cet effet collatéral des vaccins vivants, a priori positif, est mal compris. Il semble passer par un processus dit d'« entraînement immunitaire » ; qui pourrait être une sorte de reprogrammation épigénétique d'une partie du système immunitaire. Le système immunitaire réagit alors mieux et plus rapidement à un large éventail d'infections (pulmonaires notamment) ; au delà de la seule tuberculose et la convalescence serait moins longue.
Ainsi :
- Des essais (contrôlés randomisés) ont en Guinée-Bissau (pays à forte mortalité infantile) démontré que le BCG-Danish a fait chuter la mortalité néonatale (toutes causes confondues) de 38%, essentiellement car il a diminué la mortalité par pneumonie et septicémie chez les nourrissons.
- Et en Afrique du Sud, le BCG a fait chuter de 73% les infections des voies respiratoires chez les adolescents. Des essais contrôlés ont montré que le BCG réduisait la virémie d'autres virus à ARN (ex : 70% de réduction de la virémie du vaccin contre la fièvre jaune de 71% chez les volontaires aux Pays-Bas.
- Dans le modèle animal murin, il a fortement réduit la gravité des encéphalomyocardites virales induites par le mengovirus chez la souris de laboratoire.
- le BCG a un rôle de protection contre les mycobactéries atypiques.
- hors du domaine des maladies infectieuses, le BCG est utilisé comme agent anticancéreux. Depuis 1976, des instillations intra-vésicales de BCG peuvent être pratiquées comme traitement curatif des cancers de la vessie n'envahissant pas le muscle et à fort risque de récidive.
BCG et test tuberculinique
Le BCG fausse la réaction à la tuberculine, compliquant le dépistage de la tuberculose. Cela explique, en partie, le choix de santé publique fait aux États-Unis de ne pas systématiquement vacciner les enfants, puisque cela irait à l'encontre de la politique de détection et de guérison des formes latentes de la tuberculose.
Remarque
À l'origine, vaccin BCG signifie vaccin bilié de Calmette et Guérin. Cela vient du fait que la souche bactérienne en question a été obtenue par passage sur un milieu bilié comme mentionné ci-dessus. Ainsi, on parle du vaccin bilié de Calmette et Guérin lorsque l'on parle du vaccin BCG. Cependant, beaucoup traduisent « Bacille de Calmette et Guérin ».
Production du vaccin
On ne dispose pas d'échantillons des souches originales du vaccin BCG développé par Calmette en 1921 ni même de la souche de Mycobacterium bovis à partir de laquelle il fut développé.
Toutes les souches utilisées pour produire le vaccin sont issues de celle préparée entre 1908 et 1921 par Calmette et Guérin. Ces souches se sont différenciées jusque dans les années 1960/1965, moment à partir duquel les techniques de stockage par lyophilisation stoppèrent ce processus de différenciation. En 2001 on comptait 18 fabricants de vaccin pour 7 souches utilisées qui se distinguent par leur immunogénicité et par les procédés industriels dont elles sont issues. Les souches Copenhague, Tokyo (ou tokyo-172 apportée par Kiyoshi Shiga au Japon en 1924), Glaxo et Pasteur sont les plus utilisées.
Mycobacterium microti
Mycobacterium microti découvert par Wells dans les années 1930, et nommé par lui, vole bacillus, fut nommé plus tard Mycobacterium tuberculosis var. muris, faute de pouvoir être distingué alors de Mycobacterium tuberculosis. Un vaccin atténué fut utilisé en Tchécoslovaquie de 1951 à 1969 tandis que des essais furent conduits en Grande-Bretagne de 1950 à 1952 avec des formes non atténuées.
Pistes de recherche
Une étude de 2019 a montré qu'une immunisation par voie intraveineuse pourrait considérablement accroitre l'efficacité du vaccin contre la tuberculose (sur le modèle animal ; macaque rhésus) alors que jusqu'ici, le BCG était placée juste sous la peau (voie sous-cutanée). Ces résultats aident à mieux comprendre les mécanismes de la protection vaccinale contre la tuberculose. Reste à montrer que cette voie améliorerait aussi l'efficacité vaccinale chez enfants, adolescents et adultes humains, sans effets secondaires inacceptables.
Le BCG protège-t-il contre les formes graves de la Covid-19 ?
- En , une prépublication laisse penser que les populations vaccinées par le BCG semblent avoir manifesté, non pas un moins grand nombre de cas, mais de moindres complications induites par la Covid-19 et une moindre mortalité. Selon ce travail, des pays sans vaccination obligatoire par le BCG (Italie, Pays-Bas, États-Unis selon les auteurs) ou des pays n'ayant cette politique que « depuis peu » (Iran, depuis 1984) étant plus touchés. Mais cette étude, pré-publiée (avant validation par des pairs) est basée sur des informations et des comptages acquises de janvier à (et donc encore limités, notamment pour les cas asymptomatiques). De plus elle présente des biais et de possibles facteurs de confusion. Parmi ces derniers figurent notamment la non prise en compte du niveau de qualité des services de santé, de la densité de la population, de son niveau de revenu, des origines ethniques, de l'âge médian des sujets, de l'incidence de la tuberculose dans le territoire, de la part de population urbaine, des taux de certaines maladies chroniques, du temps écoulé depuis le début de propagation du virus dans la communauté, des stratégies antipandémie ou encore le taux de dépistage du CoV-2.
- Une seconde étude n'a pas cherché à éliminer ces biais, mais a plutôt observé les différences entre pays où un rappel du BCG est administré et ceux où ce rappel n'est pas pratiqué (et dans ce cas, les auteurs n'ont pas trouvé de différence significative entre ces deux stratégies vaccinales).
- Une autre « corrélation » a été mise en évidence par des chercheurs japonais : le temps de doublement (TD) du nombre total de décès par Covid-19 est significativement corrélé à la couverture vaccinale pour le BCG dans 47 pays étudiés (32 où le BCG est obligatoire et 15 où il ne l'est pas) (il ne s'agit pas nécessairement d'un lien causal) ; et la souche vaccinale Tokyo 172-1 (utilisée au Japon, en Irak, en Corée du Sud, en Malaisie et au Pakistan semble plus protectrice que les autres, car dans les pays qui l'utilisent le nombre de morts ne doublait que tous les 6,5 jours (valeur médiane) alors qu'il doublait tous les 3,3 jours (valeur médiane) dans les 27 autres pays vaccinés (médiane 3,3 jours).
- Le sujet fait l'objet d'autres recherches ; en particulier, on teste chez les personnes âgées l'effet de la vaccination par le BCG sur la prévention de l'infection sévère au Covid-19. Et une étude en Allemagne teste une souche vaccinale recombinante dérivée du BCG (VPM1002) pour voir si elle protège ou non les agents de santé et/ou des patients âgés contre la Covid-19 . En Avril, deux essais cliniques randomisés contrôlés étaient en cours aux Pays-Bas (sur 1000 personnes) et en Australie (sur 4 000 personnes) pour mesurer les effets éventuels du BCG-Danish sur l'incidence, la gravité et la durée de la Covid-19 chez les agents de santé (et en termes d'absentéisme au travail). Et d'autres essais étaient en préparation en Allemagne, Espagne, Etats-Unis et France (avec un essai clinique en double aveugle préparé avec l'Inserm à l’institut Pasteur de Lille). Ces essais nécessitent de suivre les participants durant 2 à 3 mois. S'il est vérifié que le vaccin BCG (ou un autre inducteur d'immunité) peut protéger contre la Covid-19, la réponse à la pandémie pourrait être améliorée en attendant un vaccin dédié ou une atténuation naturelle de la pathogénicité du virus (pour rappel : plus de 3 milliards de personnes sont déjà vaccinées par BCG dans le monde).
Sous réserve de validation des données et qu'il existe un lien de cause à effet, le BCG pourrait peut-être contribuer à mieux protéger les agents de santé et certaines personnes vulnérables contre les formes sévères de la Covid-19. Les experts (dont au sein de l'INSERM et de l'Institut Pasteur en France), et l'OMS () restent très prudents : « ces effets n'ont pas été bien caractérisés et leur pertinence clinique est inconnue ». Le , l'OMS rappelait qu'à ce jour rien n'indiquait encore que le BCG soit protecteur contre le SARS-CoV-2. En l'absence de preuve l'OMS, ni aucune autorité de santé, ne recommandent pas de vaccination supplémentaire (hors vaccination vaccination néonatale dans les pays ou zones « à forte incidence de tuberculose »).
Plusieurs arguments incitent en effet à la prudence :
- les indices mis en avant par Miller & al, suggérant qu'il y a moins de formes graves de Covid-19 dans les pays où le BCG est systématique sont, comme l'ont souligné les auteurs, de type « corrélation » et non des « preuves », de même pour l'étude japonaise.
- de nombreux biais et facteurs de confusion sont encore à prendre en compte pour confirmer l'hypothèse du BCG protecteur contre la Covid-19 ;
- on ignore combien de temps l'effet collatéral espéré (s'il existe, car il est encore à démontrer) persistera après vaccination ou après un rappel de vaccination ; on sait déjà que les monocytes induits perdurent plusieurs mois, mais leur capacité accrue à sécréter des cytokines diminuent progressivement par la suite.
- on ignore aussi quel serait le moment optimal pour vacciner un adulte (soignant par exemple) (les études existantes sur le bénéfice de BCG sur les infections respiratoires de l'enfant et la mortalité ont mis en avant les avantages d'une vaccination précoce : avant 9 mois par rapport à la fin de l'enfance). Il est possible que l'âge de vaccination influence aussi l'effet du BCG sur la Covid-19.
- le monde est en outre déjà en pénurie de BCG. Ce vaccin qui est l'un des moins chers au monde, et dont l'efficacité pour la lutte contre la tuberculose a été nuancée par l'OMS elle-même en 1997 n'intéresse plus l'industrie pharmaceutique. C'est notamment le cas des États-Unis où Merck (seul fabricant de BCG aux Etats-Unis) a limité sa production ; c'est aussi le cas de la France où en 2014 l’ANSM alertait sur les arrêts d'approvisionnement par Sanofi, la pénurie s'est même aggravée en 2020, au point que l'ANSM et l'AFU (association française d'urologie) a demandé au laboratoire MEDAC de contingenter en France les vaccins BCG pour les distribuer à ceux qui en ont le plus besoin (population à risque, cancers de la vessie). on n'a pas encore d'études montrant que les patients atteints d'un cancer de la vessie et traité par le BCG sont aussi protégés contre la Covid-19
Une utilisation « aveugle » du BCG aboutirait donc à une relance de la tuberculose en zone de risque et/ou pourrait nuire à plusieurs types de thérapies anticancéreuses ; - des pays où le BCG a été obligatoire (comme en France jusqu'en 2007) ne semblent pas particulièrement protégés ; mais l'étude japonaise note qu'il existe plusieurs types de souches vaccinales pour le BCG, génétiquement différentes (au début des années 2010, 90% des BCG dans le monde appartenaient à quelques souches génétiquement différentes : Copenhague, Pasteur 1173 P2, Danish 1331, Glaxo 1077 (dérivée de la souche Danish), Tokyo 172-1, Russe BCG-I et Moreau RDJ) qui pourraient, chacune avoir des effets différents face au SARS-CoV-2 .
- les effets bénéfiques « collatéraux » du vaccin BCG (s'ils sont confirmés pour la COVID) pourraient aussi être modifiés par l'administration ultérieure d'un vaccin différent (une étude a en 2014 montré que chez l'enfant, l'ordre dans lequel les vaccins sont faits a une importance : le BCG prémunit mieux l'enfant contre les infections aiguës des voies respiratoires inférieures s'il a reçu le BCG avant le DT-Polio.
- « si le vaccin BCG n'est pas efficace contre le COVID-19, la vaccination BCG pourrait engendrer un faux sentiment de Sécurité » ; en Inde par exemple, la couverture BCG est très importante, pourrait conduire à une inaction.
- il faut vérifier l'innocuité du BCG en contexte de Covid-19 par des essais randomisés pour éviter « une possibilité éloignée que la régulation à la hausse de l'immunité par le BCG exacerbe la COVID-19 chez une minorité de patients atteints d'une maladie grave ».

En effet, les auteurs de l'étude ont constaté que "chaque augmentation de 10 % du déploiement du vaccin BCG est associée à une réduction de 10,4 % de la mortalité due au Covid-19". Les observations figurant dans l'étude ont été effectuées sur 22 pays dans le monde entier, socialement comparable (accès au soin, infrastructures, niveau d'urbanisation, etc.).
Les pays qui n'ont pas de programme national de vaccination du BCG auraient une mortalité plus importante due au Covid-19, en comparaison aux pays qui ont un programme BCG bien établi. Le vaccin du BCG, qui protège de prime abord contre la bactérie de Koch, responsable de la tuberculose, entrainerait une immunité largement renforcée contre les infections respiratoires et générerait une puissante stimulation immunitaire contre la Covid-19. Cependant, ces travaux ne concluent pas, à une relation directe de cause à effet entre le vaccin BCG et le Covid-19, mais à une simple corrélation. Les recherches doivent donc se poursuivre pour savoir si, effectivement, l'incidence du vaccin est réelle ou s'il s'agit d'une simple coïncidence.
- une pré-publication (du ) note que si la recherche de corrélation se limite aux pays ayant un taux élevé de leur population testée (plus de 2 500 tests par million d'habitants) on ne trouve plus d'association significative entre couverture vaccinale par BCG et nombre de cas de Covid-19 par million d'habitants.
- enfin, lors des syndromes de type maladie de Kawasaki développés par certains enfants sévèrement infectés par le coronavirus de la Covid-19, la zone cutanée de vaccination par le BCG devient parfois enflammée et indurée (voir image ci-contre).
Postérité
Le BCG fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en ).
Un bâtiment de l'École nationale vétérinaire d'Alfort (ENVA), inauguré en 2014, a été nommé en l'honneur des créateurs de ce vaccin. Ce bâtiment s'appelle bâtiment Camille-Guérin (ou BCG).
Le , la poste française émet un timbre pour Wallis-et-Futuna dans le cadre de l'anniversaire de la « 1re inoculation du BCG ». La dessinatrice du timbre est Huguette Sainson.
Notes
Références
Voir aussi
Bibliographie
- (en) Thomas Dormandy (1999). The White Death: A History of Tuberculosis. Chapter 30 Vaccines. (ISBN 0-8147-1927-9) HB - (ISBN 1-85285-332-8) PB
- (en) Comstock GW. The International Tuberculosis Campaign: a pioneering venture in mass vaccination and research. Clin Infect Dis 1994;19(3):528-40. PMID 95110996
- (en) Lamm DL, Blumenstein BA, Crawford ED, Montie JE, Scardino P, Grossman HB, Stanisic TH, Smith JA Jr, Sullivan J, Sarosdy MF, et al. A randomized trial of intravesical doxorubicin and immunotherapy with bacille Calmette-Guerin for transitional-cell carcinoma of the bladder. N Engl J Med 1991;325:1205-9. PMID 192220
Articles connexes
- Tuberculose humaine
- Vaccinations mortelles de Lübeck
- Bernhard Lauritz Frederik Bang promoteur de la méthode Bang (abattage systématique des bovins)
- Armand Frappier le défenseur de l’application rationnelle de la vaccination antituberculeuse par le BCG au Canada.