Tumeur fibreuse solitaire
| Spécialité | Oncologie |
|---|
| ICD-O | M8815/0 |
|---|---|
| MedlinePlus | 000116 |
| MeSH | D054364 |
Une tumeur fibreuse solitaire est une tumeur rare le plus souvent bénigne, parfois très volumineuse, développée à partir des fibroblastes contenus dans les tissus mous de l'organisme. La plèvre, dans le thorax, est le site le plus fréquent, mais toute région anatomique est susceptible de développer l'une de ces tumeurs. La première description remonte à 1931.
Les signes cliniques sont souvent frustes, en raison de la lenteur d'évolution ; ils apparaissent lorsque la tumeur, qui peut être très volumineuse, comprime les organes voisins. Par ailleurs, les tumeurs fibreuses solitaires peuvent être accompagnées d'un syndrome paranéoplasique, où la sécrétion d'une substance par la tumeur entraîne d'autres symptômes.
Les examens d'imagerie permettent de préciser la taille et la localisation exactes de la tumeur. Le diagnostic est affirmé par l'analyse de la tumeur, souvent par biopsie, qui permet également d'évaluer son potentiel d'agressivité.
Le traitement des tumeurs fibreuses solitaires est la chirurgie, qui vise à retirer la masse tumorale dans sa totalité avec une marge de sécurité.
Découverte historique
La première description d’une tumeur fibreuse solitaire remonte à 1931 ; il s’agit alors d’une tumeur au niveau de la plèvre et elle est réalisée par les Américains Paul Klemperer et Coleman Rabin.
Les médecins anglais Arthur Purdy Stout et Margaret R. Murray ont de nouveau décrit ces tumeurs en 1942, sous le nom d'hémangiopéricytome et ont identifié leur nature mésenchymateuse. Le nom d'hémangiopéricytome a ensuite été utilisé pour des tumeurs voisines mais considérées à tort comme distinctes des tumeurs fibreuses solitaires ; il désigne aujourd'hui une entité controversée de tumeurs malignes des tissus mous, proches des sarcomes. La classification de l'OMS des tumeurs des tissus mous a d'ailleurs supprimé l'hémangiopéricytome (dans les localisations extra-crâniennes) de sa liste ; les formes tissulaires ont été rattachées aux tumeurs fibreuses solitaires, et les formes périvasculaires aux tumeurs des muscles lisses.
De nombreux termes ont été utilisés durant le XXe siècle pour désigner les tumeurs fibreuses solitaires : tumeurs fibreuses localisées, mésothéliome fibreux localisé, mésothéliome fibreux solitaire, fibrome sous-séreux, fibrome sous-mésothélial…
Épidémiologie
Les enfants comme les adultes peuvent développer des tumeurs fibreuses solitaires, mais le diagnostic est le plus souvent posé entre 50 et 70 ans. L'âge est plus avancé pour les tumeurs pleurales que pour celles des autres localisations et le sex ratio est équilibré.
Il s'agit d'une maladie rare avec seulement 900 cas publiés dans la littérature médicale en 2011 et 800 patients opérés aux États-Unis entre 1973 et 2012. La fréquence, difficile à déterminer, est estimée à 2,8 pour 100 000. Les tumeurs fibreuses solitaires sont responsables de moins de 2 % des tumeurs des tissus mous.
La cause est inconnue. Un mécanisme de formation a cependant été décrit, avec la fusion, au sein des cellules tumorales, de deux gènes (NAB2 et STAT6) entre les chromosomes 12 et 13.
Il n'existe pas de facteur de risque environnemental ou génétique identifié.
Manifestations cliniques
Localisations
En raison de la rareté de la maladie, peu de grandes séries de patients sont publiées, rendant difficile l'analyse de la répartition entre les différents sites. Cependant, la majorité des cas rapportés atteignent la plèvre. Cette fine membrane, qui recouvre la surface des poumons et l'intérieur de la paroi thoracique, est le siège le plus fréquent des tumeurs fibreuses solitaires. La fréquence estimée d'une localisation pleurale varie entre 40 % et 70 %. La majorité des tumeurs pleurales est développée à partir de la plèvre dite viscérale, qui tapisse le poumon (entre 65 et 80 % des tumeurs fibreuses pleurales). Cependant, une étude radiologique publiée en 2015 retrouve davantage de tumeurs pariétales.
Les autres sites les plus touchés sont les autres séreuses de l'organisme : le péritoine et, dans une moindre mesure, le péricarde. Les tumeurs fibreuses solitaires sont cependant susceptibles de se développer dans l'ensemble des tissus mous, en particulier le système nerveux central et le rétropéritoine ou le médiastin, mais aussi plus rarement le rein, le pancréas, le pelvis et l'œsophage. L'ensemble des localisations abdominopelviennes constitue environ un tiers des tumeurs. Les tissus mous des membres, de la tête (en particulier de l'orbite, de la fosse infratemporale et des sinus) et du cou peuvent eux aussi être le siège de ces tumeurs.
Les localisations neurologiques concernent dans 4 cas sur 5 le cerveau, les autres atteignant la moelle épinière et intéressent surtout les adultes de plus de 30 ans (90 % des cas), mais des cas ont été décrits chez des enfants et des adolescents. Les tumeurs fibreuses solitaires atteignant les méninges sont considérées comme plus proches des hémangiopéricytomes que les tumeurs des autres sites.
Signes cliniques
Une tumeur fibreuse solitaire progresse de manière silencieuse, sans signe clinique spécifique dans 90 % des cas. Lorsqu'elle est présente, la symptomatologie varie selon la localisation, et apparaît généralement lorsque la tumeur devient compressive. Les tumeurs fibreuses solitaires peuvent en effet être très volumineuses, en particulier dans le thorax et l'abdomen, où leur diamètre peut atteindre jusqu'à 40 cm. La plupart mesurent entre 5 et 10 cm. Les localisations pleurales de plus de 15 cm sont dites « géantes ».
Lorsque la tumeur est superficielle et palpable, elle se présente comme une tuméfaction souple et indolore, évoluant depuis plusieurs années. La réalisation plus fréquente de radiographies pulmonaires et de tomodensitométries depuis la deuxième moitié du XXe siècle permet par ailleurs de diagnostiquer plus tôt les tumeurs fibreuses solitaires pleurales, alors qu'elles sont encore asymptomatiques.
Les tumeurs pleurales sont asymptomatiques dans 72 % des cas ; lorsque les signes cliniques sont présents, ils sont dominés par la toux, la dyspnée et les douleurs thoraciques. Un épanchement pleural est parfois présent (environ 10 % des cas). Les tumeurs abdominales se manifestent par des douleurs abdominales et une constipation, parfois une rétention d'urine, et sont parfois accompagnées d'une tuméfaction palpable.
En cas de localisation dans le système nerveux central, les signes cliniques dépendent de la localisation exacte et de la taille de la tumeur, et vont de la simple céphalée ou de sensations vertigineuses aux crises d'épilepsie (totale ou partielle) ou au déficit moteur et au syndrome vestibulaire, voire à une hypertension intracrânienne. Les tumeurs spinales entraînent, elles, des douleurs rachidiennes, des déficits sensitifs ou moteurs, voire une myélopathie progressive et une paraplégie, selon le niveau de la compression. Les fonctions des sphincters sont généralement respectées.
Les tumeurs de la tête et du cou sont en règle générale peu symptomatiques et découvertes sur la palpation de la masse par le patient lui-même. Les formes orbitaires peuvent en revanche entraîner un ptosis, une diplopie et une exophtalmie unilatérale.
Si l'évolution naturelle des tumeurs fibreuses solitaires est mal connue, elle semble cependant lente, sur plusieurs années. Toutefois, après plusieurs années d'évolution à bas bruit, ces tumeurs peuvent progresser rapidement, ce qui justifie un traitement rapide une fois le diagnostic posé.
Syndromes paranéoplasiques
On observe parfois, associé à une tumeur fibreuse solitaire, un syndrome paranéoplasique. Ce terme recouvre l'ensemble des anomalies pouvant accompagner certains cancers. Ces anomalies ne sont pas en relation directe avec la tumeur, mais sont des manifestations survenant à distance de l'endroit où se développe le cancer, par production d'une substance par la tumeur. Il s'agit de syndromes rares, surtout retrouvés dans une minorité des cancers intrathoraciques et digestifs. Le syndrome paranéoplasique accompagne parfois la tumeur dans son évolution : il la précède souvent, régresse parfois avec son traitement, disparaît avec la guérison et réapparaît en cas de rechute. Son traitement consiste à traiter le cancer responsable.
Le plus fréquent est le syndrome de Doege-Potter, qui associe tumeur fibreuse solitaire et hypoglycémies. Il est présent lorsque la tumeur sécrète une hormone proche de l'insuline, appelée IGF-2, qui comme elle diminue le taux sanguin de glucose. Jusqu'à 80 % des tumeurs fibreuses solitaires expriment l'IGF-2, mais moins de 5 % des patients présentent des hypoglycémies vraies. D'autres syndromes paranéoplasiques peuvent être observés, comme l'ostéoarthropathie hypertrophiante pneumique, une atteinte articulaire, dont la fréquence varie dans les séries rapportées entre 2 et 20 %. La cause en est débattue et est rattachée à l'hypersécrétion par la tumeur soit d'acide hyaluronique, soit du facteur de croissance des hépatocytes.
Les syndromes paranéoplasiques sont moins fréquents dans les tumeurs atteignant le système nerveux que dans les autres localisations.
Bilan biologique
Il n'existe pas de marqueur sanguin dosable spécifique des tumeurs fibreuses solitaires.
Imagerie
De nombreux examens d'imagerie permettent d'explorer les tumeurs fibreuses solitaires, mais aucun ne permet de poser de diagnostic de certitude, qui est obtenue par l'analyse d'une biopsie ou de la pièce opératoire.
Les tumeurs fibreuses solitaires pleurales sont visualisées sur la radiographie thoracique comme des masses bien délimitées. Les clichés radiologiques standards sont cependant peu utiles pour les autres localisations.
En tomodensitométrie, quelle que soit la localisation, une tumeur fibreuse solitaire apparaît comme une masse tissulaire ovoïde ou lobulée, bien délimitée, refoulant les structures voisines sans les envahir. Elle se rehausse fortement après injection de produit de contraste. Les tumeurs de petite taille sont homogènes, mais les plus volumineuses présentent des plages hétérogènes de nécrose et d'hémorragie intra-tumorale. Il n'y a pas habituellement de calcifications et, lorsqu'elles sont présentes, elles sont de petite taille. Les tumeurs malignes peuvent se présenter accompagnées de nodules pulmonaires métastatiques, et tendent à être plus volumineuses et plus hétérogènes.
L'imagerie par résonance magnétique permet une exploration complémentaire dans certaines localisations. Elle est surtout réalisée pour les tumeurs du système nerveux central, du foie et du pelvis. Elle évalue mieux les différences de densité intra-tumorale et permet d'affirmer l'absence d'envahissement des tissus mous et des structures osseuses voisines. Les tumeurs fibreuses solitaires ont un aspect d'isosignal en séquence T1 et d'hypersignal en T2, et se rehaussent après l'injection de gadolinium. Cependant, dans le système nerveux central, elles ne présentent pas de critères caractéristiques permettant de poser un diagnostic de manière uniquement radiologique et, en pré-opératoire, sont souvent confondues avec un méningiome.
- Tumeur fibreuse solitaire du rétropéritoine
Le TEP scanner est utilisé afin de caractériser l'activité métabolique de la tumeur et de la différencier des tumeurs malignes. Le traceur est fixé de manière hétérogène et peu intense.
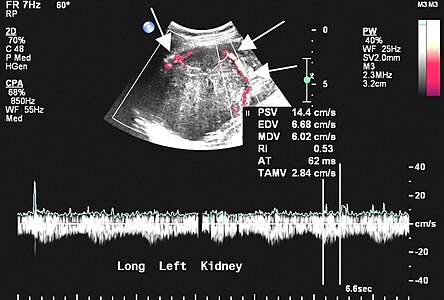
L'échographie est rarement réalisée pour les localisations pleurales, mais peut être utile dans les autres localisations. Les tumeurs fibreuses solitaires se présentent comme des masses homogènes, hypoéchogènes et bien délimitées ; le doppler permet de visualiser la vascularisation. Les tumeurs pleurales se mobilisent avec les mouvements ventilatoires.
L'angiographie est utilisée pour repérer la vascularisation des tumeurs intra-crâniennes. Celles-ci sont richement vascularisées par des branches artérielles naissant soit des carotides internes ou externes, soit du polygone de Willis, et il existe un blush tumoral tardif. Une autre application de l'angiographie est la réalisation d'une embolisation des artères nourricières de la tumeur, afin de diminuer le saignement pendant l'intervention.
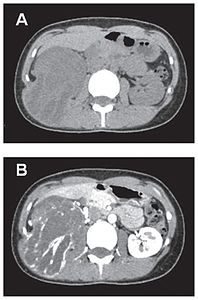
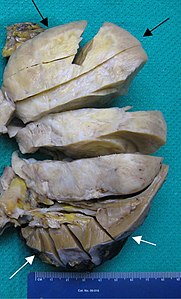
- Tumeur fibreuse solitaire du rein
Pièce opératoire de néphrectomie : la tumeur est d'apparence rosée, repérée par les flèches noires. Le rein normal est de couleur brune, sombre, en bas de l'image et repéré par les flèches blanches.
Démarche diagnostique
Le diagnostic clinique est difficile en raison de l'absence de signes spécifiques, et nécessite la réalisation d'examens complémentaires. Si le diagnostic peut être évoqué face à une imagerie typique, le diagnostic de certitude nécessite une approche anatomopathologique de la tumeur. La ponction sous scanner aide ainsi à poser le diagnostic et à orienter le traitement. En effet, les diagnostics différentiels sont multiples et dépendent de la localisation de la tumeur. Le plus fréquent est la fibromatose, mais toutes les tumeurs tissulaires sont concernées, en particulier l'histiocytofibrome, les sarcomes, et les tumeurs germinales.
Au moment du diagnostic, environ 14 % des patients présentent, en plus de la tumeur principale, des localisations dans d'autres organes, considérées comme des métastases.
Anatomie pathologique
Aspect macroscopique
La majorité des tumeurs fibreuses solitaires pleurales (75 à 80 %) se développe à partir de la plèvre viscérale et présente un pied d'implantation plus ou moins large à la surface du poumon. Ces tumeurs sont hypervascularisées et peuvent présenter une capsule. La vascularisation, abondante et ramifiée, est dite « en corne de cerf » (staghorn en anglais).
Histologie
L'histologie est l'étude des tissus biologiques. Dans le cadre des tumeurs, elle s'attache à l'identification de l'architecture des tissus, mais aussi aux divers récepteurs qu'ils expriment, afin d'identifier et de classifier les tumeurs. Elle apporte le diagnostic de certitude et permet d'orienter le traitement.
Les tumeurs fibreuses solitaires sont constituées de cellules mésenchymateuses, de différenciation fibroblastique. Elles sont ovoïdes ou fusiformes. Leur cytoplasme est riche en collagène. L'architecture tissulaire est hétérogène, supportée par un tissu conjonctif collagénique et alterne entre des zones bien fournies en cellules et des zones plus pauvres, où l'espace intercellulaire est plus riche en acide hyaluronique.
L'immunohistochimie retrouve l'antigène CD34 dans 80 % des cas, ce qui permet de différencier les tumeurs fibreuses solitaires des mésothéliomes. Les tumeurs expriment également la vimentine, mais aucune des cytokératines.
Aspect en microscopie optique (coloration H&E).
Il existe quelques variantes histologiques. Les tumeurs fibreuses solitaires dites « anaplasiques » ou « dédifférenciées » sont de moins bon pronostic et peuvent prendre l'aspect d'un sarcome pléomorphe. Les variantes myxoïdes et lipidiques ne modifient en revanche pas le pronostic. Les différents types de fusion entre les gènes NAB2 et STAT6 pourraient être à l'origine de ces variantes histologiques.
Agressivité
La majorité des tumeurs fibreuses solitaires est bénigne, mais certaines présentent des critères de malignité. L'OMS classe ainsi les tumeurs fibreuses solitaires comme des tumeurs de malignité intermédiaire.
La proportion de tumeurs fibreuses solitaires malignes varie selon les séries de 6 % à 23 %, voire un tiers des patients. Lors de l'analyse anatomo-pathologique, certaines tumeurs fibreuses solitaires présentent en effet des caractéristiques de tumeur maligne. La première définition des critères de malignité dans ces tumeurs a été réalisée par England en 1989. Il identifie ainsi une concentration cellulaire importante, une activité mitotique élevée, le pléomorphisme (aspect variable des cellules), et la présence d'hémorragie et de nécrose intra-tumorales. La perte d'expression de CD34 est fréquente. Cependant, ces caractéristiques histologiques d'agressivité ne sont pas toujours corrélées à un plus mauvais pronostic, et environ 2 % des formes bénignes évoluent de manière agressive.
Parmi les tumeurs pleurales, les formes bénignes sont plus souvent développées à partir de la plèvre viscérale, tandis que les formes malignes sont plus souvent implantées sur la plèvre pariétale.
Stadification
En 2002, de Perrot et coll. ont proposé une classification en stades de 0 (formes bénignes pédiculées) à IV (formes malignes métastatiques), destinés à homogénéiser la prise en charge et le suivi.
Traitement
Il n'existe pas de recommandation internationale spécifique sur le traitement des tumeurs fibreuses solitaires, qui est décrit avec celui des sarcomes des tissus mous. Il doit être discuté en réunion de concertation pluridisciplinaire entre les chirurgiens de la région concernée par la tumeur et les spécialistes des sarcomes (oncologues et radiothérapeuthes).
Chirurgie
Le traitement est chirurgical, basé sur la résection complète de la tumeur, avec de larges marges de sécurité (1 à 2 cm). L'opération permet généralement la guérison pour les tumeurs bénignes et la qualité des marges diminue le risque de récidive des formes malignes.
Les tumeurs pleurales peuvent être opérées par thoracotomie ou thoracoscopie. Lorsqu'elles sont appendues à la plèvre viscérale, une résection atypique pulmonaire suffit ; en cas de tumeur pénétrant dans le parenchyme pulmonaire, ou très proche des bronches lobaires ou des vaisseaux, une lobectomie pulmonaire peut être nécessaire. Les tumeurs développées à partir de la plèvre pariétale sont retirées avec celle-ci, et les marges de sécurité sont plus difficiles à obtenir.
Dans le cas des tumeurs développées à partir d'autres organes, la chirurgie est là encore considérée comme le traitement de référence.
Dans le cas des tumeurs les plus volumineuses, qui sont très vascularisées, l'intervention peut être précédée d'une embolisation des vaisseaux nourriciers de la tumeur, en radiologie interventionnelle, afin de diminuer le saignement peropératoire.
Traitements non chirurgicaux
En cas de résection incomplète lors de la chirurgie, la radiothérapie externe peut être utilisée, mais son usage doit être discuté au cas par cas. Les chimiothérapies classiques ne sont pas conseillées en post-opératoire.
En cas de tumeur inopérable, la place des chimiothérapies est difficile à préciser. Des essais ont été réalisés avec les molécules utilisées dans le traitement des sarcomes, avec une efficacité limitée. En revanche, des thérapies ciblées, en particulier l'association bévacizumab et témozolomide, ou le sunitinib, sont recommandées. D'autres molécules comme l'imatinib ou la trabectédine, ont également été essayées, avec des résultats prometteurs. Leur action anti-angiogénique, en diminuant la vascularisation de la tumeur, permettrait l'arrêt de sa croissance, sans pour autant en diminuer la taille. La recherche se porte également sur les molécules ciblant les récepteurs de l'IGF1, exprimés par les tumeurs fibreuses solitaires.
Pronostic et suivi
Le pronostic des tumeurs fibreuses solitaires est excellent, en particulier pour les formes bénignes . Selon les séries, la survie sans récidive à 5 ans est de 63 % à 90 %, et à 10 ans de 53 % à 73 % voire 86 %. Les récidives après traitement sont le plus souvent à distance, avec le développement de métastases dans d'autres organes, principalement dans le poumon, l'os et le foie. Une récidive locale est également possible, mais moins fréquente (10 % des patients). Les facteurs de risque de récidive après traitement sont : un âge plus avancé au diagnostic, la taille de la tumeur, une résection incomplète de la tumeur, son stage, et les signes de malignité à l'examen anatomo-pathologique. La résection complète est le principal facteur sur lequel il est possible d'agir.
Selon la localisation, un suivi tomodensitométrique ou par résonance magnétique est préconisé, mais sans consensus sur la durée, de 10 ans pour les uns et 2 ans pour les autres. En 2013, Tapias et coll. ont proposé, pour les tumeurs pleurales, un score de risque de récidive basé sur un système de points. Un score inférieur à 3 indique un risque nul de récidive à 15 ans. Le score analyse la localisation (plèvre pariétale ou viscérale), le caractère pédiculé ou non de la tumeur, la taille (plus ou moins de 10 cm), et les signes histologiques de malignité. Le but de ce score est de guider les modalités du suivi post-opératoire.
Références
Annexes
Bibliographie
Articles généraux :
- (en) Khin Thway, Wen Ng, Jonathan Noujaim et Robin L. Jones, « The Current Status of Solitary Fibrous Tumor: Diagnostic Features, Variants, and Genetics », International Journal of Surgical Pathology, vol. 24, , p. 281–292 (ISSN 1940-2465, PMID 26811389, DOI 10.1177/1066896915627485, lire en ligne, consulté le ) ;
- (en) Elizabeth G. Demicco, Min S. Park, Dejka M. Araujo et Patricia S. Fox, « Solitary fibrous tumor: a clinicopathological study of 110 cases and proposed risk assessment model », Modern Pathology, vol. 25, , p. 1298–1306 (ISSN 0893-3952, DOI 10.1038/modpathol.2012.83, lire en ligne, consulté le ).
Par localisation :
-
plèvre :
- (en) Rohan G. Thakkar, Sumeet Shah, Amol Dumbre et Mukta A. Ramadwar, « Giant solitary fibrous tumour of pleura -an uncommon intrathoracic entity- a case report and review of the literature », Annals of Thoracic and Cardiovascular Surgery: Official Journal of the Association of Thoracic and Cardiovascular Surgeons of Asia, vol. 17, , p. 400–403 (ISSN 2186-1005, PMID 21881330, lire en ligne, consulté le ) ;
- (en) Pierre Magdeleinat, Marco Alifano, Antonio Petino et Jean Philippe Le Rochais, « Solitary fibrous tumors of the pleura: clinical characteristics, surgical treatment and outcome », European Journal of Cardio-Thoracic Surgery, vol. 21, , p. 1087–1093 (ISSN 1010-7940, PMID 12048090, lire en ligne, consulté le ) ;
-
abdoment et pelvis :
- (en) Xue-Ming Li, Jing Reng, Peng Zhou, Ying Cao, Zhu-Zhong Cheng, Yan Xiao et Guo-Hui Xu, « Solitary fibrous tumors in abdomen and pelvis: Imaging characteristics and radiologic-pathologic correlation », World Journal of Gastroenterology, vol. 20, (PMID 24803820, PMCID 4009542, DOI 10.3748/wjg.v20.i17.5066, lire en ligne, consulté le ) ;
-
système nerveux central :
- (en) Michele Bisceglia, Carlos Galliani, Giuseppe Giannatempo et Walter Lauriola, « Solitary Fibrous Tumor of the Central Nervous System », Advances In Anatomic Pathology, vol. 18, , p. 356–392 (DOI 10.1097/pap.0b013e318229c004, lire en ligne, consulté le ).
Articles connexes
- Autres tumeurs des tissus mous :
- Localisations fréquentes :
Liens externes
- H. Bégueret, « Tumeur fibreuse solitaire », sur Respir.com, (consulté le ).
- « Tumeur fibreuse solitaire des tissus mous », sur Anabible, (consulté le ).