
Superfamille des immunoglobulines
La superfamille des immunoglobulines (IgSF) est une super-famille de protéines ayant en commun une structure tertiaire caractéristique des immunoglobulines. La structure de ces protéines contient un ou plusieurs domaines dits « de type immunoglobuline » (domaines Ig). Ces protéines sont impliquées dans les phénomènes d'interaction cellule-cellule et cellule-matrice extracellulaire.
Cette famille contient, outre les immunoglobulines, les molécules du complexe majeur d'histocompatibilité, des molécules d'adhésion cellulaire appartenant à la famille des Ig-CAM (en) (telles que les VCAM-1 (en), ICAM-1 ou NCAM (en)), des corécepteurs (telles que les molécules CD4 et CD8 intervenant dans l'activation des lymphocytes T), et certains récepteurs de cytokines.
Certaines de ces molécules ont un rôle crucial dans les interactions entre les cellules impliquées dans la réponse immunitaire. Le complexe majeur d'histocompatibilité de type I et de type II et les anticorps font en effet partie de cette superfamille. Certains membres de cette famille sont la porte d'entrée de virus tels que le virus du SIDA (récepteur de la molécule CD4) ou celui de la rage.
La plupart des membres de cette superfamille ne sont cependant pas des effecteurs du système immunitaire, car ils n'ont pas de partie variable et ne lient pas d'antigène.
Nature biomoléculaire
Les protéines membres de la superfamille des immunoglobines sont des glycoprotéines très souvent membranaires, mais parfois solubles trouvées en solution dans les liquides ou mucus du corps. Autour de 500 protéines exprimées par le génome humain ont été identifiées. Une analyse du génome humain a également suggéré que 2 % de l'ensemble des gènes coderaient pour des protéines IgSF.
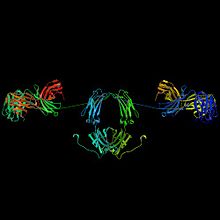
Un domaine de type immunoglobuline est constitué d'un repliement de la chaîne polypeptidique d'environ 100 acides aminés de long en 2 couches de feuillets beta antiparallèles qui se font face et qui forment une structure « sandwich-like ». Ce repliement est stabilisé par la présence d'un pont disulfure entre 2 résidus cystéine de la chaîne peptidique espacés de 50 à 70 acide aminés. Le domaine est généralement représenté sur les schémas de structure de ces protéines par une boucle fermée par le pont disulfure.
Voir aussi
Bibliographie
- Caractérisation des domaines des superfamilles IgSF et MhcSF et classification fonctionnelle dans IMGT Thèse de doctorat d'Élodie Duprat, Université Montpellier II, Science et techniques du Languedoc, 2005. (Discipline : Bioinformatique, 189 pages)