Raltégravir
| raltégravir | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | N-(2-(4-(4-fluorobenzylcarbamoyl) -5-hydroxy-1-méthyl-6-oxo-1,6-dihydropyrimidin -2-yl)propan-2-yl)-5-méthyl -1,3,4-oxadiazole-2-carboxamide | |
| No CAS | 518048-05-0 | |
| NoECHA | 100.124.631 | |
| Code ATC | J05AX08 | |
| PubChem | 54671008 | |
| SMILES | ||
| InChI |
InChI : vue 3D InChI=1/C20H21FN6O5/c1-10-25-26-17(32-10)16(30)24-20(2,3)19-23-13(14(28)18(31)27(19)4)15(29)22-9-11-5-7-12(21)8-6-11/h5-8,28H,9H2,1-4H3,(H,22,29)(H,24,30) InChIKey : CZFFBEXEKNGXKS-UHFFFAOYSA-N |
|
| Propriétés chimiques | ||
| Formule |
C20H21FN6O5 [Isomères] |
|
| Masse molaire | 444,416 3 ± 0,020 2 g/mol C 54,05 %, H 4,76 %, F 4,27 %, N 18,91 %, O 18 %, |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | "bonne" | |
| Considérations thérapeutiques | ||
| Classe thérapeutique | Antirétroviral : Inhibiteur d'intégrase | |
| Voie d’administration | Orale | |
| Grossesse | Contre-indiquée (catégorie C) |
|
| Précautions | surveiller la créatine kinase | |
| Unités du SI et CNTP, sauf indication contraire. | ||
|
modifier |
||
Le raltégravir est la dénomination commune internationale de l'Isentress, un inhibiteur de l'intégrase du VIH qui a obtenu son AMM européenne le . Cette molécule, brevetée par les laboratoires Merck & Co., est également connue sous son ancien nom de code, MK-0518. Plus précisément, il s'agit d'un inhibiteur de transfert de brins (INtegrase Strand Transfer Inhibitor, INSTI).
Posologie et effets secondaires
La posologie habituelle est de 400 mg, deux fois par jour (un essai conduit par Merck a évalué l'efficacité d'une monoprise quotidienne de 800 mg mais a conclu que cette posologie était moins efficace). En 2018, a été commercialisé une spécialité à 600mg, permettant une monoprise quotidienne de 1200 mg (équivalents aux 800 mg). Les comprimés ne doivent pas nécessairement être ingérés avec des aliments, contrairement à d'autres antirétroviraux.
Les effets secondaires les plus courants sont : nausées, vertiges, diarrhées, lipodystrophie. Chez certains patients on a pu observer une augmentation du taux de créatine kinase, sans pouvoir établir que ce problème était dû au médicament. Chez d'autres, très peu nombreux, une dépression préexistante a empiré temporairement à l'instauration du traitement sous Isentress, nécessitant même une hospitalisation dans un cas. Plus de quatre ans après l'approbation du médicament par la FDA, celle-ci a fait rajouter début un avertissement dans la notice des boîtes d'Isentress, afin de prévenir de la survenue, dans quelques cas très rares, du syndrome de Stevens-Johnson chez certains patients.
Le raltégravir étant une des seules molécules agissant sur l'intégrase du virus disponibles à l'heure actuelle ; on ne connaît pas de possibles effets secondaires à long terme (éventuel risque de cancer). De plus, on ne sait pas ce qu'il advient de l'ADN proviral, qui n'est plus intégré au génome de la cellule. Les essais sur les animaux ont montré une activité délétère sur le fœtus.
Efficacité et accessibilité
La molécule semble très puissante, malgré le peu de recul qu'on ait sur son utilisation. Elle permet notamment d'atteindre une charge virale indétectable plus rapidement qu'avec une trithérapie comprenant de l'éfavirenz.
Certaines souches de virus sont cependant résistantes à ce médicament, du fait d'une mutation sur le gène de l'intégrase.
Le médicament a obtenu l'accord de la FDA pour une mise sur le marché aux États-Unis en . Le prix d'une boîte de 60 comprimés (30 jours de traitement) était de 902,31 € en France lors de la mise sur le marché, mais Merck a revu le prix à la baisse : le prix pour un mois de traitement est en 2011 de 772,43 €.
À noter également : le raltégravir se diffuse bien dans le système nerveux central et le tractus génital, ce qui permet de diminuer respectivement le vieillissement du cerveau et la possibilité de contamination en cas de rapport sexuel non protégé. Le raltégravir est efficace contre le VIH-2, contrairement aux INNTI.
Le raltégravir a également fait ses preuves en tant que remplaçant de l'enfurvitide; l'Isentress remplaçant les injections biquotidiennes de Fuzeon, jugées difficiles à vivre par les patients. L'essai Trio (ANRS 139) a montré que dans le cadre d'une multithérapie, l'Isentress permettait d'obtenir, en association avec d'autres molécules récentes, un résultat «spectaculaire» sur des patients en échec thérapeutique.
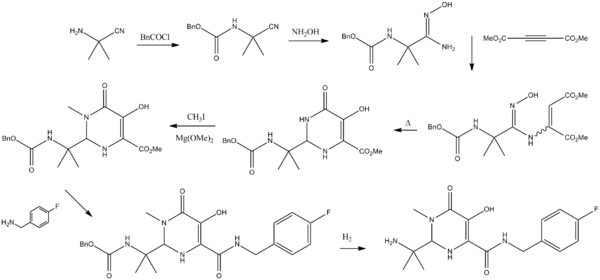
Synthèse de la molécule
K. M. Belyk, H. G. Morrison, P. Jones et V. Summa, 2007. Brevet WO 2006060730.
Perspectives
Deux essais visant à dispenser un traitement sans analogues nucléosidiques ou nucléotidiques ont été conduits : l'essai Spartan (raltégravir associé à de l'atazanavir non boosté), dont les résultats sont mitigés, et l'essai Progress (raltégravir associé au Kaletra), plus concluant.
La molécule, associée au maraviroc, permettrait de diminuer l'inflammation du système nerveux central causée par le VIH.
Des essais sont conduits afin de déterminer si l'Isentress, en association avec d'autres molécules, antirétrovirales ou non, permettrait de diminuer voire de supprimer les réservoirs viraux.
De récentes recherches ont également démontré que le raltégravir était actif sur certaines souches du HSV ; des études pourraient mener à la création d'un médicament efficace contre tous les virus de la famille de l'herpès.
L'intestin joue un rôle essentiel dans l'immuno-pathogenèse du virus de l'immunodéficience humaine (VIH). La diminution des niveaux de zonuline est corrélée à une mortalité accrue chez les patients VIH. Les traitements par maraviroc (antagoniste de récepteur de CCR5) et raltegravir (inhibiteur de l'intégrase) augmentent la zonuline. Ces données combinées suggèrent que la voie de la zonuline dans sa fonction d'immunité innée peut protéger contre l'infection par le VIH.
Autres inhibiteurs d'intégrase en développement
Deux autres molécules de la classe des anti-intégrase : l'elvitégravir de Gilead Sciences/Japan Tobacco, le MK-2048, elle aussi développée par Merck & Co. et le dolutégravir de ViiV Healthcare.
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) National Drug File
- (en) PatientLikeMe
- « Une fiche à propos du raltégravir »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) sur HIV Medication Guide (en français)
- Notice de l'Isentress sur le site de l'AFSSAPS
- (en) Un memento complet sur aidsmeds.com
- (en) Le site officiel, www.isentress.com
- Du nouveau sur les inhibiteurs d’intégrase, sur le site actions-traitements.org
- Plan de gestion de risque sur le site de l'AFSSAPS