Radiopharmacie
La radiopharmacie est une activité de pharmacie hospitalière publique ou privée qui se déroule au sein du service de médecine nucléaire. Le terme de radiopharmacie regroupe l’ensemble des moyens humains et matériels nécessaires à l’exercice de cette activité, qui utilise des sources radioactives non scellées pour la préparation de médicaments radiopharmaceutiques (MRP) utilisés en médecine nucléaire. Les missions du radiopharmacien sont d’assurer :
- la gestion, l’approvisionnement et la détention des médicaments radiopharmaceutiques, trousses, générateurs et précurseurs et de contribuer à la sécurisation du circuit des MRP ;
- la préparation des MRP ; les préparations radiopharmaceutiques stériles obtenues sont généralement multidoses, impliquant un respect strict des règles d’asepsie, en plus des règles de radioprotection relatives à la manipulation de sources radioactives non scellées ;
- le contrôle, et la dispensation nominative des MRP ;
- la double traçabilité des MRP, pharmaceutique et de leur radionucléide ;
- le contrôle des équipements et des locaux ;
- la gestion, en collaboration avec la personne compétente en radioprotection (PCR) des déchets radioactifs et assurer un rôle de formation et d’information auprès du personnel de l’établissement.
Les médicaments radiopharmaceutiques
Les médicaments radiopharmaceutiques utilisés dans les services de médecine nucléaire sont des médicaments contenant des radioéléments artificiels (REA), appelés radionucléides, employés à des fins diagnostiques ou thérapeutiques. Les radionucléides peuvent être utilisés : soit sous forme chimique très simple, soit liés à des vecteurs spécifiques d’un organe, d’une fonction physiologique ou d’une pathologie : molécules organiques, analogues de molécules biologiques, anticorps monoclonaux, particules (colloïdes, macro agrégats), cellules sanguines, etc.
Les médicaments radiopharmaceutiques se présentent
- soit sous forme de spécialités pharmaceutiques contenant des radionucléides, livrées prêtes à l’emploi (30 % des cas) ;
- Soit sous forme de préparations radiopharmaceutiques réalisées à partir de trousses, précurseurs, générateurs (70 % des cas).
La spécificité des médicaments radiopharmaceutiques repose sur plusieurs propriétés :
- la quantité injectée est infime, on parle de dose traceuse ;
- la durée d’utilisation du médicament peut être très courte (quelques minutes à quelques jours) en raison de la période physique du radionucléide ;
- ils se présentent sous la forme de sources non scellées, destinées à être administrées par voie veineuse, orale, respiratoire à des activités variables selon l’utilisation, l’âge et le poids du patient.
Matériel radioprotégé destiné à la préparation des médicaments radiopharmaceutiques : 1 : système de préparation et injection automatisé, 2 : enceinte blindée, 3 :pince, protège seringue et flacon blindés, 4 :valisette de transport.
Principe de marquage
Les médicaments radiopharmaceutiques peuvent être des radionucléides utilisés seuls sous une forme chimique simple (exemples : 123I−, 131I−, 201Tl+, 99mTcO4−,...). Mais le plus souvent, il s’agit de préparations au sein desquelles le radionucléide est associé à un vecteur ayant un tropisme particulier pour un organe, une fonction physiologique ou une pathologie. D’un point de vue chimique, cette association peut reposer sur :
- La fixation au ligand par une liaison simple, c’est le cas des halogènes (123I, 18F) monocoordinés. Ces molécules marquées sont obtenues par synthèses chimiques, biosynthèses ou échanges isotopiques.
- La complexation impliquant un site de complexation pouvant induire plusieurs liaisons métal-ligand, c’est le cas des métaux de transition et post-transition polycoordinés (99mTc, 111In)
Obtention et présentation des matières premières
Radionucléides
Les radionucléides peuvent être formés au cours de réactions nucléaires produites, soit dans un réacteur nucléaire, soit dans un accélérateur de particules (cyclotron par exemple).
Les produits de réacteurs sont obtenus par fission (99Mo) ou par bombardement neutronique d’une cible (131I, 125I, 32P).
Les produits de cyclotron sont obtenus après bombardement par des particules chargées (201Tl).
Les REA[Quoi ?] peuvent aussi provenir de générateurs (générateur de 99Mo/99mTc). Le radionucléide parent est un produit de réacteur ou de cyclotron qui se désintègre en donnant un élément fils de période physique plus courte que la sienne.
Le radionucléide fils est ensuite obtenu par élution du générateur au sein du service, au moment des besoins.
Molécules vectrices
Ces molécules peuvent être de nature très diverse : anticorps monoclonaux, particules (colloïdes, macroagrégats), cellules sanguines, etc. Les molécules vectrices sont commercialisées sous forme de trousses, correspondant à un ensemble de réactifs stériles, apyrogènes et pré-conditionnés capable de donner, après radiomarquage par le radionucléide choisi, le médicament radiopharmaceutique souhaité. Elles se présentent le plus souvent sous forme de flacons sous azote, contenant un lyophilisat.
Cas particuliers des trousses marquées au 99mTc
La préparation des trousses technétiées consiste en une réaction de réduction suivie d’une réaction de complexation avec les différents réactifs. L’éluat issu du générateur de 99Mo/99mTc se présente sous forme de pertechnétate de sodium (99mTcO4− Na+) à l’état d’oxydation +VII. Sous cet état, l’ion pertechnétate (99mTcO4−) n’a pas de propriétés complexantes. Le métal doit être réduit à des degrés d’oxydation inférieurs à VII pour pouvoir se lier aux différents ligands, d’où la nécessité d’un réducteur (Sn2+ par exemple) lors de l’étape de marquage. Le 99mTc peut alors présenter tous les degrés d’oxydation allant de - I à + VII et un nombre de coordination de 4 à 9. Pour éviter une éventuelle réoxydation, on y associe parfois un antioxydant (acide ascorbique, acide gentisique). Le marquage soit s’opérer dans des conditions de température et de pH bien précises.
Quelques exemples : 1 : Trousses destinées à être radiomarquées, 2 : générateur de 99Mo/99mTc, 3 : gélule d’iode 131, 4 : microsphères administrées au bloc de radiologie interventionnelle.
Critères de choix d’un médicament radiopharmaceutique
Critères de choix liés au radionucléide
Nature du rayonnement
En fonction de l’utilisation (diagnostique ou thérapeutique) du médicament radiopharmaceutique, le choix se fait entre :
- des radionucléides émettant principalement des rayonnements γ (détection externe permettant des explorations fonctionnelles),
- ou des radionucléides émettant principalement des rayonnements β− voir ɑ (irradiation localisée pour la thérapeutique).
Pour un usage diagnostique, les émetteurs γ purs (sans émission β− associée) sont préférables pour la radioprotection du patient.
Énergie du rayonnement
Le radionucléide doit posséder une énergie :
- suffisamment importante (> 20 keV) pour ne pas être absorbée par les tissus et permettre la détection des lésions ou organes profonds,
- pas trop grande (< 600 keV) pour permettre une détection optimale.
L’énergie, pour être adaptée aux gamma-caméras, doit être idéalement comprise entre 100 et 300 keV.
Période physique
Pour être utilisables en Médecine Nucléaire, les radiodionucléides doivent avoir une période physique suffisamment longue pour permettre une exploration correcte d’un organe ou l’étude d’un métabolisme mais aussi suffisamment courte pour ne pas entraîner une irradiation excessive du patient, inutile et nuisible. Les périodes physiques des radionucléides les plus couramment utilisés en Médecine Nucléaire vont de quelques heures à quelques jours.
Autres critères
Les radionucléides doivent avoir une radioactivité spécifique élevée, être obtenus les plus purs possible, être facilement disponibles et peu onéreux.
Critères de choix liés à la molécule vectrice et au médicament radiopharmaceutique
Notion d’organe cible
Ce sont les propriétés biologiques du vecteur (trousse) qui conditionnent les propriétés pharmacocinétiques du médicament radiopharmaceutique et sa spécificité. En effet, en fonction de la molécule vectrice utilisée, le médicament radiopharmaceutique aura un certain tropisme pour un organe à visualiser (diagnostique) ou à atteindre (thérapeutique).
Période biologique et période effective
La période biologique Tb est définie comme le temps nécessaire pour que l’organisme élimine la moitié des atomes ou molécules administrées. La période effective Te est définie comme le temps nécessaire pour que la radioactivité dans l’organisme diminue de moitié. Elle prend en compte la décroissance physique du radionucléide et son élimination biologique. Elle intègre donc la période physique (Tp) et la période biologique : 1/Te = 1/Tp + 1/Tb
Ainsi, la période physique longue d’un radionucléide peut être compensée par la période biologique courte du médicament radiopharmaceutique. Pour réaliser une exploration fonctionnelle, il est souhaitable que le médicament radiopharmaceutique administré ne soit pas éliminé avant la fin de l’examen mais ne stagne pas trop longtemps dans l’organisme en raison de l’irradiation qu’il provoque. Des périodes effectives de l’ordre de quelques jours maximums sont raisonnables.
Autres critères
- Modalités de préparation (rapide, aisée...) dépendant de la facilité ou non d’incorporation du marqueur à la molécule vectrice.
- Fiabilité et faisabilité du contrôle du marquage.
- Stabilité du marquage, compatible avec le temps nécessaire à la réalisation de l’examen scintigraphique.
Imagerie et médecine nucléaire
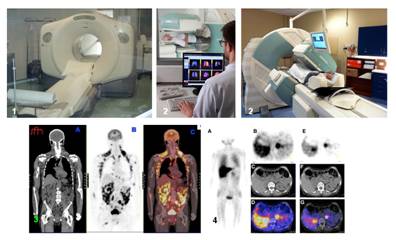
Exemples de caméra TEP/TDM (1) et TEMP/TDM (2) et d’images TEP (3) et TEMP (4).
Les actes diagnostiques (explorations scintigraphiques)
La majorité des médicaments radiopharmaceutiques est utilisée pour la réalisation de scintigraphies, permettant des explorations morphologiques et fonctionnelles de tout organe ou tissu. La plupart des organes peuvent faire l’objet d’une exploration scintigraphique (squelette, cœur, poumons, cerveau, thyroïde, reins…) ainsi que certaines pathologies (infections, tumeurs…) Ces scintigraphies utilisent des émetteurs de rayonnements γ ou des émetteurs de rayonnements β et γ dont l’énergie d’émission γ est habituellement comprise entre 70 et 511 KeV.
On distingue :
- La tomographie par émission monophotonique (TEMP).
- Elle repose sur la détection de photons gammas. Le radionucléide le plus fréquemment utilisé est le technétium (99mTc), d’autres radionucléides sont également utilisés : l’iode 123, l’indium 111 et le krypton 81m par exemple.
- La tomographie par émission de positons (TEP).
- Cette technique repose sur la détection en coïncidence de deux photons de 511 KeV, à la suite de l’annihilation du positon émis par le radionucléide β+, avec les électrons de la matière. La TEP connaît un essor important surtout en cancérologie, par le développement de molécules marquées au fluor 18. À ce jour, quatre médicaments disposent d’une autorisation de mise sur le marché (AMM).
- Le (18F]-fluorodésoxyglucose (18FDG), le plus utilisé, est le premier à avoir obtenu une AMM en France, en 1998. La TEP au 18FDG est un examen essentiel en oncologie pour le diagnostic et le suivi de certains cancers, pour la recherche de récidives et métastases ainsi que pour l’évaluation de la réponse à un traitement spécifique. Elle présente également une utilité clinique en neurologie et cardiologie. Les autres médicaments commercialisés sont :
- La [18F]-fluoroDOPA, indiquée en neurologie pour le diagnostic différentiel de la maladie de Parkinson au sein des syndromes extrapyramidaux ; et en oncologie (tumeurs neuroendocriniennes).
- La [18F]-choline, indiquée en oncologie (cancer de la prostate, carcinome hépatocellulaire).
- Le [18F]-Na est utilisé pour l’étude fonctionnelle des pathologies, structures osseuses notamment en oncologie (métastases osseuses des cancers de la prostate, du sein ou du poumon).
- Cette technique repose sur la détection en coïncidence de deux photons de 511 KeV, à la suite de l’annihilation du positon émis par le radionucléide β+, avec les électrons de la matière. La TEP connaît un essor important surtout en cancérologie, par le développement de molécules marquées au fluor 18. À ce jour, quatre médicaments disposent d’une autorisation de mise sur le marché (AMM).
Les actes thérapeutiques
D’autres médicaments radiopharmaceutiques sont indiqués en thérapie, par exemple dans le traitement des pathologies thyroïdiennes par l’iode 131 (hyperthyroïdie, cancer). La radiothérapie interne consiste à administrer un médicament radiopharmaceutique qui va se fixer dans le tissu ou l’organe qu’il doit sélectivement irradier, entraînant le blocage des processus de division cellulaire puis la mort cellulaire. La radioimmunothérapie utilise un MRP constitué d’un anticorps monoclonal sur lequel est fixé un radionucléide à visée thérapeutique. La radiothérapie utilise des radionucléides de haute énergie (de l’ordre du MeV) émetteurs β− (Iode 131, Samarium 153, Strontium 89, Yttrium 90). Certains radionucléides comme l’Iode 131 ou le Samarium 153 émettent, en plus, des rayonnements γ. Après administration de fortes activités d’Iode 131 (supérieures à 740 MBq), l’hospitalisation et l’isolement du patient en chambre radioprotégée sont nécessaires.
Les principales indications de la radiothérapie interne sont :
- Les pathologies thyroïdiennes comme l’hyperthyroïdie, les cancers différenciés par administration d’Iode 131.
- Le traitement palliatif des douleurs dues aux métastases osseuses ostéoblastiques (cancer du sein ou de la prostate) par du lexidronam marqué au samarium 153 (Quadramet), du chlorure de strontium 89 (Metastron), ou du dichlorure de radium 223 (Xofigo).
- Les carcinomes hépatocellulaires et les métastases hépatiques à l’aide microsphères radiomarquées à l’Yttrium 90.
- Les tumeurs neuroendocrines (phéochromocytomes malins, neuroblastomes de l’enfant, tumeurs carcinoïdes) avec l’iobenguane-131I (MIBG-131I).
- Les affections hématologiques tels que certains lymphomes non hodgkiniens par radioimmunothérapie avec administration d’un anticorps monoclonal anti-CD20 marqué à l’Yttrium 90.
- Les synoviorthèses qui consistent à administrer en intra-articulaire des colloïdes marqués avec un radionucléide (Erbium 169, Rhénium 186, Yttrium 90).
La radiothérapie interne s’est diversifiée par le développement de vecteurs (anticorps monoclonaux, peptides) et de précurseurs émetteurs bêta moins purs (Yttrium 90, Lutétium 177) ou alpha (radium 223, astate 211).
Cadre juridique
Sur le plan juridique, les médicaments radiopharmaceutiques, à visée thérapeutique ou diagnostique, livrés prêts à l’emploi ou préparés sur place, sont intégrés dans toutes les dispositions régulant l’utilisation des radionucléides et des médicaments. Vous trouverez ci-dessous les liens des principaux textes de lois concernant ces médicaments.
Cadre juridique relatif au médicament
L’encadrement réglementaire doit prendre en compte les normes relatives aux pratiques pharmaceutiques (hygiène, etc.) mais aussi la réglementation propre aux radionucléides.
Textes Communautaires
Les Directives EURATOM relatives à la protection radiologique des personnes soumises à des examens et traitements médicaux et à celle des populations et travailleurs contre les dangers résultants des rayonnements ionisants. [1]
Directive 65/65/CEE du (JOCE 09/02/1965). on entend par médicament « toute substance ou composition pouvant être utilisée chez l’homme ou chez l’animal ou pouvant leur être administrée, en vue d’établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique ». [2]
Directive du conseil no 89/343/CEE du (JOCE du ) qui a élargi le champ d’application des directives 65/65/CEE (modifiée par la directive 83/570/CEE) relatives aux spécialités pharmaceutiques. [3]
La Directive du conseil no 91/507/CEE qui a élargi le champ d’application de la directive 75/318/CEE (modifiée par la directive 87/19/CEE) relative aux spécialités pharmaceutiques. [4]
En France
Loi no 92-1279 du
Ces textes communautaires ont été transposés dans la loi no 92-1279 du (J.O. du 11.12.1992). [5]
Ordonnance n°2016-1729 du relative aux pharmacies à usage intérieur [6]
Décret no 2000-1316 du modifié
Certaines dispositions ont été précisées par le décret no 2000-1316 du relatif aux pharmacies à usage intérieur et modifiant le CSP (JO du ).[7]
Compétences du pharmacien
L’exercice de la radiopharmacie nécessite l’obtention du Diplôme d’Études Spécialisées Complémentaires (D.E.S.C.) de Radiopharmacie et Radiobiologie (ou équivalent), qualification réglementaire exigée à compter du (Arrêté du relatif aux qualifications et à la formation des pharmaciens utilisant des MRP dans les établissements de santé et les syndicats interhospitaliers – JO du ). [8]
Préparation radiopharmaceutique
Les textes de référence sont :
- Les Bonnes Pratiques de Pharmacie Hospitalière (2001) [9]
- Les Bonnes Pratiques de Préparation (2007) [10]
- Les Bonnes Pratiques de Fabrication (2014) [11]
Cadre juridique relatif aux médicaments dérivés du sang (MDS)
Les médicaments radiopharmaceutiques contenant de l’albumine humaine doivent faire l’objet d’une traçabilité au même titre que tout MDS (Art. 5121-181 à R.5121-201 du CSP)
Cadre juridique relatif aux médicaments radiopharmaceutiques expérimentaux
Les médicaments radiopharmaceutiques utilisés dans le cadre de recherches biomédicales doivent répondre à la fois à la législation relative aux médicaments expérimentaux (loi n°2004-806 du relative à la politique de santé publique – articles 88 à 97 – JO du ) et à celle relative aux radionucléides. Pour la réalisation des préparations rendues nécessaires par les recherches biomédicales, y compris la préparation des médicaments expérimentaux, la PUI doit avoir obtenu l’autorisation de l’ARS (délivrée sous réserve de disposer des moyens en locaux, personnel équipements et systèmes d’informations nécessaires). Cette autorisation précise également la forme pharmaceutique ou, à défaut, la nature des produits et, dans le cas de la préparation, les opérations réalisées (Art. R. 5126-9 et R.5126-16 du CSP).
Cadre juridique relatif aux radionucléides
Activité nucléaire et régimes d’autorisations
L’activité de radiopharmacie nécessite :
- L’autorisation de la PUI à réaliser la préparation de médicaments radiopharmaceutiques (Art. R5126-9 du CSP).
- L’autorisation pour l’utilisation et la détention en vue de leur utilisation de radionucléides ou produits ou dispositifs en contenant, à des fins médicales ou de recherche biomédicale étant soumises à un régime d’autorisation (Art. R.1333-24 du CSP).
La gestion des déchets radioactifs
Les principaux textes relatifs à la gestion des déchets sont :
- La circulaire DGS/DHOS n°2001-323 du . [12]
- La décision n°2008-DC-0095 de l’ASN du . [13]
Locaux et équipements
Les locaux techniques d’une unité de radiopharmacie doivent répondre aux exigences de l’Arrêté du et des Bonnes Pratiques de Préparations. [14]
Traçabilité et sécurisation
Le stockage, la préparation, la validation, la dispensation et l'administration doivent être tracés et historisés dans des registres afin de garantir les contrôles réglementaires. Des logiciels (Venus/Nicesoft, etc.) spécialisés permettent d'établir ces registres et de fournir les rapports pour les audits de contrôles. [15]
Liens utiles
- http://www.sofra-radiopharmacie.fr
- http://www.snrph.org
- http://www.ordre.pharmacien.fr/Le-pharmacien/Le-metier-du-pharmacien/Fiches-metiers/Hopital/Radiopharmacien
- http://www-instn.cea.fr/-DESC-de-Radiopharmacie-.html
- http://www.synprefh.org/pharmacie/activites-pui/radiopharmacie/index.phtml
- http://www.acomen.fr/index.php/groupe-radiopharmacie.html
- http://www.snphpu.org
- http://www.sfmn.fr/new/