Produit naturel
Un produit naturel est un composé chimique ou une substance produite par un organisme vivant, c'est-à-dire qui se trouve dans la nature. Au sens le plus large, un produit naturel est toute substance produite par la vie. Les produits naturels peuvent également être préparés par synthèse chimique (semi-synthèse et synthèse totale) et ont joué un rôle central dans le développement du domaine de la chimie organique en fournissant des cibles synthétiques difficiles. Le terme « produit naturel » a également été étendu à des fins commerciales pour désigner les cosmétiques, les compléments alimentaires et les aliments produits à partir de sources naturelles sans ingrédients artificiels ajoutés[source insuffisante].
Grâce aux améliorations techniques (programmes de criblage à haut débit, techniques de séparation et isolement), le nombre de produits naturels découverts au début du XXIe siècle dépasse le million (nombre sur-évalué par rapport à ce qui est accessible). 50 à 60 % de ces composés sont produits par les plantes et 5 % environ ont une origine microbienne. 20 à 25 % de ces produits sont des composés bioactifs naturels et près de 10 % sont isolés de micro-organismes (22 500 dont 9 000 sont issus des champignons).
Dans le domaine de la chimie organique, la définition des produits naturels se limite d'habitude aux composés organiques purifiés isolés de sources naturelles qui sont produits par les voies du métabolisme primaire ou secondaire. Dans le domaine de la chimie médicale, la définition se limite souvent aux métabolites secondaires. Les métabolites secondaires ne sont pas essentiels à la survie, mais procurent néanmoins aux organismes qui les produisent un avantage évolutif. De nombreux métabolites secondaires sont cytotoxiques et ont été sélectionnés et optimisés au cours de l'évolution pour être utilisés comme agents de « guerre chimique » contre les proies, les prédateurs et les organismes concurrents.
Les produits naturels ont parfois un effet thérapeutique bénéfique en tant que médicaments traditionnels pour le traitement des maladies, ce qui permet d'obtenir des connaissances pour en tirer des composants actifs en tant que composés tête de série (en) pour la découverte de médicaments (en). Bien que les produits naturels aient inspiré beaucoup des médicaments approuvés par l'Agence américaine des produits alimentaires et médicamenteux, leur mise au point (en) à partir de sources naturelles a fait l'objet d'une attention décroissante de la part des entreprises pharmaceutiques, en partie en raison d'un accès et d'un approvisionnement peu fiables, de problèmes de propriété intellectuelle, de la variabilité saisonnière ou environnementale de la composition et de la perte des sources causées par le rythme croissant d'extinction des espèces.
Classes
La définition la plus large d'un produit naturel est qu'il s'agit de tout ce qui est produit par la vie, y compris les matériaux biotiques (en) (p. ex. bois, soie), les matériaux d'origine biologique (p. ex. bioplastiques, amidon de maïs), les fluides corporels (p. ex. lait, exsudats végétaux) et d'autres matériaux naturels (en) (p. ex. sol, charbon). Une définition plus restrictive d'un produit naturel affirme qu'il s'agit un composé organique qui est synthétisé par un organisme vivant. Le reste du présent article se limite à cette définition plus étroite.
Les produits naturels peuvent être classés selon leur fonction biologique, leur voie de biosynthèse ou leur source, tels que décrit ci-dessous.
Fonction
Selon la proposition originale d'Albrecht Kossel en 1891, les produits naturels sont souvent divisés en deux grandes classes : les métabolites primaires et secondaires. Les métabolites primaires ont une fonction intrinsèque (propre) qui est essentielle à la survie de l'organisme qui les produit. En revanche, les métabolites secondaires ont une fonction extrinsèque (externe) qui affecte principalement d'autres organismes. Les métabolites secondaires ne sont pas essentiels à sa survie, mais ils augmentent la compétitivité de l'organisme dans son environnement. En raison de leur capacité à moduler les voies biochimiques et les voies de transduction du signal, certains métabolites secondaires ont des propriétés médicinales utiles.
Les produits naturels, en particulier dans le domaine de la chimie organique, sont souvent définis comme des métabolites primaires et secondaires. Une définition plus restrictive limitant les produits naturels aux métabolites secondaires est couramment utilisée dans les domaines de la chimie médicinale et de la pharmacognosie.
Métabolites primaires
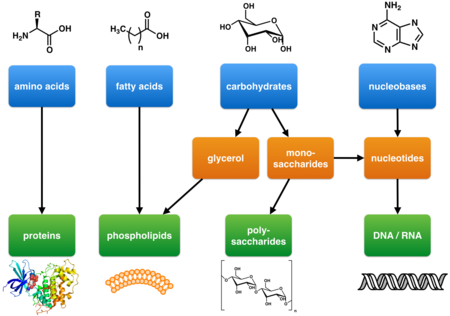
Les métabolites primaires tels que définis par Kossel sont des composants des voies métaboliques de base qui sont nécessaires à la vie. Ils sont associés à des fonctions cellulaires essentielles comme l'assimilation des nutriments, la production d'énergie et la croissance et le développement. Ils ont une large distribution d'espèces qui s'étendent sur de nombreux phyla et souvent plus d'un règne. Les métabolites primaires comprennent les glucides, les lipides, les acides aminés et les acides nucléiques qui sont les éléments de base de la vie.
Les métabolites primaires impliqués dans la production d'énergie comprennent les enzymes respiratoires et photosynthétiques. Les enzymes à leur tour sont composées d'acides aminés et souvent de cofacteurs non peptidiques qui sont essentiels à la fonction enzymatique. La structure de base des cellules et des organismes est également composée de métabolites primaires. Il s'agit notamment des membranes cellulaires (par ex. des phospholipides), des parois cellulaires (par ex. la peptidoglycane ou la chitine) et des cytosquelettes (protéines).
Les cofacteurs enzymatiques des métabolites primaires comprennent des membres de la famille de la vitamine B. La vitamine B1 sous forme de diphosphate de thiamine est une coenzyme pour la pyruvate déshydrogénase, la 2-oxoglutarate déshydrogénase et la transcétolase qui sont toutes impliquées dans le métabolisme des glucides. La vitamine B2 (riboflavine) est un constituant de la FMN et de la FAD qui sont nécessaires pour de nombreuses réactions redox. La vitamine B3 (acide nicotinique ou niacine), synthétisée à partir du tryptophane, est un composant des coenzymes NAD+ et NADP+ qui sont à leur tour nécessaires au transport des électrons dans le cycle de Krebs, à la phosphorylation oxydative, ainsi que de nombreuses autres réactions redox. La vitamine B5 (acide pantothénique) est un constituant de la coenzyme A, un composant de base du métabolisme des glucides et des acides aminés ainsi que de la biosynthèse des acides gras et des polycétides. La vitamine B6 (pyridoxol, pyridoxal et pyridoxamine) comme le pyridoxal 5′-phosphate est un cofacteur de nombreuses enzymes, en particulier les transaminases impliquées dans le métabolisme des acides aminés. La vitamine B12 (cobalamines) contient un anneau de corrine de structure similaire à la porphyrine et est une coenzyme essentielle pour le catabolisme des acides gras ainsi que pour la biosynthèse de la méthionine.
L'ADN et l'ARN qui stockent et transmettent l'information génétique sont composés de métabolites primaires d'acides nucléiques.
Les premiers messagers sont des molécules de signalisation qui contrôlent le métabolisme ou la différenciation cellulaire. Ces molécules de signalisation comprennent des hormones et les facteurs de croissance sont à leur tour composés de peptides, d'amines biogènes, d'hormones stéroïdiennes, d'auxines, de gibbérellines, etc. Ces premiers messagers interagissent avec les récepteurs cellulaires qui sont composés de protéines. Les récepteurs cellulaires activent à leur tour des seconds messagers qui relaient le message extracellulaire aux cibles intracellulaires. Ces molécules de signalisation comprennent les métabolites primaires, les nucléotides cycliques (en), le diglycéride, etc.
Métabolites secondaires
Contrairement aux métabolites primaires, les métabolites secondaires ne sont pas indispensables et ne sont pas absolument nécessaires à la survie. De plus, les métabolites secondaires ont généralement une distribution étroite des espèces.
Les métabolites secondaires ont un large éventail de fonctions. Il s'agit notamment des phéromones qui agissent comme molécules de signalisation sociale avec d'autres individus de la même espèce, des molécules de communication qui attirent et activent les organismes symbiotiques, des agents qui solubilisent et transportent les nutriments (tels que le sidérophores) et des armes concurrentes (tels que répulsifs, venins et toxines) qui sont utilisées contre leurs concurrents, proies et prédateurs. Pour de nombreux autres métabolites secondaires, la fonction est inconnue. Une hypothèse est qu'ils confèrent un avantage compétitif à l'organisme qui les produit. Selon un autre point de vue, par analogie avec le système immunitaire, ces métabolites secondaires n'ont pas de fonction spécifique, mais il est important d'avoir les machines en place pour produire ces diverses structures chimiques et quelques métabolites secondaires sont donc produits et sélectionnés pour cela.
Les classes structurales générales des métabolites secondaires comprennent les alcaloïdes, les phénylpropanoïdes, les polycétides et les terpénoïdes, qui sont décrits plus en détail dans la section sur la biosynthèse ci-dessous.
Biosynthèse
Les voies de biosynthèse menant aux principales classes de produits naturels sont décrites ci-dessous.
- Photosynthèse ou néoglucogenèse → oses → polysaccharides (cellulose, chitine, glycogène etc.)
- Voie de l'acétate → acides gras et polycétides
- Voie du shikimate → acides aminés aromatiques et phénylpropanoïdes
- Voie du mévalonate et methyletrythritol phosphate pathway → terpénoïdes et stéroïdes
- Acides aminés → alcaloïdes
Glucides
Les glucides sont une source d'énergie essentielle pour la plupart des formes de vie. De plus, les polysaccharides formés à partir de glucides plus simples sont des composants importants de la structure de nombreux organismes tels que les parois cellulaires des bactéries et des plantes.
Les glucides sont les produits de la photosynthèse végétale et de la néoglucogenèse animale. La photosynthèse produit initialement du glycéraldéhyde-3-phosphate, un sucre contenant trois atomes de carbone (un triose). Ce triose peut à son tour être transformé en glucose (un sucre contenant six atomes de carbone) ou en une variété de pentoses (des sucres contenant cinq atomes de carbone) selon le cycle de Calvin. Chez l'animal, les précurseurs à trois atomes de carbone que sont le lactate ou le glycérol peuvent être transformés en pyruvate qui, à son tour, peut être transformé en glucides dans le foie[réf. à confirmer].
Acides gras et polycétides
Par le processus de glycolyse, les sucres sont décomposés en acétyl-CoA. Dans une réaction enzymatique catalysée par l'ATP, l'acétyl-CoA est carboxylé pour former du malonyl-CoA. L'acétyl-CoA et le malonyl-CoA subissent une condensation de Claisen avec perte de dioxyde de carbone pour former l'acétoacétyl-CoA. D'autres réactions de condensation produisent successivement des chaînes poly-β-céto de poids moléculaire plus élevé qui sont ensuite converties en d'autres polycétides. Les produits naturels de la classe des polycétides ont des structures et des fonctions diverses et comprennent notamment les prostaglandines et les antibiotiques macrolides[réf. à confirmer].
Une molécule d'acétyl-CoA (l'« unité de départ ») et plusieurs molécules de malonyl-CoA (les « unités d'extension ») sont condensées par l'enzyme acide gras synthase pour produire des acides gras. Les acides gras sont des composants essentiels de la bicouche lipidique qui forme les membranes des cellules, ainsi que les réserves d'énergie sous forme de graisses chez les animaux[réf. à confirmer].
Sources
Les produits naturels peuvent être extraits des cellules, tissus et sécrétions de micro-organismes, de plantes et d'animaux. Un extrait brut (non fractionné) de l'une ou l'autre de ces sources contiendra une gamme de composés chimiques à la structure variée et souvent nouvelle. La diversité chimique dans le milieu naturel est basée sur la diversité biologique. Du coup, les chercheurs parcourent le monde pour obtenir des échantillons à analyser et à évaluer dans le cadre d'essais biologiques (en) ou d'essais pour découvrir des médicaments. Cet effort de recherche de produits naturels est connu sous le nom de bioprospection[réf. souhaitée].
La pharmacognosie fournit les outils nécessaires pour identifier, sélectionner et traiter les produits naturels destinés à un usage médical. Habituellement, le composé du produit naturel a une certaine forme d'activité biologique et ce composé est connu sous le nom de principe actif - une telle structure peut évoluer pour devenir une découverte de « tête de série ». De cette façon et par d'autres moyens, certains médicaments actuels sont obtenus directement de sources naturelles[réf. souhaitée].
D'autre part, certains médicaments sont développés à partir du produit tête de série naturel obtenu à l'origine de la source naturelle. Ce qui veut dire que la tête de série peut être[réf. souhaitée] :
- produite par synthèse totale, ou
- un point de départ (précurseur) pour un composé semi-synthétique, ou
- un cadre qui sert de base à un composé structurellement différent obtenu par synthèse totale ou partielle.
Ces différences s'expliquent par le fait que de nombreux produits naturels biologiquement actifs sont des métabolites secondaires aux structures chimiques souvent complexes. Cela présente l'avantage d'avoir de nouveaux composés, mais cette complexité rend également difficile leur synthèse ; au lieu de cela, le composé peut avoir besoin d'être extrait de sa source naturelle - un processus lent, coûteux et inefficace. il est du coup souvent plus avantageux de concevoir des analogues plus simples[réf. souhaitée].
Procaryote
Bactéries

La découverte fortuite de la pénicilline et le succès clinique qui a suivi ont incité à la recherche à grande échelle d'autres micro-organismes environnementaux qui pourraient produire des produits naturels anti-infectieux. Des échantillons de sol et d'eau ont été prélevés dans le monde entier, ce qui a conduit à la découverte de la streptomycine (dérivée de Streptomyces griseus) et à la prise de conscience que les bactéries, et pas seulement les champignons, représentent une source importante de produits naturels pharmacologiquement actifs. Ceci, à son tour, a conduit au développement d'un arsenal important d'agents antibactériens et antifongiques dont l'amphotéricine B, le chloramphénicol, la daptomycine et la tétracycline (de Streptomyces spp.), les polymyxines (de Paenibacillus polymyxa) et les rifamycine(d'Amycolatopsis rifamycinica (en)).
Bien que la plupart des médicaments dérivés de bactéries soient utilisés comme anti-infectieux, certains ont trouvé leur application dans d'autres domaines de la médecine. La toxine botulique (de Clostridium botulinum) et la bléomycine (de Streptomyces verticillus (en)) en sont deux exemples. Le botulinum, la neurotoxine responsable du botulisme, peut être injecté dans des muscles spécifiques (comme ceux qui contrôlent la paupière) pour prévenir les spasmes. De plus, la bléomycine glycopeptidique est utilisée pour le traitement de plusieurs cancers dont le lymphome de Hodgkin, le cancer de la tête et du cou et le cancer du testicule. Parmi les nouvelles tendances dans le domaine se trouvent le profilage métabolique et l'isolement de produits naturels à partir de nouvelles espèces bactériennes présentes dans des environnements sous-explorés. Il s'agit par exemple de symbiotes ou d'endophytes provenant de milieux tropicaux, de bactéries souterraines que l'on trouve dans les profondeurs du sous-sol grâce à l'exploitation minière ou aux forages, et de bactéries marines.
Archées
Parce que beaucoup d'archées se sont adaptées à la vie dans des environnements extrêmes tels que les régions polaires, les sources chaudes, les sources acides, les sources alcalines, les lacs salés et la haute pression des eaux océaniques profondes (en), elles possèdent des enzymes qui sont capables de fonctionner dans des conditions plutôt inhabituelles. Ces enzymes sont potentiellement utiles dans les industries alimentaire, chimique et pharmaceutique, où les processus biotechnologiques impliquent souvent des températures élevées, des pH extrêmes, des concentrations élevées en sel et/ou des pressions élevées. Parmi les enzymes identifiées à ce jour, on trouve les amylases, les pullulanases, les glycosyltransférases cyclodextrines, les cellulases, les xylanases, les chitinases, les protéases, l'alcool déshydrogénase et les esterases. Les archées représentent également une source de nouveaux composés chimiques, par exemple les éthers isoprénylglycériques 1 et 2 de Thermococcus S557 et Methanocaldococcus jannaschii (en), respectivement.
Eucaryotes
Fungi
Plusieurs médicaments anti-infectieux ont été dérivés de champignons, dont la pénicilline et les céphalosporines (antibactériens de Penicillium chrysogenum et Cephalosporium acremonium (en), respectivement) et la griséofulvine (antifongiques de Penicillium griseofulvum). Parmi les autres métabolites fongiques médicinalement utiles se trouvent la lovastatine (de Pleurotus ostreatus), qui est devenue le précurseur d'une série de médicaments qui abaissent le taux de cholestérol, la ciclosporine (de Tolypocladium inflatum (en)), qui est utilisée pour supprimer la réponse immunitaire après une greffe d'organe, et l'ergométrine (de Claviceps spp.) qui agit comme vasoconstricteur et est utilisée pour prévenir le saignement à la naissance. L'asperlicine (d'Aspergillus alliaceus (en)) est un autre exemple. L'asperlicine est un nouvel antagoniste de la cholécystokinine, un neurotransmetteur que l'on croit impliqué dans les crises de panique, et pourrait être utilisé pour traiter l'anxiété[réf. souhaitée].
Plantes

Les plantes sont une source importante de composés chimiques (phytochimiques) complexes et très diversifiés sur le plan structurel, cette diversité structurelle étant attribuable en partie à la sélection naturelle d'organismes produisant des composés puissants pour dissuader les herbivores (agents de dissuasion de l'alimentation). Les principales classes de substances phytochimiques comprennent les phénols, les polyphénols, les tanins, les terpènes et les alcaloïdes. Bien que le nombre de plantes ayant fait l'objet d'études approfondies soit relativement faible, de nombreux produits naturels pharmacologiquement actifs ont déjà été identifiés. Parmi les exemples cliniquement utiles, citons les agents anticancéreux paclitaxel et omacetaxine mepesuccinate (en) (respectivement de l'If de l'Ouest et de Cephalotaxus harringtonii (en)), l'agent antipaludique artémisinine (de l'armoise annuelle) et d'un Anticholinestérase , la galantamine (de Galanthus spp.), utilisée pour traiter la maladie d'Alzheimer. La morphine, la cocaïne, la quinine, la tubocurarine, la muscarine et la nicotine sont d'autres drogues d'origine végétale, utilisées à des fins médicinales ou récréatives.
Animaux

Les animaux représentent également une source de produits naturels bioactifs. En particulier, les animaux venimeux comme les serpents, les araignées, les scorpions, les chenilles, les abeilles, les guêpes, les mille-pattes, les fourmis, les crapauds et les grenouilles ont beaucoup attiré l'attention. En effet, les constituants du venin (peptides, enzymes, nucléotides, lipides, ou encore amines biogènes) ont souvent des interactions très spécifiques avec une cible macromoléculaire de l'organisme (par ex. l'α-bungarotoxine de cobra). Comme dans le cas des produits des plantes devant dissuader de se faire manger, cette activité biologique est attribuée à la sélection naturelle, les organismes capables de tuer ou de paralyser leurs proies et/ou de se défendre contre les prédateurs étant plus susceptibles de survivre et de se reproduire.
En raison de ces interactions chimiques spécifiques, les constituants du venin se sont révélés des outils importants pour l'étude des récepteurs, des canaux ioniques et des enzymes. Dans certains cas, ils ont également servi de chefs de file dans la mise au point de nouveaux médicaments. Par exemple, le téprotide, un peptide isolé à partir du venin du crotale brésilien Bothrops jararaca, a joué un rôle de premier plan dans le développement d'agents antihypertenseurs, le cilazapril (en) et le captopril. De plus, l'échistatine, une désintégrine (en) provenant du venin de la vipère Echis carinatus, a joué un rôle de premier plan dans le développement du tirofiban, un médicament antiplaquettaire.
En plus des animaux terrestres (en) et des amphibiens décrits ci-dessus, de nombreux animaux marins ont été examinés à la recherche de produits naturels pharmacologiquement actifs, avec des coraux, des éponges, des tuniciers, des bigorneaux et des bryozoaires produisant des produits chimiques aux activités analgésiques, antivirales et anticancéreuses intéressantes. Deux exemples d'utilisation clinique ont été développés : l'ω-conotoxine (de l'escargot marin Conus magus) et l'ecteinascidin 743 (du tunicier Ecteinascidia turbinata (en)). La première, la ω-conotoxine, est utilisée pour soulager les douleurs sévères et chroniques, tandis que la seconde, l'ecteinascidine 743 est utilisée pour traiter le sarcome métastatique des tissus mous. Parmi d'autres produits naturels dérivés d'animaux marins et faisant l'objet d'études comme thérapies possibles, on trouve des agents antitumoraux tels que le discodermolide (de l'éponge Discodermia dissoluta), l'éluthérobine (en) (du corail Erythropodium caribaeorum (en)) et les bryostatines (en) (du bryozoaire Bugula neritina (en)).
Utilisations médicale
Les produits naturels ont parfois une activité pharmacologique qui peut être bénéfique sur le plan thérapeutique dans le traitement des maladies. En tant que tels, les produits naturels sont les composants actifs de nombreuses médecines traditionnelles. De plus, il est possible de préparer des analogues synthétiques de produits naturels ayant une puissance et une sécurité améliorées et, par conséquent, les produits naturels sont souvent utilisés comme points de départ pour la découverte de médicaments (en). Les constituants des produits naturels ont inspiré de nombreux efforts de découverte de médicaments qui ont finalement été approuvés en tant que nouveaux médicaments par l'Agence américaine des produits alimentaires et médicamenteux.
Médecine traditionnelle
Les peuples autochtones et les civilisations anciennes ont fait des expériences avec diverses parties de plantes et d'animaux pour déterminer les effets qu'elles pouvaient avoir. Par tâtonnements et dans des cas très isolés, les guérisseurs ou chamans ont trouvé des sources d'effet thérapeutique, représentant la connaissance d'un médicament brut (en) qui se transmet de génération en génération dans des pratiques comme la médecine traditionnelle chinoise et l'Ayurveda. Des extraits de certains produits naturels ont conduit à la découverte moderne de leurs principes actifs et, en bout de route, à la mise au point de nouveaux médicaments.
Médicaments modernes dérivés de produits naturels
Un grand nombre de médicaments actuellement prescrits sont soit directement dérivés de produits naturels, soit inspirés de produits naturels. En voici quelques exemples représentatifs.
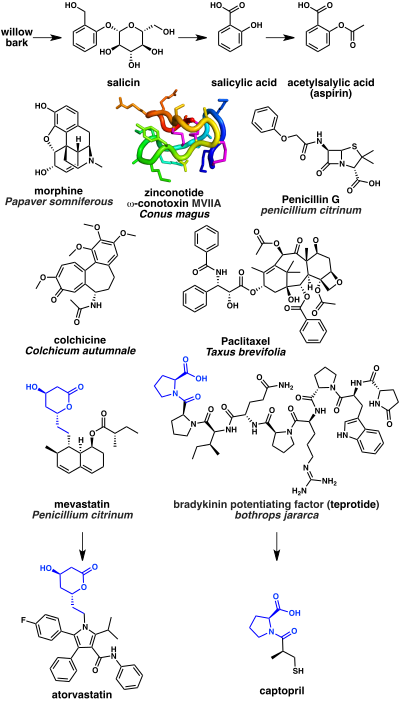
Certains des médicaments à base de produits naturels les plus anciens sont des analgésiques. L'écorce du saule est connue depuis l'Antiquité pour ses propriétés analgésiques. Cela s'explique par la présence de la salicine, un produit naturel qui peut à son tour être hydrolysé en acide salicylique. Un dérivé synthétique de l'acide acétylsalicylique, mieux connu sous le nom d'aspirine, est un analgésique largement utilisé. Son mécanisme d'action est l'inhibition de l'enzyme cyclo-oxygénase (COX). Un autre exemple notable est l'opium extrait du latex du Pavot somnifère. Le composant narcotique le plus puissant de l'opium est la morphine, un alcaloïde qui agit comme un agoniste des récepteurs opiacés. Un exemple plus récent est le ziconotide, un analgésique bloqueur des canaux calciques de type N à base d'une toxine peptidique cyclique d'escargot cone (ω-conotoxine MVIIA) de l'espèce Conus magus.
Un nombre important d'anti-infectieux sont à base de produits naturels. Le premier antibiotique découvert, la pénicilline, a été isolé de la moisissure Penicillium. La pénicilline et les bêta-lactames apparentés agissent en inhibant l'enzyme DD-transpeptidase dont les bactéries ont besoin pour faire la liaison transversale du peptidoglycane afin de former la paroi cellulaire.
Plusieurs médicaments naturels ciblent la tubuline, qui est un composant du cytosquelette. Il s'agit notamment de l'inhibiteur de polymérisation de la tubuline, la colchicine, isolé à partir de la Colchique d'automne, qui est utilisé pour traiter la goutte. La colchicine est biosynthétisée à partir d'acides aminés, la phénylalanine et le tryptophane. Le paclitaxel, en revanche, est un stabilisateur de polymérisation de la tubuline et est utilisé comme médicament chimiothérapeutique. Le paclitaxel est basé sur un produit naturel terpénoïde, le taxol, qui est isolé de l'If de l'Ouest.
Les inhibiteurs de l'HMG-CoA réductase comme l'atorvastatine, sont une classe de médicaments largement utilisée pour abaisser le cholestérol. Ceux-ci ont été développés à partir de la mévastatine (en), un polycétide produit par le champignon Penicillium citrinum. Enfin, un certain nombre de médicaments naturels sont utilisés pour traiter l'hypertension et l'insuffisance cardiaque congestive. Il s'agit notamment du captopril, inhibiteur de l'enzyme de conversion de l'angiotensine. Le captopril est basé sur le facteur peptidique de potentialisation de la bradykinine isolé du venin de la vipère à tête fléchée du Brésil (Bothrops jararaca).
Facteurs limitants et favorables
De nombreux défis limitent l'utilisation des produits naturels pour la découverte de médicaments, ce qui a amené les sociétés pharmaceutiques du XXIe siècle à préférer consacrer leurs efforts de découverte au criblage à haut débit de composés synthétiques purs avec des délais plus courts pour le perfectionnement. Les sources de produits naturels sont souvent peu fiables pour ce qui est de l'accès et de l'approvisionnement, ont une forte probabilité de dédoublement, suscitent des préoccupations en matière de propriété intellectuelle au sujet de la protection des brevets, leur composition varie en raison de la saison d'approvisionnement ou de l'environnement, et sont susceptibles de s'éteindre à un rythme croissant.
La ressource biologique pour la découverte de médicaments à partir de produits naturels demeure abondante, avec de faibles pourcentages de micro-organismes, d'espèces végétales et d'insectes évalués pour leur bioactivité. En très grand nombre, les bactéries et les micro-organismes marins ne sont toujours pas examinés. En 2008, le domaine de la métagénomique a été proposé pour examiner les gènes et leur fonction dans les microbes du sol, mais la plupart des entreprises pharmaceutiques n'ont pas exploité pleinement cette ressource, choisissant plutôt de développer une « synthèse axée sur la diversité » à partir de banques de médicaments connus ou de sources naturelles pour des composés à fort potentiel bioactivité.
Isolement et purification

Tous les produits naturels sont à la base mélangés avec d'autres composés d'origine naturelle, souvent très complexes, à partir desquels le produit d'intérêt doit être isolé et purifié. Selon le contexte, l'isolement d'un produit naturel fait référence soit à l'isolement de quantités suffisantes de matière chimique pure pour l'élucidation de la structure chimique, la dérivation/chimie de dégradation, les essais biologiques et autres besoins de recherche (généralement des milligrammes aux grammes, mais historiquement, souvent plus)[réf. nécessaire], soit à l'isolement des « quantités analytiques » de la substance en question, lorsque l'accent est mis sur son identification et son dosage (par exemple, dans le tissu biologique ou un fluide) et que la quantité isolée est fonction de la méthode analytique appliquée (mais généralement toujours sous forme d'une quantité en microgramme).
La facilité avec laquelle l'agent actif peut être isolé et purifié dépend de la structure, de la stabilité et de la quantité du produit naturel. Les méthodes d'isolement appliquées pour obtenir ces deux échelles distinctes de produit sont également distinctes, mais impliquent généralement l'extraction, la précipitation, l'adsorption, la chromatographie et parfois la cristallisation. Dans les deux cas, la substance isolée est purifiée jusqu'à homogénéité chimique, c'est-à-dire que des méthodes de séparation et d'analyse combinées spécifiques telles que les méthodes LC-MS sont choisies pour être « orthogonales », c'est à-dire atteignant leurs séparations basées sur des modes d'interaction distincts entre la substance et la matrice isolante, dans le but de détecter à nouveau une seule espèce présente dans un échantillon pur hypothétique. L'isolement précoce est presque inévitablement suivi de la détermination de la structure, surtout si une activité pharmacologique importante est associée au produit naturel purifié[réf. souhaitée].
La détermination de la structure fait référence aux méthodes appliquées pour connaître la structure chimique d'un produit naturel pur et isolé, un processus qui implique un ensemble de méthodes chimiques et physiques qui ont changé de façon marquée au cours de l'histoire de la recherche sur les produits naturels ; au début, elles étaient axées sur la transformation chimique de substances inconnues en substances connues et la mesure des propriétés physiques, comme le point de fusion et d'ébullition, et des méthodes connexes pour déterminer le poids moléculaire[réf. nécessaire]. Dans l'ère moderne, les méthodes se concentrent sur la spectrométrie de masse et les méthodes de résonance magnétique nucléaire, souvent multidimensionnelles et, dans la mesure du possible, sur la cristallographie des petites molécules[réf. nécessaire]. Par exemple, la structure chimique de la pénicilline a été déterminée par Dorothy Crowfoot Hodgkin en 1945, travaux pour lesquels elle reçut le prix Nobel de chimie en 1964.
Synthèse
De nombreux produits naturels ont des structures très complexes. La complexité perçue d'un produit naturel est une question qualitative, qui consiste à examiner sa masse moléculaire, la disposition particulière des sous-structures (tels que les groupes fonctionnels ou les anneaux) les unes par rapport aux autres, le nombre et la densité de ces groupes fonctionnels, la stabilité de ces groupes et de la molécule dans son ensemble, le nombre et le type des éléments stéréochimiques, les propriétés physiques des molécules et de leurs intermédiaires (qui influencent la facilité avec laquelle elles sont traitées et traitées), le tout dans le contexte du caractère nouveau de la structure et du succès des efforts synthétiques précédents (cf. infra).
Certains produits naturels, en particulier ceux qui sont moins complexes, sont faciles et rentables à préparer par synthèse chimique complète à partir d'ingrédients chimiques plus simples et facilement disponibles, un procédé appelé synthèse totale (surtout lorsque le procédé ne comporte aucune étape à laquelle interviennent des agents biologiques). Tous les produits naturels ne se prêtent pas à la synthèse totale, rentable ou non. En particulier, les plus complexes ne le sont souvent pas. Beaucoup sont accessibles, mais les voies nécessaires sont tout simplement trop coûteuses pour permettre une synthèse à toute échelle pratique ou industrielle. Toutefois, pour pouvoir être étudiés plus en profondeur, tous les produits naturels doivent être isolés et purifiés. Cela peut suffire si l'isolement permet d'obtenir des quantités appropriées du produit naturel pour l'usage auquel il est destiné (par ex. en tant que médicament pour soulager une maladie). Des médicaments comme la pénicilline, la morphine et le paclitaxel se sont révélés abordables à l'échelle commerciale nécessaire uniquement par des procédures d'isolement (sans qu'aucune chimie de synthèse importante n'y contribue)[réf. nécessaire]. Cependant, dans d'autres cas, les agents nécessaires ne sont pas disponibles sans manipulations chimiques synthétiques.
Hémisynthèse
Le processus d'isolement d'un produit naturel de sa source peut être coûteux en termes de temps et de dépenses matérielles, et il peut remettre en question la disponibilité de la ressource naturelle dont on se sert, ou encore avoir des conséquences écologiques pour cette ressource. Par exemple, on a estimé que l'écorce d'un If de l'Ouest entier (Taxus brevifolia) devrait être récoltée pour extraire suffisamment de paclitaxel pour une seule dose de traitement. De plus, le nombre d'analogues structuraux pouvant être obtenus pour l'analyse structure-activité (en) par prélèvement simple (si plus d'un seul analogue structural est présent) est limité par la biologie à l'œuvre dans l'organisme, et donc hors du contrôle de l'expérimentateur.
Dans les cas où la cible ultime est plus difficile à atteindre ou limite l'analyse structure-activité, il est parfois possible de se procurer un précurseur ou un analogue biosynthétique, de stade intermédiaire à avancé, à partir duquel la cible ultime peut être préparée. C'est ce qu'on appelle l'hémisynthèse ou la synthèse partielle. Avec cette approche, l'intermédiaire biosynthétique correspondant est récolté et ensuite converti en produit final par des procédés conventionnels de synthèse chimique.
Cette stratégie peut avoir deux avantages. Premièrement, l'intermédiaire peut être extrait plus facilement, et avec un rendement plus élevé, que le produit final souhaité. , Par exemple, le paclitaxel peut être fabriqué en extrayant la 10-désacétylbaccatine III (en) des aiguilles de l'If de l'Ouest, puis en effectuant une synthèse en quatre étapes[réf. nécessaire]. Deuxièmement, la voie conçue entre la matière première semi-synthétique et le produit final peut permettre la synthèse d'analogues du produit final. Les pénicillines semi-synthétiques de nouvelle génération illustrent les avantages de cette approche[réf. nécessaire].
Synthèse totale
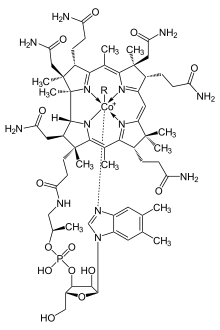
En général, la synthèse totale de produits naturels est une activité de recherche non commerciale qui a pour objectif d'approfondir la compréhension de la synthèse de cadres particuliers de produits naturels et à développer de nouvelles méthodes synthétiques fondamentales. Malgré cela, elle revêt une importance commerciale et sociétale considérable. En fournissant des cibles synthétiques exigeantes, par exemple, il a joué un rôle central dans le développement du domaine de la chimie organique. Avant le développement des méthodes de chimie analytique au XXe siècle, les structures des produits naturels étaient affirmées par synthèse totale (ce que l'on appelle la « preuve de structure par synthèse »). Les premiers efforts de synthèse de produits naturels ont ciblé des substances complexes telles que la cobalamine (vitamine B12), un cofacteur essentiel du métabolisme cellulaire.
Symétrie
L'examen des produits naturels dimérisés et trimérisés a montré qu'un élément de symétrie bilatérale est souvent présent. La symétrie bilatérale fait référence à une molécule ou à un système qui contient une identité de groupe de points C2, Cs ou C2v. La symétrie C2 tend à être beaucoup plus abondante que les autres types de symétrie bilatérale. Cette découverte nous éclaire sur la façon dont ces composés pourraient être créés mécaniquement, tout en nous donnant un aperçu des propriétés thermodynamiques qui les rendent plus favorables. La théorie fonctionnelle de la densité (DFT), la Hartree-Fock et les calculs semi-empiriques montrent également une certaine favorabilité pour la dimérisation dans les produits naturels en raison de l'évolution de plus d'énergie par liaison que le trimère ou le tétramère équivalent. Il est proposé que cela soit dû à un obstacle stérique au cœur de la molécule, car la plupart des produits naturels dimérisent et trimérisent de façon tête-à-tête plutôt que tête-bêche.
Recherche et enseignement
Les activités de recherche et d'enseignement liées aux produits naturels relèvent d'un certain nombre de domaines universitaires différents, notamment la chimie organique, la chimie pharmaceutique, la pharmacognosie, l'ethnobotanique, la médecine traditionnelle et l'ethnomédecine. Parmi les autres domaines biologiques se trouvent la biologie chimique, l'écologie chimique, la chimiogénomique et la biologie des systèmes.
Chimie
La chimie des produits naturels est un domaine distinct de la recherche chimique qui a joué un rôle important dans l'histoire de la chimie, l'approvisionnement en substances dans les premières recherches précliniques sur la découverte de médicaments, la compréhension de la médecine traditionnelle et de l'ethnopharmacologie, l'évolution de la technologie associée aux séparations chimiques, le développement de méthodes modernes pour déterminer la structure chimique par résonance magnétique nucléaire et autres techniques, ainsi que pour identifier des zones pharmacologiquement utiles dans l'espace de diversité chimique[réf. nécessaire].
De plus, les produits naturels sont préparés par synthèse organique et ont joué un rôle central dans le développement du domaine de la chimie organique en fournissant des cibles et des problèmes extrêmement stimulants pour la stratégie et les techniques de synthèse. À cet égard, les produits naturels jouent un rôle central dans la formation de nouveaux chimistes en synthèse organique et sont une motivation principale dans le développement de nouvelles variantes d'anciennes réactions chimiques telle que la réaction d'aldolisation, ainsi que dans la découverte de réactions chimiques complètement nouvelles comme la cis-hydroxylation de Woodward (en), l'époxydation de Sharpless, et les réactions croisées Suzuki-Miyaura)[réf. nécessaire].
Biochimie
Des recherches sont en cours pour comprendre et manipuler les voies biochimiques impliquées dans la synthèse de produits naturels dans les plantes. On espère que ces connaissances permettront de produire de façon plus efficace et plus économique des phytochimiques utiles sur le plan médical, comme les alcaloïdes.
Histoire
Fondements de la chimie des produits organiques et naturels
Le concept de produit naturel remonte au début du XIXe siècle, lorsque les bases de la chimie organique ont été posées. Elle était considérée à l'époque comme la chimie des substances qui composent les plantes et les animaux. Il s 'agissait d'une forme relativement complexe de la chimie qui se dressait en contraste frappant avec la chimie inorganique, dont les principes avaient été établis en 1789 par le Français Antoine Lavoisier dans son livre Traité Élémentaire de Chimie.
Isolement
Lavoisier a montré à la fin du XVIIIe siècle que les substances organiques comprenaient un nombre limité d'éléments : principalement du carbone et de l'hydrogène, complétés par l'oxygène et l'azote. Il s'est rapidement concentré sur l'isolement de ces substances, souvent parce qu'elles avaient une activité pharmacologique intéressante. Les plantes étaient la principale source de ces composés, en particulier les alcaloïdes et les glycosides. On savait depuis longtemps que l'opium, un mélange collant d'alcaloïdes (codéine, morphine, noscapine, thébaïne et papavérine) provenant du Pavot somnifère, possédait des propriétés narcotiques tout en modifiant l'humeur. En 1805, la morphine avait déjà été isolée par le chimiste allemand Friedrich Sertürner, puis on a découvert dans les années 1870 que l'ébullition del morphine avec de l'anhydride acétique produisait une substance ayant un fort effet antidouleur : l'héroïne. En 1815, Eugène Chevreul a isolé le cholestérol, une substance cristalline, à partir de tissus animaux appartenant à la classe des stéroïdes, tandis que la strychnine, un alcaloïde, a été isolée en 1820[réf. souhaitée].
Synthèse
Une deuxième étape importante a été la synthèse des composés organiques. Alors que la synthèse de substances inorganiques était connue depuis longtemps, la synthèse de substances organiques était un obstacle difficile. En 1827, le chimiste suédois Jöns Jacob Berzelius soutenait qu'une force indispensable de la nature pour la synthèse des composés organiques, appelée « force vitale » était nécessaire. Cette idée philosophique, le vitalisme, avait jusqu'au XIXe siècle de nombreux partisans, même après l'introduction de la théorie atomique. L'idée du vitalisme s'accordait particulièrement bien avec les croyances de la médecine ; les pratiques de guérison les plus traditionnelles croyaient que la maladie était le résultat d'un certain déséquilibre dans les énergies vitales qui distingue la vie de la non-vie. En 1828, le chimiste allemand Friedrich Wöhler réussit à synthétiser l'urée, un produit naturel présent dans l'urine, en chauffant du cyanate d'ammonium, une substance inorganique, pour tenter de briser l'idée du vitalisme en science :
Cette réaction a prouvé qu'il n'y avait pas besoin d'une force vitale pour préparer des substances organiques. Mais cette idée a d'abord été accueillie avec beaucoup de scepticisme et ce n'est que 20 ans plus tard, avec la synthèse de l'acide acétique à partir du carbone par Hermann Kolbe, que l'idée fut acceptée. Depuis, la chimie organique est devenue un domaine de recherche indépendant consacré à l'étude des composés contenant du carbone, puisque cet élément commun a été détecté dans diverses substances d'origine naturelle. Un facteur important dans la caractérisation des matières organiques était basé sur leurs propriétés physiques (telles que le point de fusion, le point d'ébullition, la solubilité, la cristallinité ou la couleur)[réf. souhaitée].
Théories structurelles
Une troisième étape a été l'élucidation de la structure des substances organiques : bien que la composition élémentaire des substances organiques pures (qu'elles soient d'origine naturelle ou synthétique) puisse être déterminée assez précisément, la structure moléculaire reste un problème. L'envie de l’élucider vient d'une controverse entre les chimistes Friedrich Wöhler et Justus von Liebig, qui ont tous les deux étudié un sel d'argent de la même composition, mais avec des propriétés différentes. Wöhler a étudié le cyanate d'argent, une substance inoffensive, tandis que von Liebig a étudié le fulminate d'argent, un sel aux propriétés explosives. L'analyse élémentaire montre que les deux sels contiennent des quantités égales d'argent, de carbone, d'oxygène et d'azote. Selon les idées qui prévalaient à l'époque, les deux substances devaient posséder les mêmes propriétés, mais ce n'était pas le cas.
Cette contradiction apparente a été résolue plus tard par la théorie des isomères de Berzélius qui affirme que non seulement le nombre et le type d'éléments sont importants pour les propriétés et la réactivité chimique, mais aussi la position des atomes dans un composé. C'est une cause directe du développement des théories structurelles, comme la théorie radicale de Jean-Baptiste Dumas et la théorie de la substitution d'Auguste Laurent. Toutefois, il a fallu attendre jusqu'en 1858 avant qu'August Kekulé ne formule une théorie de structure définitive. Il postule que le carbone est tétravalent et qu'il peut se lier à lui-même pour former des chaînes de carbone lorsqu'il est présent dans les produits naturels.
Élargissement du concept
Le concept de produit naturel, initialement basé sur des composés organiques pouvant être isolés des plantes, a été étendu à la matière animale au milieu du XIXe siècle par l'Allemand Justus von Liebig. En 1884, Hermann Emil Fischer a porté son attention sur l'étude des glucides et des purines, travaux pour lesquels il a reçu le prix Nobel en 1902. Il a également réussi à fabriquer synthétiquement en laboratoire une variété d'hydrates de carbone, dont le glucose et le mannose. Après la découverte de la pénicilline par Alexander Fleming en 1928, les champignons et autres micro-organismes ont été ajoutés à l'arsenal des sources de produits naturels.
Étapes clés
Dans les années 1930, plusieurs grandes catégories de produits naturels étaient connues. Parmi les découvertes importantes se trouvent notamment[réf. souhaitée]:
- les terpènes, d'abord systématiquement étudié par Otto Wallach (Prix Nobel 1910) et plus tard par Leopold Ružička (Prix Nobel 1939) ;
- les colorants à base de porphines (dont la chlorophylle et l'hème), étudiés par Richard Willstätter (Prix Nobel 1915) et Hans Fischer (Prix Nobel 1930) ;
- les stéroïdes, étudiés par Heinrich Otto Wieland (Prix Nobel 1927) et Adolf Windaus (Prix Nobel 1928) ;
- les caroténoïdes, étudiés par Paul Karrer (Prix Nobel 1937) ;
- les vitamines, étudiés notamment par Paul Karrer, Adolf Windaus, Robert R. Williams, Walter Norman Haworth (Prix Nobel 1937), Richard Kuhn (Prix Nobel 1938) et Albert Szent-Györgyi ;
- les hormones, étudiées par Adolf Butenandt (Prix Nobel 1939) et Edward Calvin Kendall (Prix Nobel 1950) ;
- les alcaloïdes et les anthocyanes, étudiés nottamament pas Robert Robinson (Prix Nobel 1947).
Voir aussi
Journaux scientifiques
- Chemistry of Natural Compounds (en)
- Journal of Natural Products
- Natural Product Reports
- Natural Product Research (en)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Natural product » (voir la liste des auteurs).
Bibliographie
- (en) Bhat SV, Nagasampagi BA, Sivakumar M, Chemistry of Natural Products, Berlin, Springer, , 2e éd., 840 p. (ISBN 3-540-40669-7)
- Hanson JR, Natural Products : The Secondary Metabolites, Royal Society of Chemistry, (ISBN 0-85404-490-6)
- Kaufman PB, Natural Products from Plants, CRC Press, (ISBN 0-8493-3134-X)
- Medicinal Chemistry of Bioactive Natural Products, Wiley-Interscience, , 336 p. (ISBN 0-471-73933-2, lire en ligne)
- Adriano Rutz, Maria Sorokina, Jakub Galgonek, Daniel Mietchen, Egon Willighagen, Arnaud Gaudry, James G Graham, Ralf Stephan, Roderic Page, Jiří Vondrášek, Christoph Steinbeck, Guido F Pauli, Jean-Luc Wolfender, Jonathan Bisson et Pierre-Marie Allard, « The LOTUS initiative for open knowledge management in natural products research », eLife, vol. 11, , e70780 (PMID 35616633, DOI 10.7554/eLife.70780, S2CID 249064853)
Liens externes
- William Reusch, « Natural Products page » [archive du ], Virtual Textbook of Organic Chemistry, Ann Arbor, Mich., Michigan State University, Department of Chemistry,
- « NAPROC-13 Base de datos de Carbono 13 de Productos Naturales y Relacionados (Carbon-13 Database of Natural Products and Related Substances) », Spanish language tools to facilitate structural identification of natural products
- Modèle:WD1913
- https://www.wikidata.org/wiki/Wikidata:WikiProject_Chemistry/Natural_products