
Oxyde de vanadium(V)
| Pentoxyde de vanadium | |||

| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Oxyde de Vanadium (V) | ||
| Synonymes |
Pentoxyde de vanadium |
||
| No CAS | 1314-62-1 | ||
| NoECHA | 100.013.855 | ||
| No CE | 215-239-8 | ||
| SMILES | |||
| InChI |
|
||
| Apparence | poudre cristalline jaune à rouge ou solide de formes variables. | ||
| Propriétés chimiques | |||
| Formule | O5V2V2O5 | ||
| Masse molaire | 181,88 ± 0,001 7 g/mol O 43,98 %, V 56,02 %, |
||
| Propriétés physiques | |||
| T° fusion | 690 °C | ||
| T° ébullition | (décomposition) : 1 750 °C | ||
| Solubilité | dans l'eau : 8 g·l-1 | ||
| Masse volumique | 3,4 g·cm-3 | ||
| Thermochimie | |||
| S0solide | 130,4 J K−1 mol−1 | ||
| ΔfH0liquide | −1 491,2 kJ mol−1 | ||
| ΔfH0solide | −1 550,6 kJ mol−1 | ||
| Cp | 130,5 J K−1 mol−1 à 25°C | ||
| Cristallographie | |||
| Système cristallin | orthorhombique | ||
| Classe cristalline ou groupe d’espace | Pmmn N°59 | ||
| Paramètres de maille | a = 11,552 Å, b = 3,619 Å, c = 4,797 Å | ||
| Précautions | |||
| SGH | |||
|
H302, H332, H335, H341, H361d, H372 et H411
H302 : Nocif en cas d'ingestion H332 : Nocif par inhalation H335 : Peut irriter les voies respiratoires H341 : Susceptible d'induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H361d : Susceptible de nuire au fœtus. H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H411 : Toxique pour les organismes aquatiques, entraîne des effets à long terme |
|||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
|
modifier |
|||
L'oxyde de vanadium(V) ou pentoxyde de vanadium (V2O5) est la forme la plus oxydée du vanadium.
On s'en sert comme catalyseur souvent sur un support d'alumine. Il est utilisé dans la synthèse de l'acide sulfurique où il catalyse l'oxydation du dioxyde de soufre en trioxyde.
C'est aussi un précurseur pour la production d'alliage de vanadium.
Propriétés
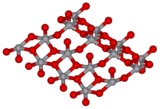
V2O5 est un solide brun-jaune. Il cristallise dans le système orthorhombique, c'est une structure lamellaire formée par des pyramides à base tétragonale VO5 reliées entre elles par une arête. La cohésion entre les différents plans est due à des interactions de Van der Waals.
Production
Il existe de nombreuses méthodes de synthèse en fonction de la pureté, de la structure et de la morphologie que l'on veut obtenir: méthode sol-gel, hydrothermale/solvothermale, dépôt chimique en phase vapeur, electrospinning.
Un minerai de vanadium ou un sous-produit riche en vanadium est traité par du carbonate de sodium et un sel d'ammonium pour obtenir du métavanadate d'ammonium NH4VO3. En acidifiant le milieu par de l'acide sulfurique, on observe la précipitation de V2O5 hydraté de couleur rouge-orangé. Une calcination à 690°C permet ensuite d'obtenir de l'oxyde de vanadium liquide qui forme en refroidissant un solide de couleur brun-jaune.
De l'oxyde de vanadium(V) de grande pureté peut être obtenu en calcinant directement du métavanadate de d'ammonium à 550°C. Si on calcine directement du vanadium en présence d'air, on obtient en général du V2O5 moins pur car contenant des oxydes de vanadium de type VnO2n+1.
En utilisant le dépôt chimique en phase vapeur ou le dépôt physique en phase vapeur (pulvérisation cathodique), on peut obtenir de l'oxyde de vanadium(V) en couche mince sur un support.
Utilisations
Synthèse de l'acide sulfurique
La synthèse de H2SO4 nécessite de produire du trioxyde de soufre par oxydation de dioxyde de soufre, ce qui doit se faire à une température modérée.
SO2 + 0.5 O2 → SO3
Cette réaction se fait par le procédé contact dans lequel on utilise un catalyseur à base de V2O5 pour faire cette réaction. Si on excepte les combustibles, l'acide sulfurique est la molécule la plus synthétisée dans le monde avec une production annuelle de l'ordre de 165 millions de tonnes.
Synthèses en chimie organique
V2O5 est aussi un catalyseur d'oxydation utilisé dans plusieurs synthèses de produits chimiques. Par exemple les anhydrides maléique et phtalique sont produits en utilisant ce catalyseur, ce qui permet de faire l'oxydation des précurseurs (le butane pour l'anhydride maléique et l'ortho-xylène pour l'anhydride phtalique) à température modérée (350 à 400°C) :
C4H10 + 4 O2 → C2H2(CO)2O + 8 H2O
C6H4(CH3)2 + 3 O2 → C6H4(CO)2O + 3 H2O
Des acides organiques sont aussi produits par cette méthode: acide adipique, acide oxalique, etc.
Réduction des oxydes d'azote
L'oxyde de vanadium(V) est aussi l'un des catalyseurs couramment utilisés dans les procédés de réduction catalytique sélective des oxydes d'azote.
Fabrication d'alliages avec le fer
Ces alliages contenant entre 35 et 85% de vanadium sont des additifs permettant d'améliorer la dureté des aciers, il améliore aussi la résistance à la corrosion. On les utilise par exemple dans les aciers HSLA pour les outils.
Pour obtenir ces alliages, on réduit de l'oxyde de vanadium en vanadium métal par du silicium ou de l'aluminium en présence de fer à haute température, le vanadium se dissout alors dans le fer pour créer un alliage.
C'est l'utilisation la plus importante en termes de quantité puisqu'elle consomme plus de 80% de la production mondiale de vanadium.


