
Méthacrylate de méthyle
| Méthacrylate de méthyle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
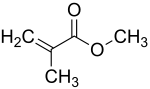
| Structure du méthacrylate de méthyle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | 2-méthylprop-2-énoate de méthyle | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 80-62-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA | 100.001.180 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 201-297-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No RTECS | OZ5075000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6658 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 34840 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
Std. InChI : vue 3D InChI=1S/C5H8O2/c1-4(2)5(6)7-3/h1H2,2-3H3 Std. InChIKey : VVQNEPGJFQJSBK-UHFFFAOYSA-N |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | liquide inflammable incolore et très volatil à l'odeur caractéristique dont les vapeurs forment des mélanges explosifs avec l'air | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C5H8O2 [Isomères]CH2=C(CH3)COOCH3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire | 100,115 8 ± 0,005 2 g/mol C 59,98 %, H 8,05 %, O 31,96 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −48 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 101 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | 15 g/L à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 0,94 g/cm3 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 430 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair |
10 °C (coupelle ouverte), 2 °C (coupelle fermée) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | entre 1,7 % (70 g/m3) et 12,5 % (520 g/m3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | 39,6 hPa à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosité dynamique | 0,6 mPa s à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp |
équation :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H225, H315, H317, H335, P210, P233, P280, P302+P352, P304+P340 et P403+P235
H225 : Liquide et vapeurs très inflammables H315 : Provoque une irritation cutanée H317 : Peut provoquer une allergie cutanée H335 : Peut irriter les voies respiratoires P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P233 : Maintenir le récipient fermé de manière étanche. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P302+P352 : En cas de contact avec la peau : laver abondamment à l’eau et au savon. P304+P340 : En cas d'inhalation : transporter la victime à l’extérieur et la maintenir au repos dans une position où elle peut confortablement respirer. P403+P235 : Stocker dans un endroit bien ventilé. Tenir au frais. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2B,
B2 : Liquide inflammable point d'éclair = 2 °C coupelle fermée (méthode non rapportée) D2B : Matière toxique ayant d'autres effets toxiques sensibilisation de la peau chez l'humain ; irritation des yeux chez l'animal Divulgation à 1,0% selon la liste de divulgation des ingrédients |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 339 : matière liquide très inflammable, pouvant produire spontanément une réaction violente Numéro ONU : 1247 : MÉTHACRYLATE DE MÉTHYLE MONOMÈRE STABILISÉ Classe : 3 Étiquette :  3 : Liquides inflammables Emballage : Groupe d'emballage II : matières moyennement dangereuses ; |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL50 | 7 870 mg/kg (souris, oral) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,38 (octanol/eau) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DJA | 0,05 mg/kg p.c./jour | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,46 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le méthacrylate de méthyle (MMA) est un composé chimique de formule CH2=C(CH3)COOCH3. C'est l'ester d'acide méthacrylique CH2=C(CH3)COOH et de méthanol CH3OH. Il se présente sous la forme d'un liquide inflammable incolore et très volatil à l'odeur caractéristique peu soluble dans l'eau dont les vapeurs forment des mélanges explosifs avec l'air. Il tend à polymériser, surtout s'il contient des impuretés. Cette polymérisation peut être amorcée de manière ciblée, par exemple en ajoutant des peroxydes. La température croît brutalement par effet Trommsdorff et la pression doit être maîtrisée. L'enthalpie de polymérisation est de −59 kJ/mol ou −590 kJ/kg.
Le méthacrylate de méthyle est le monomère du polyméthacrylate de méthyle (PMMA), homopolymère dont la production constitue l'essentiel de son utilisation ; il intervient également dans la production de copolymères tels que le méthacrylate de méthyle-butadiène-styrène (MBS), utilisé pour modifier les propriétés du PVC.
Production
Compte tenu des volumes de méthacrylate de méthyle produits dans le monde, de nombreuses méthodes ont été développées pour sa production à partir de précurseurs à deux ou quatre atomes de carbone. Deux voies de synthèse sont principalement utilisées.
Par la cyanhydrine d'acétone
La cyanhydrine d'acétone (CH3)2C(OH)C≡N, souvent notée ACH, est obtenue par condensation d'acétone (CH3)2C=O et de cyanure d'hydrogène HCN. Elle est hydrolysée en présence d'acide sulfurique H2SO4 pour former un organosulfate de méthacrylamide CH2=C(CH3)CONH2. La méthanolyse de cet ester donne du bisulfate d'ammonium NH4HSO4 et du méthacrylate de méthyle. Cette voie de synthèse produit finalement des quantités importantes de sulfate d'ammonium (NH4)2SO4 comme sous-produit.
- (CH3)C=O + HCN ⟶ (CH3)C(OH)C≡N ;
- (CH3)C(OH)C≡N + H2SO4 ⟶ (CH3)2C(OSO2OH)CONH2.
L'ester est en fait produit initialement sous forme d'adduit (CH3)2C(OSO2OH)CONH2·H2SO4 avec l'acide sulfurique, qui est ensuite clivé par craquage, puis méthanolysée :
Ce mode de synthèse a fait l'objet de nombreuses optimisations.
Par le propanoate de méthyle
Le propanoate de méthyle CH3CH2COOCH3 est obtenu par carboalcoxylation d'éthylène CH2=CH2 :
- C2H4 + CO + CH3OH ⟶ CH3CH2COOCH3.
La synthèse du propanoate de méthyle est réalisée dans un réacteur à réservoir agité en continu à une température et une pression modérées en utilisant un agencement d'agitation et de mélange gaz-liquide spécifiques. Dans un deuxième groupe de réactions, le propanoate de méthyle est condensé avec le formaldéhyde HCHO en une seule étape de réaction hétérogène pour former le méthacrylate de méthyle :
- CH3CH2COOCH3 + HCHO ⟶ CH2=C(CH3)COOCH3 + H2O.
La réaction du propanoate de méthyle avec le formaldéhyde est réalisée sur un lit fixe de catalyseur en oxyde de césium CsO2 sur silice SiO2, qui permet d'obtenir une bonne sélectivité du méthacrylate de méthyle à partir du propanoate de méthyle. Il se forme des résidus de composés plus lourds et peu volatils qui empoisonnent le catalyseur, résidus qui sont facilement nettoyés afin de permettre la régénération du catalyseur et la restauration de la production. Le méthacrylate de méthyle est séparé de l'eau, du propanoate de méthyle du formaldéhyde par une première distillation, tandis que l'eau et le propanoate de méthyle sont recyclés par déshydratation du formaldéhyde. Le méthacrylate de méthyle est purifié à plus de 99,9 % par distillation sous vide.
Autres voies de synthèse
Par le propanal
L'éthylène C2H4 est d'abord hydroformylé pour donner du propanal CH3CH2CHO, qui est ensuite condensé avec du formaldéhyde HCHO pour produire de la méthacroléine CH2=C(CH3)CHO. La condensation est catalysée par une amine secondaire. L'oxydation à l'air de la méthacroléine en acide méthacrylique CH2=C(CH3)COOH complète la synthèse de l'acide :
- CH3CH2CHO + HCHO ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH.
À partir de l'acide isobutyrique
L'acide isobutyrique (CH3)2CHCOOH est obtenu par hydrocarboxylation du propylène CH2=CHCH3 en présence de fluorure d'hydrogène comme catalyseur :
- CH2=CHCH3 + CO + H2O ⟶ (CH3)2CHCOOH.
La déshydrogénation oxydante de l'acide isobutyrique donne l'acide méthacrylique CH2=C(CH3)COOH selon une réaction catalysée par des oxydes métalliques :
- (CH3)2CHCOOH + 1⁄2 O2 ⟶ CH2=C(CH3)COOH + H2O.
Par le méthylacétylène
Le propyne HC≡CCH3, ou méthylacétylène, est converti en méthacrylate de méthyle par la chimie de Reppe en une étape avec un rendement de 99 % à l'aide d'un catalyseur dérivé d'acétate de palladium(II) (CH3COO)2Pd, ligands phosphine PH3 et acides de Brønsted :
Par l'isobutylène
Les réactions par oxydation directe consistent en une oxydation en deux étapes d'isobutylène CH2=C(CH3)2 ou d'alcool tert-butylique (CH3)3COH avec de l'air pour produire de l'acide méthacrylique CH2=C(CH3)COOH et une estérification par le méthanol CH3OH pour produire le méthacrylate de méthyle :
- CH2=C(CH3)2 + O2 ⟶ CH2=C(CH3)CHO + H2O ;
- CH2=C(CH3)CHO + 1⁄2 O2 ⟶ CH2=C(CH3)COOH ;
- CH2=C(CH3)COOH + CH3OH ⟶ CH2=C(CH3)COOCH3 + H2O.
Par le méthacrylonitrile
Le méthacrylonitrile CH2=C(CH3)C≡N peut être produit par ammoxydation à partir d'isobutylène CH2=C(CH3)2 :
- CH2=C(CH3)2 + NH3 + 3⁄2 O2 ⟶ CH2=C(CH3)C≡N + 3 H2O.
Cette étape est analogue à la voie industrielle vers l'acrylonitrile CH2=CHC≡N, un composé apparenté. Le méthacrylonitrile peut être hydraté en méthacrylamide CH2=C(CH3)CONH2 par l'acide sulfurique H2SO4 :
- CH2=C(CH3)C≡N + H2SO4 + H2O ⟶ CH2=C(CH3)CONH2·H2SO4 ;
- CH2=C(CH3)CONH2·H2SO4 + CH3OH ⟶ CH2=C(CH3)COOCH3 + NH4HSO4.
Mitsubishi Gas Chemicals a proposé d'hydrater le méthacrylonitrile en méthacrylamide sans utiliser d'acide sulfurique puis de l'estérifier par du formiate de méthyle HCOOCH3 pour obtenir le méthacrylate de méthyle :
- CH2=C(CH3)C≡N + H2O ⟶ CH2=C(CH3)CONH2 ;
- CH2=C(CH3)CONH2 + HCOOCH3 ⟶ CH2=C(CH3)COOCH3 + HCONH2 ;
- HCONH2 ⟶ NH3 + CO.
Estérification de la méthacroléine
Asahi Chemical a développé un procédé reposant sur l'estérification oxydante directe de la méthacroléine CH2=C(CH3)CHO, qui ne produit pas de sous-produits tels que le bisulfate d'ammonium NH4HSO4. La matière première est l'alcool tert-butylique, comme dans la méthode par oxydation directe. Dans la première étape, la méthacroléine est produite de la même manière que dans le processus d'oxydation directe par oxydation catalytique en phase gazeuse et est simultanément oxydée et estérifiée dans du méthanol liquide pour obtenir directement le méthacrylate de méthyle :
- CH2=C(CH3)CHO + CH3OH + 1⁄2 O2 ⟶ CH2=C(CH3)COOCH3 + H2O.
Utilisations
L'application principale du méthacrylate de méthyle, qui représente environ 75 % du volume produit, est la fabrication de plastiques acryliques en polyméthacrylate de méthyle (PMMA). Le méthacrylate de méthyle est également utilisé pour la production du copolymère méthacrylate de méthyle-butadiène-styrène (MBS), utilisé comme modificateur du PVC. Il est également utilisé dans les prothèses totales de la hanche ainsi que dans les prothèses du genou pour fixer les inserts osseux dans l'os, ce qui réduit significativement les douleurs post-opératoires mais a une durée de vie qui n'excède généralement pas 20 ans, ce qui fait qu'on en réserve l'usage plutôt pour les personnes âgées, les patients plus jeunes étant traités sans PMMA pour allonger la durée de vie des prothèses.
Le méthacrylate de méthyle est une matière première pour la fabrication d'autres méthacrylates. C'est par exemple le cas du méthacrylate d'éthyle CH2=C(CH3)COOCH2CH3 (EMA), du méthacrylate de butyle CH2=C(CH3)COOCH2CH2CH2CH3 (BMA) et du méthacrylate de 2-éthylhexyle CH2=C(CH3)COOCH2CH(C2H5)CH2CH2CH2CH3 (2-EHMA). L'acide méthacrylique CH2=C(CH3)COOH (MAA) est utilisé comme intermédiaire ainsi que dans la fabrication de polymères de revêtements, de produits construction et d'applications textiles.
Liens externes
- Chemical data on Chemicalland
- US Environmental Protection Agency, 1994 data
- Intox Cheminfo data
- SRI Consulting PEP report
- Methacrylate Producers Association (MPA)
- National Pollutant Inventory - Methyl methacrylate fact sheet
- Basic Acrylic Monomer Manufacturers (BAMM)





