Limonène
| Limonène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
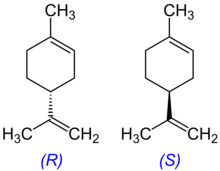
| Structure du R-limonène. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | 1-méthyl-4-prop-1-èn-2-yl-cyclohexène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS |
5989-27-5 (R) 5989-54-8 (S)(–) 138-86-3 (RS) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA | 100.004.856 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 227-813-5 (R) 227-815-6 (–) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 440917 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2633 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | liquide incolore, d'odeur caractéristique (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule |
C10H16 [Isomères] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire | 136,234 ± 0,009 1 g/mol C 88,16 %, H 11,84 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −75 °C (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 176 °C (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | dans l'eau : nulle (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 0,84 g cm−3 (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 255 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 48 °C (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 0,7–6,1 %vol[réf. souhaitée] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | à 14,4 °C : 0,4 kPa (d-limonène) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp |
équation (D) :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pouvoir rotatoire | (+)-limonène : +10,6 °·dm-1·l·g-1 (–)-limonène : −10,6 °·dm-1·l·g-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H226, H315, H317, H410, P210, P233, P241, P242, P243, P264, P272, P273, P280, P331, P362, P391, P301+P310, P303+P361+P353, P333+P313, P370+P378, P405, P403+P235 et P501
H226 : Liquide et vapeurs inflammables H315 : Provoque une irritation cutanée H317 : Peut provoquer une allergie cutanée H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P233 : Maintenir le récipient fermé de manière étanche. P241 : Utiliser du matériel électrique/de ventilation/d’éclairage/…/antidéflagrant. P242 : Ne pas utiliser d'outils produisant des étincelles. P243 : Prendre des mesures de précaution contre les décharges électrostatiques. P264 : Se laver … soigneusement après manipulation. P272 : Les vêtements de travail contaminés ne devraient pas sortir du lieu de travail. P273 : Éviter le rejet dans l’environnement. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P331 : NE PAS faire vomir. P362 : Enlever les vêtements contaminés et les laver avant réutilisation P391 : Recueillir le produit répandu. P301+P310 : En cas d'ingestion : appeler immédiatement un CENTRE ANTIPOISON ou un médecin. P303+P361+P353 : En cas de contact avec la peau (ou les cheveux) : enlever immédiatement les vêtements contaminés. Rincer la peau à l’eau/se doucher. P333+P313 : En cas d’irritation ou d'éruption cutanée : consulter un médecin. P370+P378 : En cas d’incendie : utiliser … pour l’extinction. P405 : Garder sous clef. P403+P235 : Stocker dans un endroit bien ventilé. Tenir au frais. P501 : Éliminer le contenu/récipient dans … |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Limonène  B3, D2B, Limonène (d-)   B3, D2B, Limonène (l-)   B3, D2B, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le limonène, LIM, de formule brute C10H16, est un hydrocarbure terpénique présent dans de nombreuses huiles essentielles à partir desquelles il peut être obtenu par distillation. À température ambiante, c'est un liquide incolore à odeur brillante, fraîche et propre d'orange, caractéristique des agrumes.
Le limonène est utilisé comme solvant dans les produits de nettoyage, la fabrication de produits alimentaires, la parfumerie et les produits d'hygiène, ainsi que comme insecticide.
Le limonène tire son nom du citron qui, comme les autres agrumes, contient des quantités considérables de ce composé chimique, responsable en grande partie de leur parfum.
Le limonène est une molécule chirale, et, comme pour beaucoup de molécules chirales, les sources biologiques produisent un énantiomère spécifique. La principale source industrielle, l'orange, contient du d-limonène ((+)-limonène), qui est l'énantiomère R dextrogyre. L'eucalyptus et la menthe poivrée, quant à eux, contiennent du l-limonène ((–)-limonène), qui est l'énantiomère S lévogyre. Le limonène racémique est connu en tant que « dipentène ».
Le limonène peut favoriser la cicatrisation des plaies et l'anabolisme, tout en améliorant le stress, la dépression, l'inflammation, le stress oxydatif, les spasmes et les infections virales.
En outre, il présente une variété de propriétés anticancéreuses.
Utilisations
Comme l'odeur principale qui constitue les agrumes (famille des Rutaceae), le D-limonène est utilisé dans l'industrie agroalimentaire ainsi que dans l'industrie pharmaceutique pour parfumer les médicaments, notamment les alcaloïdes amers. Il est également utilisé dans les produits nettoyants pour son odeur rafraîchissante orange-citron et son effet dissolvant.
Ainsi, le limonène est également de plus en plus utilisé comme solvant, notamment le dégraissage des machines, puisqu'il est produit depuis une source renouvelable, l'huile de citrus, comme un sous-produit de la fabrication de jus d'orange.
Le limonène fonctionne comme solvant à peinture lorsqu'elle est appliquée sur du bois.
L'énantiomère R est également utilisé comme insecticide et a des propriétés répulsive sur de nombreux insectes comme les aleurodes.
L'énantiomère S (ou L-limonène) a une odeur plus proche du pin et de la térébenthine.
L'utilisation du limonène est très fréquente dans les produits cosmétiques.
Chimie
Le limonène est un terpène relativement stable, qui peut être distillé sans décomposition, et forme de l'isoprène lorsqu'on le fait passer sur un filament de métal chaud. Il est facilement oxydé en environnement humide en carvéol et en carvone. L'oxydation à l'aide du soufre produit du p-cymène et un sulfure.
Le limonène existe naturellement comme (R)-énantiomère, mais peut être racémisé en dipentène, en le chauffant simplement à 300 °C. Lorsqu'il est chauffé avec un acide minéral, le limonène forme un diène conjugué, l'α-terpinène, qui s'oxyde facilement en p-cymène, un hydrocarbure aromatique. La preuve est en la formation d'α-terpinène résultant d'une réaction de Diels-Alder lorsque le limonène est chauffé avec de l'anhydride maléique.
Il est possible d'effectuer la réaction sur l'une des deux liaisons sélectivement. Le chlorure d'hydrogène anhydre réagit préférentiellement sur l'alcène disubstitué, alors que l'époxydation avec l'acide métachloroperbenzoïque (MCPBA) se fait sur l'alcène trisubstitué. Dans les deux cas, il est également possible de faire réagir l'autre double liaison.
Dans une autre méthode synthétique, l'addition Markovnikov d'acide trifluoroacétique suivie de l'hydrolyse de l'acétate donne du terpinéol.
Biosynthèse
Le limonène est formé à partir de géranyl-pyrophosphate, via une cyclisation d'un néryle carbocation ou son équivalent, comme montré ci-dessous. L'ultime étape inclut la perte d'un proton par le cation pour former l'alcène.
Sécurité / Santé
Le limonène et ses produits d'oxydation en grande concentration sont irritants pour la peau. Le 1,2-dihydroxylimonène (formé par simple oxydation à l'air) est connu comme sensibilisant cutané.
La plupart des cas d'irritation ont été signalés chez des personnes exposées à long terme en milieu industriel au composé pur (par exemple, lors d'opération de dégraissage avant mise en peinture).
Toutefois une étude de patients présentant des dermatites a montré que 3 % d'entre eux avaient été sensibilisés par du limonène.
Bien qu'on ait un moment pensé qu'il pouvait être la cause de cancers du rein chez le rat, le limonène est aujourd'hui connu comme étant un agent anticancéreux avec une valeur potentielle comme outil anticancéreux diététique chez les humains.
Il n'a pas été prouvé que ce produit soit cancérigène ou génotoxique pour l'Homme.
Le CIRC a classé le d-limonène au niveau 3 : non classable comme cancérigène chez l'homme.
Sources
- E. E. Turner, M. M. Harris, Organic Chemistry, Longmans, Green & Co., Londres, 1952.
- Wallach, Annalen der Chemie, 246, 221 (1888).
- Blumann & Zeitschel, Berichte, 47, 2623 (1914).
- CSST Workplace Hazardous Materials Information System.
- M. Matura et al., J. Am. Acad. Dermatol., 2002, 33, 126-27.
Annexes
Articles connexes
Liens externes
- (en) Description sur le site de Biochem Corp.
- Fiche sécurité internationale CDC