
Leishmaniose
| Causes | Leishmania, Leishmania donovani, Leishmania infantum (en), Leishmania braziliensis (en), Leishmania mexicana (en), Leishmania major (en) ou Leishmania tropica |
|---|---|
| Symptômes | Ulcère, ulcère de la bouche, fièvre, splénomégalie, anémie et hépatomégalie |
| Médicament | Itraconazole, kétoconazole, pentamidine, miltéfosine et paromomycine |
|---|---|
| Spécialité | Infectiologie |
| CIM-10 | B55 |
|---|---|
| CIM-9 | 085 |
| DiseasesDB | 3266 29171 3266 7070 |
| MedlinePlus | 001386 |
| eMedicine | 783750 |
| MeSH | D007896 |
| Patient UK | Leishmaniasis |
La leishmaniose est une maladie chronique à manifestation cutanée et/ou viscérale (il est question de leishmanioses au pluriel) et à transmission vectorielle, due à une vingtaine d'espèces de protozoaires flagellés appartenant au genre Leishmania de la famille des Trypanosomatidae et transmises par la piqûre de certaines espèces de phlébotomes, comprenant les insectes du genre Lutzomyia dans le Nouveau Monde et Phlebotomus dans l’Ancien Monde.
Les leishmanioses sont des maladies parasitaires de l'espèce humaine et de nombreuses autres espèces de mammifères. Réparties dans 88 pays, leur incidence est actuellement de 2 millions de nouveaux cas humains par an. La répartition géographique des leishmanioses dépend de celle des phlébotomes vecteurs et des mammifères réservoirs.
La leishmaniose est une zoonose commune au chien et aux humains
Parasite


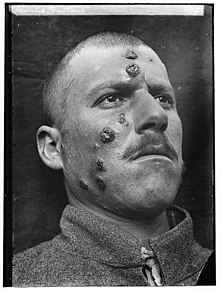
La plupart des formes de cette maladie ne sont transmissibles qu'entre canidés (ou d'autres mammifères) et certains insectes, mais quelques-unes touchent les humains (zoonose). L'infection humaine est provoquée par environ 21 des 30 espèces qui infectent les mammifères. Parmi celles-ci sont regroupés le complexe de L. donovani avec 3 espèces (L. donovani, L. infantum et L. chagasi) ; le complexe de L. mexicana avec 3 espèces principales (L. mexicana, L. amazonensis et L. venezuelensis) ; L. Tropica ; L. major ; L. aethiopica ; et le sous-genre Viannia avec 4 espèces principales (L. (V.) braziliensis, L. (V.) guyanensis, L. (V.) panamensis, L. (V.) peruvian).
Ces différentes espèces sont morphologiquement indifférentiables mais peuvent être distinguées par analyse des isoenzymes, analyse des séquences ADN, ou anticorps monoclonaux.
Épidémiologie
L'humain n’est un réservoir prouvé et majeur que pour deux espèces : Leishmania donovani et Leishmania tropica. Toutes les autres espèces, dont la pathogénicité et la fréquence sont variables, sont des agents de zoonoses.
Les formes cliniques classiques sont viscérales et tégumentaires.
La leishmaniose viscérale (LV)
C'est une forme sévère de la maladie, dans laquelle les parasites ont migré dans les organes vitaux. Elle est majoritairement anthroponotique (réservoir humain) comme dans le foyer historique où a été décrit le Kala Azar (Nord-Est de l’Inde, Népal et Bangladesh) ainsi qu’en Afrique de l'Est dans des pays comme le Soudan (environ 20 000 cas par an), Éthiopie (4 000 cas par an) mais aussi Érythrée, le Kenya, l’Ouganda et la Somalie. Elles sont dues à Leishmania donovani, sont épidémiques et représentent 90 % des 500 000 nouveaux cas humains mondiaux annuels.
Les LV zoonotiques sont plus rares et sporadiques principalement sur tout le pourtour du bassin méditerranéen et en Amérique Latine en particulier au Brésil (surtout dans la région du Nordeste où 4 000 à 5 000 cas par an essentiellement pédiatriques sont recensés en lien avec la pauvreté et la malnutrition). Elles sont dues à Leishmania infantum, espèce tout particulièrement pathogène pour le chien qui en est aussi le réservoir. Au Maghreb quelques centaines de cas humains sont détectés par an, contre environ 700 cas de LV autochtone par an en Europe du Sud où Leishmania infantum est la seule espèce présente. La LV patente est mortelle si non traitée. Des formes cutanées dues à ce parasite, souvent spontanément curables, sont aussi décrites. On rapporte également des formes subcliniques ou pauci-symptomatiques mais surtout une proportion très importante de porteurs asymptomatiques dans la population méditerranéenne. Ces individus sont des candidats au développement d’une LV patente en cas d’immunodépression comme on l’a vu avec l’épidémie de sida et aujourd’hui avec l’utilisation de certaines thérapies immunosuppressives. En effet, Leishmania infantum est un parasite opportuniste.
Diagnostic : Évoqué sur des arguments cliniques classiques (fièvre folle, pâleur, splénomégalie) associés une pancytopénie sanguine, le diagnostic biologique classique de certitude de la LV se fait par la mise en évidence du parasite par microscopie de la moelle osseuse (ou dans la rate en Inde !) ou dans le sang. Ce diagnostic a bénéficié des progrès reposant sur les techniques de biologie moléculaire comme la PCR qualitative dans le sang.
Traitement : On faisait naguère appel aux sels d’antimoine (Glucantime, Pentostam) en injection intramusculaire pendant 28 jours. Mais l'émergence de résistances, en particulier dans le foyer indien a conduit à rechercher d’autres médicaments actifs. C’est ainsi que l’amphotéricine B liposomale (AmbiSome) en perfusion durant quelques jours ou la miltéfosine (Impavido) premier anti-Leishmania utilisable per os tendent à remplacer les antimoniés. Ces derniers sont parfois utilisés en association, particulièrement en Asie, pour éviter le développement de résistances. L’aminosidine par voie intramusculaire est aussi proposée.
Les leishmanioses tégumentaires
Elles sont essentiellement cutanées, beaucoup plus rarement muqueuses. La leishmaniose cutanée (LC) : elle peut aussi être causée par Leishmania donovani (en particulier au Sri Lanka).
Dans l’Ancien Monde et en particulier les régions africaines et du Proche-Orient et Moyen-Orient, deux espèces sont majoritairement responsables de leishmanioses cutanées (LC). Il s’agit, d’une part, de Leishmania major, agent de la leishmaniose cutanée zoonotique qui se présente sous forme d’une ou plusieurs lésions ulcérées développées au point de piqûre des phlébotomes. Dans ces régions, les réservoirs sont des rongeurs sauvages des cultures (Psamommys, Meriones). Dans le Maghreb, on en a répertorié plus de 10 000 cas au cours de la seule année 2008 et environ 20 000 cas en Iran au cours de la même année. De plus, ce parasite est à l’origine d’épidémies récentes en Afrique de l’Ouest au Burkina Faso et au Mali. Leishmania tropica est l’autre espèce majeure responsable de LC dans l’Ancien Monde. C’est une espèce anthroponotique à l’origine d’épidémies urbaines dans des grandes villes affectant plusieurs dizaines de milliers d’individus comme à Alep en Syrie ou à Kaboul en Afghanistan. Un variant de Leishmania tropica, Leishmania killicki, responsable de leishmanioses cutanées plus chroniques, a d’abord été identifié en Tunisie, puis en Libye et plus récemment en Algérie. Il serait l’agent d’une leishmaniose zoonotique avec un rongeur réservoir : le gondi. Dans le Nouveau Monde, on observe les leishmanioses tégumentaires sud-américaines. Leishmania guyanensis, agent du Pian bois, est l’espèce la plus souvent diagnostiquée en France métropolitaine chez des individus de retour de séjour en forêt amazonienne en Guyane Française (aventuriers, militaires). Les réservoirs sont des paresseux, animaux de la forêt. Il faudra, au moyen d’outils moléculaires différencier cette espèce de Leishmania braziliensis dont les réservoirs sont plutôt des rongeurs forestiers. En effet, L. braziliensis est responsable, comme L.guyanensis, d’une lésion cutanée localisée au point de piqûre du phlébotome mais elle évolue généralement vers une forme métastatique muqueuse délabrante de la sphère ORL qu’on appelle Espundia. De plus, le traitement diffère en fonction de l’espèce parasitaire. La pentamidine (Pentacarinat), en cure courte de 2 à 3 injections intramusculaires, sera le traitement de choix des formes à L. guyanensis. Les antimoniés restent le traitement de première ligne des formes dues à L. braziliensis. Une autre espèce à retenir est Leishmania mexicana responsable de l’ulcère des gommiers (Chicleros) avec atteinte du pavillon des oreilles en Amérique du Sud et Centrale. Les réservoirs sont aussi des rongeurs. Deux autres espèces de leishmanie, Leishmania aethiopica dans l’Ancien Monde et Leishmania amazonensis dans le Nouveau Monde peuvent être responsables de formes particulièrement redoutables appelées leishmanioses cutanées disséminées.
Diagnostic de certitude des LC : il peut être orienté par une technique sérologique très sensible comme le western blot. Il se fait généralement par biopsie, grattage ou ponction-aspiration de la lésion évocatrice. L’examen direct après coloration de May-Grünwald-Giemsa permettra la mise en évidence du parasite sous sa forme amastigote. La culture du prélèvement sur milieux spéciaux (Novy McNeal Nicolle ; Schneider) ainsi que les techniques de biologie moléculaire aboutiront au diagnostic d’espèce.
Prévention des leishmanioses humaines
La prévention des leishmanioses humaines est compliquée. Elle doit combiner une action sur les phlébotomes, qui suppose de bien connaître leur écologie, variable selon les espèces, et une action sur les réservoirs (humain ou animaux domestiques ou sauvages). Elle doit aussi tenir compte de la virulence de la souche et de la sensibilité de l’hôte (immunité, génétique).
Il n’y a actuellement pas de vaccin disponible pour la prévention de la leishmaniose humaine.
Cycle parasitaire

Le parasite manipule l'odeur de son hôte (qui attire des phlébotomes, qui transporteront alors le parasite vers d'autres hôtes).
La leishmaniose est transmise à l'hôte définitif par la piqûre du phlébotome femelle, qui ont joué le rôle d'hôtes intermédiaires. Les phlébotomes injectent la larve au stade infectieux, de promastigotes métacycliques, pendant le repas de sang (1). Les promastigotes métacycliques qui atteignent la plaie de piqûre sont phagocytées par les macrophages (2) et se transforment en amastigotes (3). Les amastigotes se multiplient dans les cellules infectées et atteignent différents tissus, suivant (du moins en partie) l’espèce de Leishmania qui est impliquée (4). Ces spécificités d’atteinte tissulaires différentes sont la cause des manifestations cliniques qui différent dans les diverses formes de leishmaniose. Les phlébotomes s’infectent pendant les repas de sang sur un hôte infecté quand ils ingèrent des macrophages porteurs d’amastigotes (5.6). Dans l’intestin du phlébotome, les parasites se différencient en promastigotes (7), qui se multiplient et se différencient en promastigotes métacycliques et migrent dans la trompe du phlébotome (8) (« Cycle évolutif »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )). Le parasite modifie l'odeur de son hôte, ce qui attire des phlébotomes qui vont eux-mêmes s'infecter et alors contribuer à véhiculer la maladie (un phénomène similaire a été suspecté puis récemment observé dans le cas du paludisme ).
Signes cliniques
La leishmaniose est une maladie à évolution habituellement lente qui peut revêtir plusieurs aspects. Il existe deux grandes variétés de leishmaniose : la leishmaniose cutanéomuqueuse et la leishmaniose viscérale, le plus souvent secondaire à la première (mais elle peut être primitive d'emblée).
Leishmaniose cutanée
C'est la forme la plus répandue. Elle provoque des lésions ulcératives sur le corps qui apparaissent des semaines ou des mois après l'infestation. Elles guérissent habituellement en quelques mois, laissant des cicatrices particulièrement inesthétiques. La maladie peut passer à la chronicité sous la forme d'une leishmaniose viscérale avec atteinte splénique entraînant une anémie et/ou hépatique. La leishmaniose est l'une des causes connue de splénomégalie (augmentation de volume de la rate), qui peut devenir plus grosse même que le foie. Lorsqu'elle est diffuse, la leishmaniose produit des lésions cutanées étendues qui ressemblent à celles de la lèpre et sont particulièrement difficiles à traiter.
Dans l'ancien monde, la leishmaniose cutanée est due au protozoaires Leishmania major, Leishmania tropica ou Leishmania aethiopica et porte des noms divers selon les régions : Bouton d'Orient ou Clou de Biskra sur le pourtour méditerranéen et Bouton d'Alep au Proche-Orient. Dans le nouveau monde, elle est due à Leishmania mexicana, Leishmania panamensis, Leishmania amazonensis, Leishmania peruviana, Leishmania braziliensis ou Leishmania guyanensis : uta au Pérou, espundia au Brésil (réservoir : paresseux) et pian-bois (zones forestières humides de l'Amérique du Sud). Elles sont toutes transmises par la piqûre de phlébotomes infectés. Leurs réservoirs sont divers et pas toujours bien connus (rongeurs, chiens ...).
Le Bouton d'Orient est une lésion d'inoculation du parasite par le phlébotome vecteur (Afrique du nord, Asie mineure, Amérique du Sud). Après 2 semaines d'incubation, apparait une papule prurigineuse qui s'ulcère puis prend l'aspect d'une furonculose localisée. Cette lésion est indolore et siège sur les parties découvertes du corps (le front par exemple). Le parasite est retrouvé dans le fond des ulcérations, il doit faire l'objet d'une recherche au microscope. Le traitement est local, il consiste en l'injection d'antimoniate de méglumine (en France : Glucantime) tout autour de la lésion. Ces injections sont parfois renouvelées une deuxième fois si la lésion est profonde. Elles n'empêchent cependant pas la constitution, plusieurs semaines, mois ou années après, d'une leishmaniose viscérale.
La leishmaniose cutanéomuqueuse est une forme particulière de leishmaniose cutanée étendue dans laquelle les lésions atteignent les téguments avant de s'étendre aux muqueuses comme la bouche ou les narines.
Leishmaniose viscérale
C'est la forme la plus grave de la maladie. Elle est habituellement secondaire à une leishmaniose cutanée mais peut aussi être primitive d'emblée. Elle est alors due à deux sous-espèces de Leishmania donovani : L. d. infantum et L. d. donovani, et décrite sous le nom de kala-azar.
L'incidence mondiale est de l'ordre de 500 000 nouveaux cas annuels. Elles sont plus fréquentes dans les pays du pourtour méditerranéen, au Brésil (où le nombre de cas humains a doublé entre 1990 et 2015 ; y tuant plusieurs milliers de personnes par an), au Soudan et dans la péninsule indienne. Les réservoirs de L. infantum sont le chien, le renard et des autres membres de la famille des canidae. L'humain est le réservoir unique de L. d. donovani. La transmission est essentiellement effectuée par la piqûre de phlébotomes infectés. Le tableau clinique caractéristique de la maladie est celui d'une splénomégalie majeure anémiante avec teint cireux et fièvre, qui se constitue en quelques mois d'évolution.
Le diagnostic de certitude est affirmé par l'identification du parasite dans les tissus humains (ou du chien).
L'examen le plus simple et le plus rentable est actuellement le myélogramme (ponction de moelle osseuse): l'analyse du frottis médullaire permet de révéler la présence des parasites parfois associée à une réaction histiocytaire. Plusieurs méthodes sérologiques sont également disponibles avec une bonne fiabilité.
On a montré que les poils des chiens infectés ont une odeur différente. Il serait possible de dresser des chiens pour identifier d'autres chiens malades, mais cela est compliqué. Une alternative en cours de mise au point est un « nez électronique » (eNose) : une expérience publiée en 2019 a consisté à utiliser des échantillons de sang et de poils de chiens diagnostiqués comme atteint de Leishmaniose et de 185 autres chiens ; des sachets de poils ont été remplis d'eau puis chauffés, et des échantillons de l'air contenus dans ces sacs ont été soumis au nez électronique. Ce dernier a détecté la maladie dans 95% des cas. Le détecteur est encore un prototype fragile, mais il pourrait être encore amélioré et commercialisé selon ses concepteurs.
Traitement

Il existe deux molécules couramment utilisées contenant de l’antimoine, l’antimoniate de méglumine (Glucantime) et le stibogluconate de sodium (Pentostam). Le mécanisme d’action de ces produits contre le parasite n'est pas complètement élucidé ; elles peuvent perturber son mécanisme de production d’énergie ou le métabolisme de la trypanothione. Malheureusement, dans beaucoup de régions du monde, le parasite est devenu résistant à l'antimoine et pour la leishmaniose viscérale ou cutanéomuqueuse l'amphotéricine (AmbiSome) est maintenant le traitement de choix. L'échec de l'AmbiSome pour traiter la leishmaniose viscérale (Leishmania donovani) a été rapporté au Soudan. Mais cet échec peut être attribué à des facteurs dépendants de l’hôte, telles la coinfection avec le VIH ou la tuberculose davantage que par la résistance du parasite.
La miltéfosine (Impavido), est un nouveau médicament pour traiter la leishmaniose viscérale et cutanée. Le taux de bons résultats pour la miltéfosine dans la phase III des essais cliniques est de 95 %. Des études en Éthiopie montrent qu’il est également efficace en Afrique. Chez les malades immunodéprimés atteints du VIH et qui sont coinfectées par la leishmaniose, il a été prouvé que, même dans les formes résistantes, deux tiers des patients réagissent à ce nouveau traitement. Des essais cliniques en Colombie ont montré un taux d’efficacité élevé pour la leishmaniose cutanée. Dans les formes cutanéomuqueuses provoquées par L. brasiliensis ce traitement s’est montré plus efficace que d'autres molécules. La miltéfosine a reçu l'autorisation de mise sur le marché des autorités indiennes en 2002 et allemandes en 2004. En 2005 il a reçu la première autorisation pour la leishmaniose cutanée en Colombie. La miltéfosine est actuellement évaluée également pour le traitement de la leishmaniose cutanéomuqueuse provoquée par le L. braziliensis en Colombie et les résultats préliminaires sont très prometteurs. Il est maintenant autorisé dans de nombreux pays et c’est la première percée thérapeutique pour un traitement administré par voie orale pour la leishmaniose viscérale et cutanée (More, et al. 2003). En , il a reçu le statut de médicament orphelin de la Food and drug administration des États-Unis. La molécule est généralement mieux tolérée que d'autres médicaments. Les effets secondaires principaux sont des troubles de gastrointestinaux dans les un à deux premiers jours du traitement ce qui n'affecte pas son efficacité. Puisqu'il est disponible pour un traitement par voie orale, il évite les dépenses et les inconvénients de l'hospitalisation, ce qui fait de lui une alternative intéressante. L'institut pour la santé mondiale a développé la paromomycine, dont les résultats ont conduit à son inscription comme médicament orphelin.
L'amphotéricine B sous sa forme liposomique (AmbiSome) est actuellement considérée comme le traitement de choix des formes viscérales. Ce traitement est donné par voie intraveineuse sur une durée courte (5 à 6 jours); la dose cumulative doit être d'au moins 20 mg/kg. Il est moins toxique que les traitements à base d'antimoine. Il peut être utilisé chez les enfants et aussi chez des sujets fragilisés (femmes enceintes, sujet immunodéprimés y compris patients infectés par le VIH. La principale limitation à son utilisation dans les pays en voie de développement est son coût élevé.
Des approches sont actuellement en cours pour identifier de nouveaux traitements actifs :
- la leishmaniose résistante aux médicaments peut répondre favorablement à l'immunothérapie (inoculation d’antigènes du parasite associés à un adjuvant) qui vise à stimuler le propre système immunitaire du malade pour éliminer le parasite ;
- depuis le , l’University of Antioquia à Medellín (Colombie), avec la collaboration de chercheurs de l'University of Texas Medical Branch à Galveston, (Texas, États-Unis) a lancé un projet de recherche partagé avec le logiciel World Community Grid afin d'identifier des molécules permettant la création d'un traitement ;
- plusieurs vaccins potentiels sont en cours de développement, à la demande de l'organisation mondiale de la santé, mais aucun n'est encore disponible en 2010. L'équipe du laboratoire de chimie organique à l'institut fédéral de technologie suisse (ETH) à Zurich essaye de concevoir un vaccin à base de glucides. Par ailleurs, le génome du parasite Leishmania major a été séquencé ce qui rend possible l'identification des protéines parasitaires qui sont importantes pour le caractère infectieux du parasite et sont ainsi des cibles potentielles pour des traitements médicamenteux.
Épidémiologie
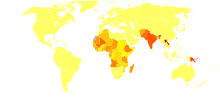
- absence de données
- moins de 20
- 20-30
- 30-40
- 40-50
- 50-60
- 60-70
- 70-80
- 80-100
- 100-120
- 120-150
- 150-200
- plus de 200
La leishmaniose peut être contractée dans de nombreux pays tropicaux et subtropicaux ainsi que sur le pourtour du Bassin Méditerranéen. Elle est présente dans des régions relevant de 88 pays environ. Approximativement 350 millions de personnes vivent dans les zones d’endémie. Les conditions climatiques compatibles avec le développement de la leishmaniose sont très larges, allant des forêts tropicales d’Amérique centrale et d’Amérique du Sud aux déserts d’Asie occidentale. Plus de quatre-vingt-dix pour cent des cas mondiaux de leishmaniose viscérale se rencontrent en Inde, au Bangladesh, au Népal, au Soudan et au Brésil.
La leishmaniose est également retrouvée au Mexique, en Amérique Centrale, et en Amérique du Sud, du nord de l'Argentine au sud du Texas (sauf en Uruguay ou au Chili), l'Europe méridionale (la leishmaniose n'est pas répandue chez les voyageurs à destination de l’Europe méridionale), l'Asie (sauf le Sud-est asiatique), le Moyen-Orient, et l'Afrique (particulièrement l’Afrique du Nord et de l’Est, avec quelques cas ailleurs). La maladie n'existe pas en Australie ou en Océanie.
La leishmaniose est présente en Irak et a été contractée par un certain nombre de soldats des troupes impliquées dans l’invasion de ce pays en 2003 et dans son occupation. Les soldats ont surnommé la maladie le furoncle de Bagdad. Selon Kris Hundley plus de 650 soldats des États-Unis auraient contracté la maladie entre le début de l'invasion en mars 2003 et fin 2004.
En 2004, environ 3 400 hommes de troupe de l'armée colombienne, opérant dans la jungle du sud du pays (en particulier autour des départements de Meta et de Guaviare), ont été atteints par la leishmaniose. Apparemment, une des raisons qui a contribué à cette épidémie était le fait que plusieurs des soldats atteints n'avaient pas utilisé le produit répulsif mis à leur disposition, en raison d’une odeur jugée désagréable. Il est estimé que près de 13 000 cas de la maladie ont été enregistrés dans l’ensemble de la Colombie tout au long de l’année 2004, et environ 360 nouveaux cas parmi des soldats avaient été recensés en février 2005.
En septembre 2005 la maladie a été contractée par au moins quatre soldats hollandais ayant stationné à Mazari Sharif, en Afghanistan, qui ont été rapatriés pour traitement.
Au Maroc, dans la région de Errachidia, 500 à 600 cas de leishmaniose sont enregistrés par an avec des pics épidémiques tous les cinq ans.
En France métropolitaine, la leishmaniose est présente dans tout le Sud du pays, plus particulièrement dans les régions du Sud Est mais aussi dans certains départements de la région Rhône-Alpes comme l'Ardèche ou la Côte d'Azur, et elle tend à gagner en importance. Comme sur toute la rive nord du bassin méditerranéen, la leishmaniose humaine autochtone y est exclusivement due à Leishmania infantum. Jusqu’aux années 1980, la leishmaniose viscérale du Sud de la France était principalement une maladie du jeune enfant. Avec l’émergence du SIDA, Leishmania infantum se comporte comme un agent opportuniste responsable de leishmaniose viscérale disséminée chez ces patients exclusivement adultes et très immunodéprimés. Leishmania infantum est un parasite peu pathogène pour l’humain. L’expression de sa pathogénicité dépend de facteurs de risque liés à l’hôte ou au parasite encore mal connus. L’immunodépression de l’hôte est certainement le facteur de risque le mieux exploré permettant le développement de formes viscérales mortelles à l’absence de traitement.
La leishmaniose viscérale (LV) méditerranéenne
La forme viscérale humaine est une maladie, de survenue sporadique, qui se caractérise par une fièvre capricieuse ou folle d’évolution chronique associée à une grande fatigue et une pâleur cireuse traduisant l’anémie. L’examen clinique révèle très souvent une rate hypertrophiée. Une prise de sang permettra d’orienter le diagnostic par la mise en évidence d’une pancytopénie, d’un syndrome inflammatoire et d’une réponse positive aux tests sérologiques. Ce diagnostic sera le plus souvent confirmé par la mise en évidence des leishmanies par la ponction de moelle osseuse. Des techniques modernes de biologie moléculaire (PCR) très sensibles appliquées à la moelle osseuse ou au sang sont aujourd’hui fréquemment utilisées. Elles sont particulièrement utiles pour le suivi post-thérapeutique. En dehors des classiques formes viscérales du jeune enfant qui sont régulièrement diagnostiquées et représentent encore 30 % du total des formes viscérales humaines, les observations chez des individus adultes sont aujourd’hui majoritaires et représentent 70 % de l’ensemble. Chez les patients coinfectés par le VIH, des formes disséminées avec des localisations originales digestives ou pulmonaires sont décrites. Plus récemment, des cas ont été assez fréquemment relevés chez les transplantés d’organe immunodéprimés. Enfin, on note aussi des formes paucisymptomatiques comme exclusivement adénopathiques. Depuis 1999, le Centre National de Référence des Leishmania recense les cas de leishmanioses. La synthèse des publications sur ce sujet permet de noter, de 1999 à 2009, 205 cas de LV acquis en France métropolitaine en 11 ans. La moyenne est de 14 cas par an pour les cinq dernières années. Les patients originaires des Alpes-Maritimes et ceux des Bouches-du-Rhône représentent respectivement 35 % et 20 % de l’ensemble des cas autochtones français. Au total, 15 départements du Sud sont à l’origine des cas autochtones avec une incidence annuelle moyenne maximum dans le département des Alpes-Maritimes (0,66 pour 100 000 habitants). Le traitement repose aujourd’hui sur l’amphotéricine B liposomale (AmBisome) en perfusion de 2 à 6 jours. Aucune résistance n’est décrite à ce jour et ce médicament a supplanté les antimoniés dont la cure durait un mois. Seuls les patients très immunodéprimés ont tendance aux rechutes. La guérison repose aussi sur l’amélioration de l’immunité.
Les leishmanioses tégumentaires dues à Leishmania infantum
Parmi celles-ci on distingue les formes cutanées et les formes muqueuses. Les leishmanioses cutanées sont rarement diagnostiquées (26 cas au cours des 11 dernières années) probablement parce qu’elle passent inaperçues lorsqu’elles siègent sur certaines parties du corps à l’exception du visage. Elles se caractérisent par un grand polymorphisme clinique. Les lésions qui sont le plus souvent uniques. L’évolution se fait généralement vers la guérison spontanée. Il n’y a pas de dissémination aux viscères à l’exception des individus très immunodéprimés. Les leishmanioses muqueuses sont plus sévères bien que plus rares (8 cas au cours des 11 dernières années). Elles surviennent le plus souvent chez des individus immunodéprimés, sont localisées au larynx, au nez et à la bouche. Souvent délabrantes, elles nécessitent une thérapeutique adaptée pour éviter la dissémination qui est souvent déjà présente au moment du diagnostic.
Le portage asymptomatique humain de Leishmania infantum
Le nombre limité de cas humains patents ne constitue que la partie extériorisée de l’iceberg. Dans les foyers de leishmaniose canine un grand nombre d’infections humaines demeure asymptomatique. La prévalence du portage asymptomatique est difficile à évaluer. Le nombre de sujets contacts voire porteurs asymptomatiques de leishmanies est souvent conséquent. La maladie peut se développer soit peu de temps après la primoinfection soit à la suite d’une réactivation après une latence de plusieurs années après la contamination par la piqûre de phlébotome. À partir de 1989, des dépistages de sujets contacts ont été réalisés dans différentes localités des Alpes-Maritimes sélectionnées sur l’existence de cas récents humains ou canins. Pour l’OMS, la positivité de l’intradermoréaction (IDR) à la leishmanine est le reflet du portage asymptomatique. Dans les foyers des Alpes-Maritimes, le pourcentage de positivité à l’IDR d’une population augmente de façon significative avec l’âge et la durée de résidence dans ces foyers. Devant la difficulté d’obtention d’une leishmanine de qualité, un test sérologique (le western blot) a été développé et un profil sérologique concordant avec l’IDR positive à la leishmanine a été retenu. Ceci a permis de continuer les enquêtes épidémiologiques dans les foyers des Alpes-Maritimes. Récemment, au cours de la période 2005-2010, 10 localités ont été visitées et des taux variant de 26 à 69 % de séropositivité ont été trouvés selon les lieux. Ces travaux épidémiologiques sont aujourd’hui complétés par des analyses de biologie moléculaire qui permettent de gagner en sensibilité en allant jusqu’à doubler le nombre d’individus positifs et donc porteurs asymptomatiques. En effet, la mise en évidence du génome de Leishmania infantum dans le sang périphérique d’individus sains correspond à une définition plus stricte du portage asymptomatique. Chez l’humain sain la parasitémie est très faible et transitoire dans le sang périphérique, rendant le rôle de réservoir très improbable. À noter qu’à ce jour, seules 2 études européennes ont permis d’isoler une dizaine de souches de Leishmania infantum à partir de la culture du buffy coat de poches de sang de donneurs volontaires.
Historique
La maladie, également autrefois nommée Bouton d'Orient, Clou de Biskra, Bouton d'Alep, Kala-azar, fièvre noire, fièvre à phlébotome, fièvre Dum-Dum ou espundia n'a été complètement médicalement décrite qu'en 1901 par l’anatomopathologiste écossais William Boog Leishman, mais la transmission de la leishmaniose par certains de ses vecteurs (moucherons en l'occurrence) avait déjà été étudiée dès 1786 par l’Italien Scopoli, sans qu'il ait toutefois compris le rôle des phlébotomes. Il faudra pour cela attendre les expériences des frères Sergent (de 1901 à 1904). La transmission de Leishmania infantum du chien à l’humain par l'intermédiaire du phlébotome n'a été établie qu'en 1926 par Parrot et Donatien. Ce protozoaire parasite est mis en évidence chez l’humain pour la première fois par Charles Nicolle à l’Institut Pasteur de Tunis en 1908. En France, c’est à Marseille qu’est identifié le premier cas de leishmaniose canine par Pringault en 1914. Les deux premières observations humaines de leishmaniose viscérale (LV) en France sont décrites en 1918 chez deux enfants serbes vivant à Nice depuis 18 mois et c’est en 1922 qu’est rapporté le premier cas indiscutablement autochtone chez un enfant né et n’ayant jamais quitté la Principauté de Monaco. En 1933, Faure-Brac soutient sa thèse de Docteur Vétérinaire à Lyon. Il sacrifie 187 chiens à la fourrière de Nice, trouve 18 % de chiens parasités dont 11 % sans signe clinique. Il parle d’infection latente et insoupçonnée donc déjà de porteurs asymptomatiques. Cette notion va être oubliée pendant plus d’un demi-siècle. Il faudra attendre 1943 pour la description du premier cas humain d’une leishmaniose cutanée autochtone dans les Alpes-Maritimes.
Chez le chien
La leishmaniose est une maladie commune au chien et à l'humain. Les zones d'endémie sont donc les mêmes. Due à Leishmania infantum, elle est considérée comme une maladie principalement méditerranéenne mais est actuellement en extension dans les régions au climat continental, en particulier dans le Nord-Ouest de l’Italie et en Allemagne. Elle est aussi fréquente en Amérique latine et, en particulier, au Brésil. Des cas de leishmaniose canine ont commencé à apparaître en Amérique du Nord en 2000, et au Canada en 2008. Dans la population canine de ces régions, il existe de nombreux porteurs asymptomatiques dont le rôle de réservoir n’est pas exclu. En France, bien qu'essentiellement cantonnée au pourtour méditerranéen, elle s'étend progressivement en remontant la vallée du Rhône et les vallées du Sud-Ouest.
La transmission du chien à l'humain est possible par l'intermédiaire du phlébotome. C'est dire s'il est important de connaître les signes d'appel chez l'animal. La maladie peut être grave chez le chien mais certaines lignées vivant en zone d'endémicité ont développé une tolérance à la maladie et sont des porteurs sains (ils hébergent le parasite sans être malades pour autant). Ils constituent alors un réservoir de Leishmania.
Les symptômes de la maladie dépendent des organes atteints et ce polymorphisme rend le diagnostic d'autant plus difficile. Les principaux signes qui doivent attirer l'attention chez un chien dont on sait qu'il a séjourné dans des zones d'endémicité sont : un amaigrissement progressif ; des lésions cutanées (alopécie, dermatite sèche, exfoliative ou ulcéreuse) principalement au niveau de la truffe (narines), des oreilles et des coussinets ; des griffes anormalement longues (onychogryphose ou« ongles de fakir »). Parmi les signes témoignant d’une forme viscérale, on note le gonflement des ganglions facilement palpables, des troubles oculaires, des épistaxis répétées et parfois impressionnantes résultant de troubles de la coagulation, une insuffisance rénale grave qui se traduit par une propension à boire beaucoup (polydipsie) et, par voie de conséquence, à uriner exagérément (polyurie). Ces derniers symptômes sont ceux qui amènent généralement le propriétaire à consulter.
La transmission canine s’effectue directement du phlébotome au chien. Le phlébotome femelle hématophage prélève le parasite par piqûre d’un chien réservoir. Après multiplication et transformation du parasite dans son tube digestif, il le transmet par piqûre à un autre chien. Aux États-Unis, des cas ont prouvé la transmission de chien à chien de Leishmania infantum avec contamination directe par le sang et les sécrétions ainsi que par voie transplacentaire d'une chienne infectée à ses chiots.
Le diagnostic est confirmé par la découverte du protozoaire dans un prélèvement fait dans le fond des lésions cutanées ou par la sérologie. Il est toujours possible de rechercher les parasites au microscope, par exemple, dans un produit de ponction ganglionnaire. En pratique, les tests sérologiques sont les plus couramment utilisés. Les plus pratiques reposent sur les méthodes ELISA ou les bandelettes immunochromatographiques sensibilisées par un antigène. Ces dernières sont facilement utilisables sur le terrain ou en cabinet vétérinaire. De plus, leur positivité est très souvent corrélée avec une leishmaniose-maladie et non à un portage asymptomatique. Les diverses méthodes PCR actuellement proposées permettent la détection de l'ADN de Leishmania. Leurs sensibilités différent et la positivité est parfois en rapport avec un portage asymptomatique d’où l’importance de pratiquer des PCR en temps réel avec quantification de la charge parasitaire.
Le pronostic est toujours réservé car le traitement est long, parfois mal supporté par le chien et pas toujours efficace. Le taux d'anticorps anti-leishmania apporte une notion pronostic intéressante pour le vétérinaire : plus ce taux est élevé, plus le pronostic est mauvais etce, d'autant plus que les symptômes sont développés.
Le traitement le plus couramment utilisé est l’association d’une injection quotidienne de Glucantime par voie intramusculaire pendant un mois associé à l'allopurinol en comprimés donnés tous les jours pendant toute la vie. L’efficacité dépend de la bonne observance, du stade clinique de l’animal au début du traitement, de l’apparition ou non de complications (rénales en particulier) et – plus rarement – de la résistance de la souche aux médicaments. Une rémission clinique est tout à fait possible mais ne suffit pas à arrêter le traitement sans lequel un risque de rechute est important.
Un traitement oral à base de miltéfosine, lancé par les laboratoires Virbac en 2007 et bénéficiant d’une AMM vétérinaire, est disponible dans les pays d’Europe du Sud, mais pas en France. D’autres alternatives thérapeutiques comme le Marbocyl ou l’Amphotéricine B peuvent être proposées.
Prévention et vaccins
Il y a de profondes différences dans les mécanismes immunitaires et génétiques qui interviennent dans la prédisposition ou la résistance au développement de la maladie chez le chien. Les colliers à base de deltaméthrine portés par le chien ont démontré une efficacité certaine. Le phlébotome étant le plus actif du crépuscule à l'aube, garder un chien à l'intérieur de l’habitation la nuit permettra de minimiser l'exposition. Le premier vaccin contre la leishmaniose canine du nom de Leshmune a été commercialisé au Brésil en 2003. En , le premier vaccin contre la leishmaniose canine en Europe a été commercialisé par les laboratoires Virbac.
Nécessitant un protocole de trois primoinjections suivies d'un rappel annuel, celui-ci n'empêche pas la contamination mais renforce l'organisme du chien. Un animal vacciné a quatre fois moins de risque de développer la maladie qu'un non vacciné.
Chez le chat
Le chat est un animal moins sensible à la leishmaniose en raison d'une réponse immunitaire plus solide. La symptomatologie est essentiellement cutanée et similaire, sur le plan lésionnel, au chien. La leishmaniose chez le chat n'en demeure pas moins une pathologie à surveiller car les experts tendent à s'accorder sur l'émergence possible de cette maladie chez les félins avec un risque de sous-estimation réel des cas.
Voir aussi
Article connexe
Bibliographie
- (en) Elisabeth Lindgren, Torsten J. Naucke (2006). Leishmaniasis: influences of climate and climate change, epidemiology, ecology and adaptation measures. In : Menne B., Ebi K. Climate change and adaptation strategies for human health, Springer, Darmstadt, p. 131-156.
- (en) Robert Killick-Kendrick, Mireille Killick-Kendrick, M.-C. Focheux, J. Dereure, MP Puech & M C Cadiergues (1997). Protection of dogs from bites of phlebotomine sandflies by Scalibor ProtectorBands for control of canine leishmaniasis. Med Vet Entomol 11, 105-111.
- (en) Robert Killick-Kendrick, Jean-Antoine Rioux, MW Guy, TJ Wilkes, FM Guy, I. Davidson, R. Knechtli, RD Ward, E. Gulivard, J. Perieres, H. Dubois, (1984). Ecology of leishmaniasis in the south of France. 20. Dispersal of Phlebotomus ariasis Tonnoir, 1921 as a factor in the spread of visceral leishmaniasis in the Cevennes. Ann. Parasitol. Hum. Comp., 59: 555-572.




