GCaMP
GCaMP est un marqueur calcique encodé génétiquement (GECI), initialement développé par Junichi Nakai. GCaMP résulte de l'assemblage d'une protéine fluorescente verte (EGFP), d'une protéine modulée par le calcium (calmoduline) et de M13, un peptide d'une kinase de la chaîne légère régulatrice de la myosine II. L'intérêt du GECI est qu'il peut être étudié dans des organismes vivants. La première souris transgénique exprimant GCaMP a été créée en 2004 et GCaMP a par la suite été amélioré en GCaMP2, stable à température corporelle des mammifères, permettant les premiers enregistrements de données in vivo chez les mammifères en utilisant un GECI. Successivement, les GCaMPs ont été modifiés en GCaMP3 et GCaMP-X, améliorant ainsi l'amplitude de leur signal fluorescent et améliorant leur rapport signal sur bruit. Des GECIs à fluorescence rouge, nommés "RCaMPs", ont également été développés pour permettre l'analyse d'images multi-spectrales.
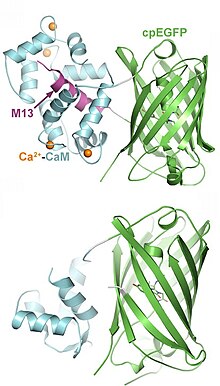
La EGFP est modifiée par permutation circulaire de telle sorte que ses domaines N- et C-terminaux sont fusionnés créant ainsi un nouveau domaine terminal au centre de la protéine. Sont ensuite fusionnés à ce nouveau domaine terminal la calmoduline et le M13. La calmoduline est une protéine capable de s'associer à quatre ions calcium grâce à ses motifs main EF. Lorsqu'elle est au contact du calcium, la calmoduline subit un changement conformationnel démasquant son site de fixation aux chaînes hélicoïdales de ses protéines cibles telles que le M13. En l'absence de calcium, la protéine EGFP circularisée n'est pas fluorescente à cause de la protonation de son chromophore par l'eau rendant son absorption aux longueurs d'onde excitatrices moindre. Le changement conformationel dû à la fixation du calcium à la calmoduline empêche cette action de l'eau, permet la déprotonation du chromophore et une fluorescence vive.