
Ferroquine
| Ferroquine | |
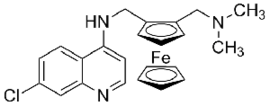
| |
| Identification | |
|---|---|
| DCI | Ferroquine |
| Nom UICPA | 7-chloro-N-(2-((dimethylamino)methyl)ferrocenyl)quinolin-4-amine |
| No CAS | 185055-67-8 |
| NoECHA | 100.208.008 |
| Apparence | solide jaune cristallin |
| Propriétés chimiques | |
| Formule |
C23H24ClFeN3 [Isomères] |
| Masse molaire | 433,755 ± 0,025 g/mol C 63,69 %, H 5,58 %, Cl 8,17 %, Fe 12,87 %, N 9,69 %, |
| pKa | 7,00 et 8,45 |
| Propriétés physiques | |
| T° fusion | 193 à 195 °C |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antipaludique |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
La ferroquine (FQ, SSR97193) est début 2013 le candidat médicament organométallique le plus avancé dans son développement industriel et en étude clinique comme traitement du paludisme non compliqué.
Historique
La ferroquine est l’illustration du concept de metallo-drug développé par le professeur Gérard Jaouen. Ceux ci sont de trois catégories. L’une dont l’archétype est le cas platine souffre de toxicité sévère. La seconde vise a diminuer la toxicité par le jeu d’échanges pertinents de métaux et de ligands. La troisième vise a modifier par un organométallique une molécule thérapeutique connue, mais d’efficacité décroissante de façon a la repotensialiser. La ferroquine inventée par le Pr Jacques Brocard, le Dr Lucien Maciejewski et le Pr Jacques Lebibi entre dans cette catégorie. Conçue en 1994 à l'université Lille 1, la ferroquine résulte de l’incorporation d’un motif ferrocénique dans le squelette de base de la chloroquine (CQ), l’antipaludéen le plus utilisé et qui connaît de graves problèmes de résistance. La FQ a été validée sur le plan de la pharmacologie spécifique d’abord à l'unité INSERM 42 à Villeneuve d’Ascq, puis à l'unité INSERM 547, à l’Institut Pasteur de Lille. Des essais effectués au Gabon, au Sénégal, au Cambodge, en Thaïlande et à Madagascar ont montré la remarquable activité de la FQ sur tous les isolats de terrain. La ferroquine (nom de code SSR97193) est entrée en développement clinique de phase I chez Sanofi-Aventis en 2003. Conformément aux réglementations de l’Organisation mondiale de la santé (OMS), afin de limiter l’apparition des résistances, il a été choisi d’utiliser la ferroquine en bithérapie avec l’artésunate (ARS, un analogue semi-synthétique de l’artémisinine, antipaludéen issu de la pharmacopée chinoise). Le développement de la ferroquine s’est poursuivi et les essais cliniques de phase II chez l’homme adulte ont débuté fin 2007. En 2011, à la suite de la décision de la Sanofi de modifier la stratégie de développement de la FQ, l’association FQ/ARS a été abandonnée au profit de la combinaison FQ/OZ439 pour le traitement du paludisme en partenariat avec la société Medicines for Malaria Venture (MMV). Une « Investigational New Drug » (IND) a été déposée auprès de la Food and Drug Administration (FDA) en et l’étude de phase IIb planifiée pour fin 2014.
Une nouvelle utilisation thérapeutique de la FQ a été découverte : la ferroquine inhibe l'infection du virus de l'hépatite C (HCV) de cellules de lignées de carcinome hépatocellulaire, en agissant sur un stade précoce du cycle viral. Ces travaux sont couverts par un brevet en France () avec un passage en extension PCT en .
Propriété
- logD(7,4) = 2,95
- logD(5,2) = -0,77
Mode d'action
Un parallèle entre les mécanismes d’action de la chloroquine et de la ferroquine : ces molécules exerceraient leur action en interférant avec le processus de détoxification de l’hème par le parasite. Lors de la phase érythrocytaire, le parasite se développe à l’intérieur des globules rouges (GR) humains. Il dégrade alors l’hémoglobine (constituant majeur des GR) non seulement pour se fournir en acides aminés, mais aussi pour se faire de la place afin de favoriser sa croissance et sa division. L’hème libéré lors de ce processus est dangereux pour le parasite à cause de son pouvoir oxydant puissant. Plasmodium est capable de provoquer une biominéralisation de l’hème en hémozoïne, dont le dimère inactif est le résultat de ce processus de détoxification. En utilisant la nano-imagerie chimique par nanosonde synchrotron, la distribution subcellulaire de la ferroquine et de la chloroquine dans les hématies parasitées a été étudiée. La nano-imagerie chimique révèle que la ferroquine s’accumule dans la vacuole digestive du parasite à proximité de l’hémozoïne. La quantification de la ferroquine par cette technique a été validée par l'utilisation conjointe d'un traceur à base de ruthénium et d'études ICP-MS. Une triple approche couplant des méthodes biophysiques (RMN, RPE, voltamétrie cyclique), biochimiques et biologiques (association à l’hématine, test d’inhibition de la formation de la β-hématine, ultrastructure) et de modélisation moléculaire (calculs quantiques, DFT et docking), a permis d’établir l’action inhibitrice de la ferroquine sur l’hémozoïne à un niveau moléculaire. De façon tout à fait originale, la ferroquine agit également, via la chimie du ferrocène, en générant (directement ou indirectement) des radicaux libres. Cette production serait létale pour le parasite, ces radicaux étant connus pour engendrer de graves dommages sur toutes les molécules biologiques, en particulier la peroxydation extensive des acides gras polyinsaturés présents dans les membranes. Il a été également suggéré que la présence du ferrocène permettait une localisation préférentielle au niveau du site de nucléation de l’hémozoïne, inhibant ainsi la formation de l’hémozoïne. En étudiant l’effet de la ferroquine sur différentes étapes du cycle érythrocytaire du parasite, les chercheurs ont montré que la ferroquine inhibe également une étape clé de la propagation du parasite : la formation des germes infectieux, les mérozoïtes, et l’invasion des érythrocytes. Une très importante différence entre les mécanismes de résistance potentielle à la ferroquine et à la chloroquine a été reporté. Au laboratoire, il n’a pas été possible d’obtenir un clone résistant à la ferroquine fixé génétiquement alors que cette induction est possible avec la majorité des antipaludéens. De plus, la ferroquine n’interagit pas avec les protéines de transport connues pour conférer des résistances aux principaux antipaludéens.