
Dichloroisocyanurate de sodium
| Dichloroisocyanurate de sodium | |||
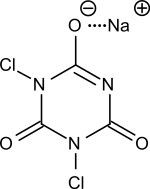
| |||
| Structure chimique du dichloroisocyanurate de sodium | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA |
sodium 3,5-dichloro-2,4,6- trioxo-1,3,5-triazinan-1-ide |
||
| No CAS | 2893-78-9 | ||
| NoECHA | 100.018.880 | ||
| No CE | 220-767-7 | ||
| PubChem | 517121 | ||
| SMILES | |||
| InChI |
InChI : vue 3D InChI=1/C3HCl2N3O3.Na/c4-7-1(9)6-2(10)8(5)3(7)11;/h(H,6,9,10);/q;+1/p-1/fC3Cl2N3O3.Na/q-1;m |
||
| Apparence | poudre cristalline blanche, d'odeur âcre. | ||
| Propriétés chimiques | |||
| Formule |
C3Cl2N3NaO3 [Isomères] |
||
| Masse molaire | 219,946 ± 0,008 g/mol C 16,38 %, Cl 32,24 %, N 19,1 %, Na 10,45 %, O 21,82 %, |
||
| Propriétés physiques | |||
| T° fusion | Se décompose au-dessous du point de fusion à 230 °C | ||
| Solubilité | dans l'eau : 250 g·L-1 | ||
| Masse volumique | >1 | ||
| Pression de vapeur saturante | <0,000 05 mmHg | ||
| Précautions | |||
| SGH | |||
|
H272, H302, H319, H335, H410 et EUH031
H272 : Peut aggraver un incendie ; comburant H302 : Nocif en cas d'ingestion H319 : Provoque une sévère irritation des yeux H335 : Peut irriter les voies respiratoires H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme EUH031 : Au contact d'un acide, dégage un gaz toxique |
|||
| SIMDUT | |||
  C, D1B, D2B,
C : Matière comburante cause ou favorise la combustion d'une autre matière en dégageant une autre substance comburante D1B : Matière toxique ayant des effets immédiats graves Létalité aiguë : CL50 inhalation/4 heures (rat) < 847,5 mg·m-3 D2B : Matière toxique ayant d'autres effets toxiques Irritation des yeux chez l'animal; Irritation de la peau chez l'animal Divulgation à 1,0% selon la liste de divulgation des ingrédients |
|||
| NFPA 704 | |||
| Transport | |||
Code Kemler : 50 : matière comburante (favorise l'incendie) Numéro ONU : 2465 : ACIDE DICHLOROISOCYANURIQUE SEC ; ou SELS DE L’ACIDE DICHLOROISOCYANURIQUE (à l’exception des sels de sodium dihydratés) Classe : 5.1 Étiquette :  5.1 : Matières comburantes Emballage : Groupe d'emballage II : matières moyennement dangereuses ; |
|||
| Inhalation | Toux. Mal de gorge, œdème pulmonaire lésionnel. | ||
| Peau | Rougeur. Brûlures cutanées. Douleur. |
||
| Yeux | Rougeur. Douleur. Perte de la vue. Brûlures profondes graves. |
||
| Ingestion | Sensation de brûlure. Mal de gorge. | ||
| Écotoxicologie | |||
| CL50 | 0.27 à 1,17 mg·L-1 (rats) | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
|
modifier |
|||
Le dichloroisocyanurate de sodium (ou DCCNa) est une source stable de chlore libre.
Il est utilisé comme désinfectant, biocide antibactérien, anti-algue et désodorisant industriel.
Il constitue le chlore choc utilisé comme biocide pour la désinfection de l'eau des piscines. (Le chlore lent correspond à l'acide trichloroisocyanurique).
C'est un sel de sodium de l'acide dichloroisocyanurique, soluble dans l'eau.
De couleur blanche, il est proposé en granules, poudre ou pastilles de 20 g. Ce composé hétérocyclique dérive de la triazine.
Il réagit avec l'eau, l'urée, l'ammoniac, les agents réducteurs et les bases fortes.
Dans l'eau, il se décompose en acide hypochloreux HOCl (un puissant biocide qui se décompose lui-même en partie en ion hypochlorite ClO− faible biocide et fort oxydant, agent actif de l'eau de Javel, qui est elle-même de l'hypochlorite de sodium NaClO en solution aqueuse) et en cyanurate de sodium, qui joue un rôle de stabilisant (se décomposant à son tour en partie en acide cyanurique (CNOH)3 ) en protégeant l'acide hypochloreux HOCl et l'ion hypochlorite ClO− d'une décomposition par les ultraviolets.
- C3Cl2N3O3Na + 2·H2O → C3H2N3O3Na + 2HOCl
- HOCl
ClO− + H+
Il n'a pas d'effet significatif sur le pH de l'eau. Il faut privilégier un pH de l'ordre de 7.4 (7.2-7.5) favorable à la formation de l'acide hypochloreux. Par exemple, avec un pH de 8.2, il faudrait 2 mg·L-1 pour avoir le même effet bactéricide que 0,7 mg·L-1 à pH = 7.4.

Sécurité
Ce produit est toxique par ingestion ou par inhalation des gaz qu'il produit et donc à maintenir hors de portée des enfants. Il doit être impérativement stocké dans des locaux bien ventilés, dans des contenants hermétiques, à l'abri de l'humidité et de toute source de chaleur ou d'ignition, et éloigné des aliments et des produits alimentaires et des matières incompatibles.
Pour les conditions de stockage et d'utilisation, se reporter à la Circulaire DGS/SD 7 A/DRT/CT 4 n° 2003-47 du 30 janvier 2003 relative aux risques d'incendie ou d'explosion lors du stockage et/ou de l'utilisation de produits de traitement des eaux de piscine.
- en cas d'ingestion : Rincer la bouche. NE PAS faire vomir. Mettre au repos. Consulter un médecin.
- en cas de contact avec les yeux : Rincer d'abord abondamment à l'eau pendant plusieurs minutes (retirer si possible les lentilles de contact), puis consulter un médecin.
- en cas de contact avec la peau : Retirer les vêtements contaminés. Rincer la peau abondamment à l'eau ou prendre une douche. Consulter un médecin.
Voir aussi
Bibliographie
- Bloomfield S.F & Uso E.E (1985) The antibacterial properties of sodium hypochlorite and sodium dichloroisocyanurate as hospital disinfectants. Journal of Hospital Infection, 6(1), 20-30|résumé.
- Bloomfield S.F & Arthur M (1992) Interaction of Bacillus subtilis spores with sodium hypochlorite, sodium dichloroisocyanurate and chloramine‐T. Journal of Applied Microbiology, 72(2), 166-172|résumé.
- Clase T & Edmondson P (2006) Sodium dichloroisocyanurate (NaDCC) tablets as an alternative to sodium hypochlorite for the routine treatment of drinking water at the household level. International journal of hygiene and environmental health, 209(2), 173-181.
- Coates D (1988) Comparison of sodium hypochlorite and sodium dichloroisocyanurate disinfectants: neutralization by serum. Journal of Hospital Infection, 11(1), 60-67|résumé
- Coates D (1996) Sporicidal activity of sodium dichloroisocyanurate, peroxygen and glutaraldehyde disinfectants against Bacillus subtilis. Journal of Hospital Infection, 32(4), 283-294|résumé.
- Heling I, Rotstein I, Dinur T, Szwec-Levine Y & Steinberg D (2001) Bactericidal and cytotoxic effects of sodium hypochlorite and sodium dichloroisocyanurate solutions in vitro. Journal of endodontics, 27(4), 278-280|



