
Dapagliflozine
| Dapagliflozine | |
| |
| Identification | |
|---|---|
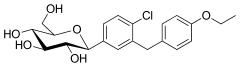
| Nom systématique | (2S,3R,4R,5S,6R)-2-[4-chloro-3-[(4-éthoxyphényl)méthyl]phényl]-6-(hydroxyméthyl)oxane-3,4,5-triol |
| No CAS | 461432-26-8 |
| NoECHA | 100.167.331 |
| Code ATC | A10BK01 |
| DrugBank | DB06292 |
| PubChem | 9887712 |
| SMILES | |
| InChI |
InChI : vue 3D InChI=1S/C21H25ClO6/c1-2-27-15-6-3-12(4-7-15)9-14-10-13(5-8-16(14)22)21-20(26)19(25)18(24)17(11-23)28-21/h3-8,10,17-21,23-26H,2,9,11H2,1H3/t17-,18-,19+,20-,21+/m1/s1 InChIKey : JVHXJTBJCFBINQ-ADAARDCZSA-N |
| Propriétés chimiques | |
| Formule |
C21H25ClO6 |
| Masse molaire | 408,873 ± 0,022 g/mol C 61,69 %, H 6,16 %, Cl 8,67 %, O 23,48 %, |
| Propriétés physiques | |
| T° fusion | 65 °C |
| T° ébullition | 609 °C |
| Précautions | |
| SGH | |
|
H302, H318, H319, H360, H362, H372, P201, P202, P260, P263, P264, P280, P281, P330, P301+P312, P305+P351+P338, P308+P313, P337+P313, P405 et P501
H302 : Nocif en cas d'ingestion H318 : Provoque des lésions oculaires graves H319 : Provoque une sévère irritation des yeux H360 : Peut nuire à la fertilité ou au fœtus (indiquer l'effet s'il est connu)(indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H362 : Peut être nocif pour les bébés nourris au lait maternel H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) P201 : Se procurer les instructions avant utilisation. P202 : Ne pas manipuler avant d’avoir lu et compris toutes les précautions de sécurité. P260 : Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P263 : Éviter tout contact avec la substance au cours de la grossesse/pendant l’allaitement. P264 : Se laver … soigneusement après manipulation. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P281 : Utiliser l’équipement de protection individuel requis. P330 : Rincer la bouche. P301+P312 : En cas d'ingestion : appeler un CENTRE ANTIPOISON ou un médecin en cas de malaise. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P308+P313 : En cas d’exposition prouvée ou suspectée : consulter un médecin. P337+P313 : Si l’irritation oculaire persiste : consulter un médecin. P405 : Garder sous clef. P501 : Éliminer le contenu/récipient dans … |
|
| Écotoxicologie | |
| LogP | 2,7 |
| Données pharmacocinétiques | |
| Biodisponibilité | 78% |
| Liaison protéique | 91% |
| Demi-vie d’élim. | 13,8 h |
| Excrétion |
urine (75,2%), fécès (21%) |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
La dapagliflozine est une molécule de la classe des gliflozines. Développée initialement comme un médicament antidiabétique, elle est aussi utilisée en Europe et aux États-Unis depuis fin 2020 dans l'insuffisance cardiaque et dans l'insuffisance rénale. Elle est commercialisée en France sous le nom de Forxiga par le groupe AstraZeneca.
Dans le diabète
Le dapagliflozine est utilisé avec un régime et des exercices physiques pour maitriser la glycémie chez les diabétiques de type 2 et pour réduire le risque d'hospitalisation pour crises cardiaques chez les adultes diabétiques de type 2 et les patients sujets de maladies cardiovasculaires et d'autres facteurs de risques.
En 2012, le dapagliflozine a été approuvé par l'Agence européenne des médicaments (EMA) alors qu'aux États-Unis, il a été refusé par la FDA en 2012 en raison de doutes d'effets secondaires mais autorisé par la suite pour le diabète en 2014 puis étendu pour l'insuffisance rénale et les problèmes cardiaques en 2020.
Dans l'Union Européenne, la dapagliflozine est indiqué pour les adultes :
- pour le traitement du diabète de type 2 insuffisamment contrôlé en complément d'un régime et de l'exercice :
- en monothérapie quand la metformine est inappropriée pour cause d'intolérance
- en plus d'autres médicaments pour le traitement du diabète de type 2
- pour le traitement du diabète de type 1 insuffisamment contrôlé en complément de l'insuline chez les patients ayant un IMC ≥ 27 kg/m2, lorsque l'insuline seule ne permet pas un contrôle glycémique adéquat malgré une insulinothérapie optimale
- pour le traitement de l'insuffisance cardiaque à fraction d'éjection réduite.
Dans l'insuffisance cardiaque
Il permet la diminution du risque d'aggravation et de mortalité chez les patients porteurs d'une insuffisance cardiaque, même en l'absence de diabète. Les symptômes sont également améliorés avec, notamment, une amélioration de la qualité de vie, et une diminution des troubles du rythme ventriculaire graves. Ces effets sont retrouvés dans toutes les tranches d'âge. Des données similaires sont retrouvées en cas de fraction d'éjection préservée ou peu diminuée.
Il diminue également le risque de survenue d'une fibrillation atriale ou d'un flutter.
Le le Comité des médicaments à usage humain de l’EMA adopte un avis positif recommandant l’extension d’indication de la dapagliflozine dans l’insuffisance cardiaque chronique symptomatique avec une fraction d'éjection réduite. L’autorisation de mise sur le marché (AMM) repose sur les résultats de l’étude de phase 3 internationale DAPA-HF (4 742 patients dans 410 sites sur 20 pays).
Dans l'insuffisance rénale
En avril 2021, la FDA a élargi l'indication de la dapagliflozine pour réduire le risque de dysfonction rénale, d'insuffisance rénale, de décès cardiovasculaire et d'hospitalisation pour insuffisance cardiaque chez les adultes atteints d'insuffisance rénale chronique qui présentent un risque de progression de la maladie. L'efficacité de la dapagliflozine pour améliorer les bilans rénaux et réduire la mortalité cardiovasculaire chez les personnes atteintes d'insuffisance rénale chronique a été confirmée grâce à une étude multicentrique en double aveugle portant sur 4304 participants.
Mécanisme d'action
La dapagliflozine inhibe le cotransporteur sodium-glucose 2 (SGLT2) qui est principalement situé dans le tubule proximal du néphron. Le SGLT2 facilite 90 % de la résorption du glucose dans les reins, et son inhibition permet donc l'excrétion du glucose dans l'urine. Cette excrétion permet un meilleur contrôle de la glycémie et potentiellement une perte de poids chez les patients atteints de diabète sucré de type 2.
Métabolisme
La dapagliflozine est principalement glucuronidée pour devenir un métabolite 3-O-glucuronide inactif (60,7%). La dapagliflozine produit aussi d'autres métabolite glucoronidés mineurs (5,4%), un métabolite déséthylé (< 5%), et un métabolite hydroxyé (< 5%). Le métabolisme de la dapagliflozine est médié par les cytochromes P450 CYP1A1, CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP3A4 et les uridine diphosphate glucuronyltransférases UGT1A9, UGT2B4 et UGT2B72. La glucuronidation du principal métabolite est médiée par l'UGT1A9.
Effets secondaires
Étant donné que la dapagliflozine entraîne une glycosurie importante (parfois jusqu'à environ 70 grammes par jour), elle peut entraîner une perte de poids rapide et de la fatigue. Le glucose agit comme un diurétique osmotique qui peut conduire à la déshydratation. L'augmentation de la quantité de glucose dans les urines peut également aggraver les infections déjà associées au diabète, en particulier les infections des voies urinaires et la candidose.
À la suite de la remontée de cas de pharmacovigilance, un risque fréquent d'acidocétose diabétique chez les diabétiques de type 1 et un risque rare mais sérieux de gangrène de Fournier (fasciite nécrosante périnéale) en association avec la prise de dapagliflozine ont été démontrés en 2016 et 2018 par l'Agence européenne des médicaments (EMA). Dans un courrier, l’Agence nationale de sécurité du médicament et des produits de santé, comme l’avait fait avant elle la Food and Drug Administration (FDA), prévient les professionnels de santé de ces risques afin de pouvoir en informer les patients(ANSM).


