
Chlorure de cadmium
| Chlorure de cadmium | |||

| |||
 | |||
| __ Cd2+ __ Cl− | |||
| Identification | |||
|---|---|---|---|
| No CAS |
10108-64-2 (anhydre) 34330-64-8 (monohydrate) 7790-78-5 (hémipentahydrate) 34330-64-8 (hydrate) |
||
| NoECHA | 100.030.256 | ||
| No CE | 233-296-7 | ||
| No RTECS | EV0175000 | ||
| PubChem | 24947 | ||
| SMILES | |||
| InChI |
|
||
| Apparence | cristaux incolores, solide blanc en masse, hygroscopique, inodore | ||
| Propriétés chimiques | |||
| Formule | CdCl2CdCl2 | ||
| Masse molaire | 183,317 ± 0,012 g/mol Cd 61,32 %, Cl 38,68 %, |
||
| Propriétés physiques | |||
| T° fusion | 568 °C | ||
| T° ébullition | 960 °C | ||
| Solubilité | 1,4 kg·l-1 (eau, 20 °C) | ||
| Masse volumique | 4,05 g·cm-3 | ||
| Pression de vapeur saturante | 13 hPa (656 °C) | ||
| Cristallographie | |||
| Système cristallin | trigonal | ||
| Précautions | |||
| SGH | |||
|
H301, H330, H340, H350, H360FD, H372, H410, P201, P260, P273, P284, P310 et P301+P310
H301 : Toxique en cas d'ingestion H330 : Mortel par inhalation H340 : Peut induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H350 : Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H360FD : Peut nuire à la fertilité. Peut nuire au fœtus. H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme P201 : Se procurer les instructions avant utilisation. P260 : Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P273 : Éviter le rejet dans l’environnement. P284 : Porter un équipement de protection respiratoire. P310 : Appeler immédiatement un CENTRE ANTIPOISON ou un médecin. P301+P310 : En cas d'ingestion : appeler immédiatement un CENTRE ANTIPOISON ou un médecin. |
|||
| NFPA 704 | |||
| Transport | |||
Code Kemler : 66 : matière très toxique Numéro ONU : 2570 : COMPOSÉ DU CADMIUM Classe : 6.1 Étiquette :  6.1 : Matières toxiques |
|||
| Classification du CIRC | |||
| Groupe 1 | |||
| Écotoxicologie | |||
| DL50 | 10 mg/kg (grenouille, intramusculaire) 63 mg/kg (cochon d'inde, oral) |
||
| LogP | 5 | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
|
modifier |
|||
Le chlorure de cadmium est un composé chimique inorganique constitué de cadmium et de chlore, de formule CdCl2.
Propriétés physiques et chimiques
C'est un solide blanc anhydre à fins cristaux rhombiques incolores, mais hygroscopique, très soluble dans l'eau et légèrement soluble dans l'éthanol.
Même s'il est considéré comme un solide ionique, ses liaisons Cl-Cd ont un fort caractère covalent. Sa structure cristalline rhomboédrique, constituée de couches ioniques à deux dimensions est une référence pour décrire d'autres structures cristallines.
Le chlorure de cadmium se dissout bien dans l'eau et dans les autres solvants polaires. Dans l'eau sa très grande solubilité s'explique en partie par la formation de complexes ioniques tel que [CdCl4]2−., ce qui donne à CdCl2 un caractère d'acide de Lewis doux :
- CdCl2 + 2 Cl− → [CdCl4]2−
Avec de grands cations, il est possible d'isoler l'ion [CdCl5]3− qui a une structure de bipyramide trigonale.
Il existe aussi le chlorure de cadmium monohydrate (CdCl2.H2O) et hémipentahydrate (CdCl2.5H2O).
Synthèse ou préparation
Le chlorure de cadmium anhydre peut être préparé par réaction entre le dichlore anhydre ou le chlorure d'hydrogène gazeux sur du cadmium métallique chauffé :
- Cd métal + 2 HCl gaz → CdCl2vapeurs condensées en masses cristallines + H2
De l'acide chlorhydrique peut être utilisé pour former du CdCl2 ionisé et hydraté, puis par réaction avec le métal, l'oxyde de cadmium ou le carbonate de cadmium.
- Cd dissous dans HCl, chauffé à évaporation + 2 HCl gaz → CdCl2vapeurs condensées en masses cristallines + H2
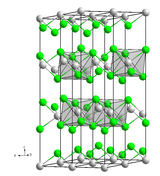
Structure cristalline
Le chlorure de cadmium possède un système trigonal du groupe d'espace 
Cette structure est une structure de référence en cristallographie et sert à décrire un grand nombre de chlorures de métal de transition, notamment le chlorure de manganèse(II), le chlorure de fer(II) ou le chlorure de zinc, mais aussi le chlorure de magnésium, le bromure de zinc et l'iodure de nickel(II).
Les halogénures de cadmium, comme CdCl2, CdBr2 ou CdI2, présentent des lacunes sur leurs sites octaédriques, ce qui explique leur facilité à former des couches minces (très utile pour dévoiler ou utiliser leurs propriétés physico-chimiques).
Utilisation
Le chlorure de cadmium est un absorbeur de sulfure d'hydrogène. Les solutions de chlorure de cadmium absorbent le sulfure d'hydrogène. Il est d'ailleurs utilisé dans la production artificielle de sulfure de cadmium, utilisé comme « jaune de cadmium », un pigment jaune brillant inorganique stable, qui a servi pour les taxis de New-York.
- CdCl2ou autres solutions de sels de cadmium+ H2Sgaz→ CdSpoudre jaune + 2 HCl aqueux
En laboratoire, CdCl2 anhydre peut être utilisé pour la préparation d'organocadmiens de type R2Cd, où R est un aryle ou un alkyle primaire. Ces composés furent utilisés pour la synthèse de cétones à partir de chlorures d'acyle :
- CdCl2 + 2 RMgX → R2Cd + MgCl2 + MgX2
- R2Cd + R'COCl → R'COR + CdCl2
De tels réactifs ont été largement supplantés par les organocuprates beaucoup moins toxiques.
Le chlorure de cadmium peut servir de catalyseur dans la réaction de Biginelli qui produit des 3,4-dihydropyrimidin-2(1H)-ones.
Le chlorure de cadmium est aussi utilisé dans les photocopieurs, en microscopie, en photographie, en teinture et galvanoplastie. Il a été utilisé dans l'impression de cotonnades, type calicot.
Sécurité
Le chlorure de cadmium est une substance très toxique et dangereuse pour l'environnement. Il est cancérogène, mutagène et peut avoir des effets sur la reproduction. Il a un effet toxique aigu puissant et irritant pour les voies respiratoires après inhalation des vapeurs ou d'aérosols. L'intoxication chronique provoque des dommages aux reins, au foie et aux poumons. Une caractéristique visuelle de l'intoxication au cadmium est la formation d'un ourlet jaune sur le collet de la dent due à la présence de composés sulfurés du cadmium.
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Cadmium chloride » (voir la liste des auteurs) et en allemand « Cadmiumchlorid » (voir la liste des auteurs).



