Prévention et dépistage du cancer du col utérin
- Cet article traite uniquement du dépistage pratiqué au niveau du col de l'utérus. Pour d'autres utilisations du terme frottis en médecine, voir l'article Frottis.
Depuis la publication en 1943 de Diagnosis of Uterine Cancer by the Vaginal Smear, le dépistage du cancer du col utérin reposait sur la recherche de modification cellulaire des cellules du col de l'utérus pouvant aboutir à un cancer du col de l'utérus (CCU).
Ces modifications sont le résultat d'une infection persistante par les papillomavirus humains oncogènes (HPV). Cette découverte a modifié les stratégies de prévention et de dépistage du cancer du col de l'utérus : par la mise au point de tests qui prouvent la persistance d'une infection virale avant que celle-ci perturbe l'architecture de la cellule et par le développement de vaccins pour prévenir l'infection à HPV.
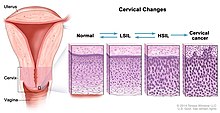
Le cancer du col est l’un des rares cancers pour lequel le stade précurseur (lésion précancéreuse) persiste de nombreuses années avant d’évoluer vers un authentique cancer invasif, ce qui offre un temps amplement suffisant pour le détecter et le traiter.
En 2018, environ 570 000 cas de cancer du col de l'utérus et 311 000 décès dus à la maladie se sont produits dans le monde. Le cancer du col de l'utérus est le quatrième cancer par ordre de fréquence chez les femmes, après le cancer du sein (2,1 millions de cas), le cancer colorectal (0,8 million) et le cancer du poumon (0,7 million). Le cancer du col utérin est un problème de santé publique majeur affectant les femmes d'âge moyen, en particulier dans les pays à revenu bas (revenu national brut par habitant inférieur à 1 026 $) et les pays à revenu intermédiaire (revenu national brut par habitant se situant entre 1 026 $ et 12 475 $).
Papillomavirus et cancer de col de l'utérus
La notion médicale d'une connexion entre le cancer du col et les rapports sexuels est une notion connue depuis plus d'un siècle : depuis qu'un médecin italien avait remarqué que les religieuses n'avaient jamais de cancer de col de l'utérus.
Dans les années 1990 apparurent les premières publications faisant un lien fort entre le papillomaviruset le cancer du col suivi par des publications définissant les types de papillomavirus virus impliqués dans ces cancers.
La survenue d'un cancer du col de l'utérus est le plus souvent le résultat d’un processus se déroulant sur 10-15 ans et en quatre étapes :
- Infection productive initiale par un virus oncogène,
- Infection persistante (virus oncogène toujours détectable après 2 ans),
- Infection transformante ou précancer,
- Cancer invasif.
Rappel anatomique
Le col de l’utérus est entièrement recouvert d’une muqueuse, composée d’un tissu de surface appelé épithélium et d’un tissu conjonctif en profondeur. La frontière entre les deux tissus est appelée membrane basale.
Au niveau de l’endocol, l’épithélium contient des glandes qui produisent un mucus (épithélium glandulaire). L’épithélium glandulaire est constitué d’une seule couche de cellules hautes. Il tapisse le canal endocervical et s’étend vers l’extérieur sur une portion variable de l’exocol.
Au niveau de l’exocol, l’épithélium est semblable à celui de l’épiderme de la peau (épithélium malpighien). Il est constitué d’une couche profonde épaisse recouverte de plusieurs couches de cellules de plus en plus plates se superposant comme des tuiles.
La frontière entre l’épithélium de l’endocol et l’épithélium de l'exocol est appelée la zone de jonction pavimento-cylindrique (JPC) aussi nommée jonction squamo-cylindrique. La localisation de la JPC varie avec l’âge de la femme, son statut hormonal, l’existence d’antécédents de traumatismes provoqués par l’accouchement et l’utilisation ou non d’une contraception orale.
Lorsqu’il est exposé à l’acidité vaginale, l’épithélium cylindrique, plus fragile et qui s’étend à partir du canal cervical en recouvrant la partie externe du col, est progressivement remplacé par un épithélium pavimenteux plus solide. Ce processus physiologique normal de remplacement est appelé métaplasie pavimenteuse ; elle donne naissance à une nouvelle JPC. La région de taille variable se situant entre la JPC initiale et la nouvelle JPC est appelée la zone de remaniement. Les cellules de la zone de remaniement sont particulièrement sensibles à l’infection par le VPH. Et c'est au niveau de cette zone de remaniement que naissent 90 % des cancers du col de l’utérus.
Synonyme
L’épithélium glandulaire et cylindre sont des synonymes et désignent le même épithélium, celui qui se trouve dans l'endocol.
L’épithélium pavimenteux, malphighien et épthélium malpighien sont des synonymes et désignent le même épithélium, celui qui se trouve dans l'exocol.
Infection par papillomavirus et cancer de col de l'utérus
Les papillomavirus humains (HPV) sont des virus à ADN de petite taille, très résistants, qui infectent les épithéliums. L'infection à HPV est l’infection sexuellement transmissible (I.S.T) la plus fréquente dans le monde. Une pénétration n'est pas nécessaire, un contact bucco-génital suffit.
Il existe plusieurs types de HPV classés par numéro. Les HPV responsables de CCU, nommés HPV oncogènes, sont au nombre de 12 (16, 18, 31, 33, 35, 45, 52, 58, 39, 51, 56, 59). L'HPV 68 n'est plus considéré comme oncogène par l'Institut National du Cancer. Le type 16 est la cause d’environ 50 % des cancers du col utérin dans le monde, et les types 16 et 18 représentent ensemble environ 70 % des cancers du col utérin. Le type 16 est un des agents cancérigènes les plus importants de l'être humain.
Les autres types de HPV comme le HPV 6 et 11, responsables de condylome de l'anus ou de la vulve, peuvent aussi entraîner des lésions cervicales de type CIN I ou lésion malpighienne intraépithéliale de bas grade, mais cette lésion régressera toujours et ne se transformera jamais en cancer.
La majorité des femmes et des hommes sexuellement actifs seront infectés par ces virus au cours de leur vie. L'incidence de l'infection augmente très rapidement après le premier rapport sexuel (70 % des femmes sont atteintes un an après leur premier rapport sexuel) puis diminue par acquisition d'une immunité spécifique.
L'infection par les HPV oncogènes est totalement asymptomatique, mais elle sera longue à se guérir spontanément. Il faut attendre deux ans pour que chez 90 % des femmes infectées le virus devienne indétectable. C'est dans les 10 % de femmes dont le virus est toujours détectable après deux ans que va se développer, très lentement, pour certaines d'entre elles, un CCU après un processus de plusieurs années. Le délai entre l'infection par un HPV oncogène et la manifestation d'un CCU invasif est entre 10 et 30 ans.
La présence d'une infection à HPV oncogène est nécessaire pour développer un cancer du col de l'utérus, mais n'est pas suffisante à elle seule. D'autres facteurs favorisent la persistance de l'infection, ou sont des cofacteurs cancérogènes (favorisant le développement d'un CCU) mais modérés en comparaison d'une infection persistante à HPV oncogène.
Les facteurs associés
Trois types de facteurs influencent le risque de cancer du col de l'utérus : le virus, les facteurs endogènes (propres à la personne infectée) et les facteurs exogènes ou environnementaux.
Le virus
Un des facteurs majeurs de risque, une infection à HPV16 est associée à un risque de lésion précancéreuse environ 10 fois supérieur à celui d’autres types également classés comme HPV à haut risque, comme les HPV 51, 56 et 59.
Facteurs endogènes
Les formes familiales, à caractère génétique, du cancer du col de l'utérus sont exceptionnelles (par exemple, le très rare syndrome de Peutz-Jeghers). Toutefois, des variants génétiques de la réponse immunitaire sont probablement impliqués dans la progression du cancer du col (risque selon le type HLA).
L’âge précoce au premier rapport sexuel, un nombre élevé de partenaires sexuels au cours de la vie ainsi que le nombre de partenaires et le fait d’avoir un partenaire ayant de nombreux partenaires, un nombre élevé d’accouchements et la première grossesse à un âge précoce, des antécédents de maladies sexuellement transmissibles (comme l’infection à virus herpes simplex, l’infection à chlamydia, celle à gonorrhoeae), un bas niveau socio-économique, sont des facteurs de risque connus bien avant la découverte du rôle fondamental de l'HPV. Il s'agit cependant de facteurs de risques d'infection à HPV, et non pas de cofacteurs cancérogènes (favorisant la progression de l'infection à HPV vers le cancer du col).
Toutes les perturbations de la réponse immunitaire de la personne infectée augmentent le risque de développer un cancer du col de l'utérus. Ces perturbations peuvent être en rapport avec une infection s'attaquant aux systèmes immunitaires comme le VIH ou par la prise de médicaments immunosuppresseurs utilisés après les greffes d'organe.
Facteurs exogènes
Le Centre international de recherche sur le cancer a classé les produits chimiques, activités, agents physiques, agents biologiques en 5 catégories
- Cancérogène pour l'homme [Groupe 1],
- Probablement cancérogène pour l'homme [Groupe 2A],
- Peut-être cancérogène pour l'homme [Groupe 2B],
- Inclassable [Groupe 3],
- Probablement non cancérogène pour l'homme [Groupe 4].
Tableau résumant les agents cancérogènes publiés dans le Journal of the National Cancer Institute en juillet 2018.
| Cancérogène | Probablement cancérogène | Peut-être cancérogène | Non classifiable | Probablement non cancérogène |
|---|---|---|---|---|
| Contraception estro-progestatifs pendant plus de cinq ans | ||||
| Tabac | ||||
| Infection à IHV | ||||
| Exposition in utero au diéthylstilbestrol | ||||
| HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 | HPV 68 | HPV de 26, 53, 66, 67, 70, 73, 82,30, 34, 69, 85 et 97 |
La contraception orale par estro-progestatifs au long cours (prise pendant plus de cinq ans) est un facteur de risque qui augmente avec la durée d'utilisation. Ce risque diminue après l'arrêt pour revenir au risque des non-utilisatrices au bout de dix ans.
L'Organisation mondiale de la santé (OMS) reconnaît ce risque, mais selon son comité d'experts, c'est le risque le plus faible par rapport aux autres cofacteurs. Les avantages importants de cette méthode très efficace pour prévenir les grossesses non planifiées et non désirées « l’emportent largement sur la probabilité très faible d’une augmentation du risque de cancer du col pouvant résulter de l’utilisation d’un contraceptif oral. Par conséquent, il ne faut pas empêcher ou décourager les femmes d’opter pour une contraception orale. Il faut simplement que ces femmes, comme toutes les autres femmes, bénéficient d’un dépistage du cancer du col ».
Le risque lié au tabagisme est dépendant de la dose et de l'âge (risque accru pour les femmes ayant commencé à fumer jeunes), en ce qui concerne le carcinome épidermoïde du col. Cette association est discutée pour les adénocarcinomes du col.
Les filles de femmes ayant été traitées par le diéthylstilbestrol durant la grossesse présentent un risque plus élevé d'avoir un type rare de CCU, l'adénocarcinome à cellules claires.
Le cancer du col de l'utérus dans le monde
En 2018, environ 570 000 cas de cancer du col de l'utérus et 311 000 décès dus à la maladie se sont produits. Le cancer du col de l'utérus était le quatrième cancer par ordre de fréquence chez les femmes, après le cancer du sein (2,1 millions de cas), le cancer colorectal (0,8 million) et cancer du poumon (0,7 million). L'incidence du cancer du col utérin normalisée selon l'âge était de 13,1 pour 100 000 femmes dans le monde et variait considérablement selon les pays, avec des taux allant de moins de 2 à 75 pour 100 000 femmes. Le cancer du col utérin était la principale cause de décès liés au cancer chez les femmes en Afrique orientale, occidentale, moyenne et australe. L'incidence la plus élevée a été estimée à Eswatini, environ 6,5 % des femmes développant un cancer du col de l'utérus avant l'âge de 75 ans.
Prévention primaire du cancer du col de l’utérus : vaccination
Les résultats d’une méta-analyse sur 60 millions de sujets avec un suivi jusqu'à 8 ans post-vaccination parue en juin 2019 montrent clairement l’impact considérable des programmes de vaccination contre l’HPV sur les infections à HPV, notamment les néoplasies intra épithéliales du col utérin chez les jeunes filles et les femmes.
Prévention secondaire du cancer du col de l’utérus : dépistage cytologique
Le dépistage cytologique a été pendant plus de 80 ans la pierre angulaire du dépistage du cancer du col. Son intérêt est actuellement moindre (du moins dans les pays à ressources financières élevées) par l’apparition du dépistage viral.
Le test de dépistage cytologique, un frottis endocervical aussi appelé test de Papanicolaou, est une analyse morphologique, à l'aide d'un microscope, des cellules du col de l’utérus pour détecter précocement la présence de cellules anormales par un cytologiste. Cette analyse est subjective, s'appuyant sur les compétences du cytologiste qui en effectue l'analyse. Il est réalisé à l'aide du frottis dont il existe deux types : le prélèvement sur lame ou le prélèvement en couche mince.
En France, le dépistage est individuel. Toutes les femmes asymptomatiques, ayant ou ayant eu une activité sexuelle, âgées de 25 à 65 ans, doivent bénéficier d'un frottis tous les 3 ans, après 2 prélèvements négatifs réalisés à un an d'intervalle. Il n'est pas nécessaire d'avancer l'âge de dépistage avant 25 ans, car on trouverait des anomalies légères disparaissant spontanément. Cette couverture à 3 ans a été estimée à 56,7 % des femmes concernées pour les années 2006-2008.
Ce test, qui porte sur l'analyse de cellules du col utérin, n'est pas à confondre avec d'autres frottis, vaginaux, visant à dépister les infections sexuellement transmissibles, comme l’herpès, la syphilis, le HIV, etc. Les résultats peuvent redevenir normaux en cas de cancer invasif : en effet, les cellules les plus superficielles sont souvent complètement nécrosées avec impossibilité de voir les anomalies cellulaires. La subjectivité et l'impossibilité de détecter des cancers avancés font que sa sensibilité est moyenne(53 %) mais sa spécificité est bonne (supérieur à 90 %).
En se souvenant que les altérations de la cellule par le virus oncogène vont se produire des années après l'infection, on comprend que 75 % des femmes infectées par un virus oncogène auront un frottis normal.
Le diagnostic du CCU ne se fait pas par le frottis. Il est uniquement conçu pour alerter le médecin. Le diagnostic se fait par une biopsie du col de l'utérus, le plus souvent au cours d'une colposcopie.
Depuis 2019, l'HAS préconise la recherche en première intention du virus HPV par prélèvement au niveau du col utérin, pour les femmes entre 30 et 65 ans. Uniquement les femmes porteuses de l'HPV se verront réaliser un frottis, sous la forme d'une analyse complémentaire à l'initiative du laboratoire d'analyse.
Réalisation
Techniques
La technique classique (frottis conventionnel avec étalement sur lame) consiste à fixer sur une lame de verre un échantillon de cellules de façon uniforme. La fixation doit être réalisée immédiatement par vaporisation directe d’un agent fixateur sur lame.
La technique en milieu liquide, pour laquelle l’échantillon est mis en suspension dans un flacon contenant la solution de conservation ; les cellules sont ensuite étalées en couche mince après une méthode de filtration ou de centrifugation. Ce frottis en milieu liquide, outre l'analyse morphologique permet le test HPV et le double immuno-marquage p16INK4A/Ki67. La plus grande variété d’examens réalisables à partir d’un frottis sur milieu liquide rend l’utilisation de cette technique préférable en 2020.
Conditions
Quel que soit le type de frottis, sa réalisation est la même, après la pose d'un spéculum et localisation du col, le médecin ou la sage-femme gratte le col de l'utérus avec soit une spatule (lame) ou une petite brosse (couche mince) en fonction du type de frottis. La seule condition impérative est de ramener des cellules appartenant à l'extérieur et à l'intérieur du col, c'est-à-dire des cellules malphigiennes et des cellules glandulaires. La présence de ces deux types cellulaires témoigne que le frottis a bien atteint la zone de jonction séparant les cellules malphigiennes et des cellules glandulaires : c'est la jonction pavimento-cylindrique (JPC). C'est au niveau de cette jonction que naissent 90 % des cancers du col de l'utérus.
Le frottis peut se faire au cours de la grossesse. C'est pour beaucoup de femmes la seule occasion de bénéficier d'un frottis. Par contre, un petit saignement apparaît souvent chez la femme enceinte après le frottis. Un saignement par un frottis, au cours de la grossesse, chez une femme rhésus négatif ne doit pas conduire à l'injection de gamma-globuline anti-D. Le saignement est beaucoup moins gênant pour le cytologiste qui va interpréter le frottis si la technique dite en couche mince est utilisée. C'est une des raisons de l'utilisation plus fréquente de la couche mince.
Résultat
Dépistage des cancers
En cas d'infection
Frottis et œstrogène
Explication des termes retrouvés dans les comptes-rendus
Des règles de bonne pratique en anatomie et cytologie pathologiques ont été publiées par l'Association Française d’Assurance Qualité en Anatomie et Cytologie Pathologiques, notamment les informations indispensables que devrait contenir un compte-rendu
La présence d'une inflammation, souvent signalée dans le compte-rendu par le cytologiste, n'a aucune valeur pronostique pour la survenue d'un CCU. Une inflammation, détectée par la présence de polynucléaire neutrophile, peut être due à de multiples causes : rapport sexuel, fil de stérilet, usage de tampon ou de tout autre dispositif menstruel, introduction de doigt lors de la toilette, etc. L'inflammation n'est pas synonyme d'infection et encore moins d'infection à HPV.
On peut, à l'occasion d'un frottis, faire la découverte fortuite d'infection à trichomonas vaginalis authentique I.S.T.
La présence de filet mycélien ou de perturbation de la flore vaginale, comme la vaginose, est parfois signalée mais ne devrait pas conduire systématiquement à un traitement en l'absence de signes cliniques.
Rappelons que le terme de métaplasie signale la transformation et l'adaptation d'une cellule glandulaire (se trouvant normalement dans l'endocol) en une cellule malphigienne. C'est un mécanisme normal et habituel en biologie.
Le terme métaplasie qui désigne un processus cellulaire normal ne doit pas être confondu avec la terme dysplasie qui désigne une cellule ou un tissu dont l'architecture est modifiée.
Classification
La classification utilisée en France comme dans d'autres pays européens est la classification de 2014 de Bethesda. Cette terminologie est recommandée par la Société Française de Cytologie Clinique, à l’instar de l’ensemble des Sociétés Européennes de Cytologie réunies en Fédération, mais rien n'oblige, en France, un laboratoire à l'utiliser.
Comme un frottis de qualité doit avoir à la fois des cellules malphigiennes, et des cellules glandulaires témoignant que la zone de jonction malphigiennes-glandulaires a été atteinte, la classification décrit à la fois des anomalies des cellules glandulaires et des cellules malphigiennes.
- Anomalies des cellules malphigiennes
- ASC-US : atypies de cellules malpighiennes de signification indéterminée ;
- LSIL : lésion malpighienne intra-épithéliale de bas grade ;
- ASC-H : atypies de cellules malpighiennes ne pouvant exclure une lésion de haut grade ;
- HSIL : lésion malpighienne intra-épithéliale de haut grade (incluant les carcinomes in situ) ;
- Carcinome malpighien.
- Anomalies des cellules glandulaires
- Atypies des cellules cylindriques ;
- Atypies des cellules cylindriques ne pouvant exclure un adénocarcinome ;
- Adénocarcinome in situ ;
- Adénocarcinome.
Lésion malpighienne intra-épithéliale de bas grade
Ce diagnostic signifie qu'il y a des changements précoces dans la taille et la forme des cellules. Les lésions malpighiennes intra-épithéliales de bas grade sont souvent associées au VPH, qui peut également provoquer des verrues génitales. Ces lésions, chez les femmes dont le système immunitaire est intact, disparaissent souvent sans intervention dans les 18 à 24 mois.
ASCUS
La plupart des résultats anomaux seront des ASC-US. ASC-US est l'acronyme anglais signifiant atypies de cellules malpighiennes de signification indéterminée. En clair, le cytologiste est incapable de dire si les anomalies cytologiques qu'il voit au microscope sont en rapport avec une infection à HPV ou pas. D'autres éléments peuvent rendre les cellules anormales, telles que l'irritation, certaines infections, telles qu'une infection à levures, des excroissances, telles que des polypes ou des kystes bénins (pas un cancer), et des changements hormonaux qui surviennent pendant la grossesse ou la ménopause.
Dans ce cas, il faut faire une recherche d'HPV. Cette recherche d'HPV peut se faire sans prélèvement supplémentaire si la technique en couche mince a été utilisée. En cas de frottis par lame, la patiente devra effectuer un deuxième prélèvement. C'est encore un autre avantage de la couche mince. Si la recherche est négative il ne faut plus d'examen complémentaire et rassurer la patiente. Si le résultat est positif, des examens complémentaires s'imposeront.
Cela signifie que certaines cellules ne semblent pas complètement normales, mais il n'est pas clair si les changements sont causés par une infection au VPH. Bien que ces éléments puissent donner un aspect anormal aux cellules cervicales, ils ne sont pas liés au cancer.
Lésion malpighienne intra-épithéliale de haut grade
Les ASC-H : atypies de cellules malpighiennes ne pouvant exclure une lésion de haut grade, HSIL : lésion malpighienne intra-épithéliale de haut grade (incluant les carcinomes in situ) les carcinomes malpighiens ainsi que les atypies des cellules cylindriques ne pouvant exclure un adénocarcinome, adénocarcinome in situ ; les adénocarcinome doivent impérativement faire l'objet d'une biopsie.
Prévention secondaire par inspection visuelle à l'acide acétique
C'est l'outil privilégié dans les pays à bas et moyen revenu, en raison de sa très bonne efficacité, quelquefois jugée supérieure au frottis cytologique, sans préjudice de l'adoption du test PVH si une version de celui-ci d'un coût adapté s'avérait efficace.
L’inspection visuelle à l'acide acétique est un examen du col après imprégnation à l'acide acétique, dilué entre 3 % et 5 % dans les pays où les systèmes de soins le permettent.
Ce test permet de détecter les modifications cellulaires précoces du col de l’utérus, qui deviennent visibles lors d’un examen à l’œil nu après la mise en place d’un spéculum et le badigeonnage du col. Ce test est facilement réalisable pour toutes les femmes entre 30 et 50 ans, car la zone de jonction est facilement visible.
Après application, il faut attendre une minute pour que disparaisse la couleur légèrement blanchâtre prise par les tissus altérés par une ou par des modifications cellulaires physiologiques (métaplasie). En cas d’apparition de modifications acidophiles de couleur blanchâtre sur le col de l’utérus qui ne disparaissent pas après une minute, il existe une forte probabilité que ces modifications soient associées à la présence de lésions précancéreuses ou cancéreuses du col.
Lorsque des modifications présentant ces caractéristiques et des bords nets sont observées dans la zone de remaniement, le résultat du test est considéré positif. Si aucune modification acidophile persistante n’est observée, le résultat du test est considéré négatif.
En 2011, la mise en œuvre d'un dépistage organisé par ce biais était estimée à 0,50 dollar par personne dans les pays à revenu faible ou intermédiaire.
Prévention secondaire : Test-HPV
Aux environs des années 2004, quand la recherche de l'HPV est devenue disponible pour les gynécologues, ce test avait une spécificité très faible, mais aboutissant à une valeur prédictive positive très faible de 20 % : en l'absence d'anomalie cytologique au frottis, le test se trompait dans 80 % des cas, inquiétant inutilement beaucoup de femmes et conduisant à des examens complémentaires inutiles. Par contre sa valeur prédictive négative était excellente. Dans ces conditions, la Sécurité sociale française a refusé le remboursement du test HPV en l'absence d'anomalie cytologique. Le seule indication prise en charge par la S.S. française était la présence atypies de cellules malpighiennes de signification indéterminée ou ASC-US.
La supériorité du test HPV sur le dépistage cytologique a été démontrée par plusieurs études.
Le dépistage à la recherche de ces virus n’est pas recommandé chez les femmes âgées de moins de 30 ans, car si une grande partie d’entre elles présentent bien une infection à HPV, la plupart de ces infections seront éliminées spontanément de leur corps avant l’âge de 30 ans. La réalisation d’un test HPV chez les femmes âgées de moins de 30 ans permettra donc d’identifier un grand nombre de femmes qui présentent une infection à HPV transitoire, ce qui pourra entraîner la réalisation de procédures et de traitements non nécessaires à l’origine d’effets néfastes, d’une anxiété, d’un inconfort et de dépenses inutiles.
Cependant, plus l’âge de la femme avance, plus la détection d’une infection par un VPH à haut risque a des chances de correspondre à une infection à HPV persistante. Une infection à HPV persistante étant à l’origine de presque tous les cas de cancer du col, un test HPV positif chez une femme âgée de plus de 30 ans indique qu’elle peut déjà présenter ou être à risque de développer dans le futur des lésions précancéreuses.
Test HPV dans le dépistage du cancer de l’utérus
Par prélèvement vaginal par un professionnel
Au contraire du prélèvement pour rechercher des anomalies cytologiques, la réalisation d’un test VPH ne requiert pas nécessairement un examen gynécologique ou la visualisation du col de l’utérus. Un professionnel de santé peut prélever un échantillon de cellules en insérant une petite brosse ou un autre dispositif approprié jusqu’au fond du vagin, puis en plaçant cet instrument dans un petit flacon contenant une solution de conservation appropriée.
Le test HPV dans le dépistage du cancer de l'utérus détecte plus de lésions précancéreuses que le frottis cytologique. Il remplace le frottis cytologique dans beaucoup de pays. En France, il est recommandé de faire un test tous les cinq ans après 30 ans, le frottis cytologique conservant sa place avant 30 ans.
Le test HPV a une sensibilité plus élevée pour détecter les lésions CIN 2+ et CIN 3. Comparé au dépistage par cytologie, le dépistage primaire par test HPV permet de diminuer l’incidence des cancers invasifs du col de l’utérus de 60 à 70 %.
Par auto prélèvement
L’échantillon peut aussi être prélevé par la femme elle-même ; il faut alors lui donner la petite brosse et le flacon spécial et lui expliquer comment les utiliser. Cette stratégie permet une mise en œuvre à un coût nettement inférieur pour le service de santé et une diminution des désagréments pour la femme.
Le prélèvement peut être fait par la femme elle-même ; dans ce cas-là en fonction de la technique moléculaire pour détecter le HPV la sensibilité et la spécificité.
Différents types de tests (ADN PCR, amplification du signal de l’ADN, détection de l’ARN messager), de dispositifs d'auto prélèvement vaginal (APV) (brosse, écouvillon, dispositif de lavage, tampon) et milieux de conservation/transport (milieu de conservation cellulaire, milieu virologique, échantillon sec) ont été utilisés sur des APV. Le dépistage primaire par test HPV avec un test validé fondé sur la méthode de PCR est aussi sensible pour la détection des CIN 2+ et CIN 3+ et légèrement moins spécifique sur des APV, comparativement aux échantillons cervicaux, prélevés par des cliniciens. En revanche, les autres tests de détection des HPV-HR présentent de moins bonnes performances diagnostiques lorsqu’ils sont appliqués sur des APV. Les tests fondés sur l’amplification du signal de l’ADN étaient moins spécifiques lorsqu’ils étaient appliqués sur des APV que sur des échantillons prélevés par des cliniciens.
Dans les urines
Le test HPV-HR peut être réalisé sur des urines. Le recueil d’urine peut être plus acceptable du point de vue social et culturel, ou plus confortable pour certaines femmes qui hésitent à effectuer un APV. L’urine peut être recueillie par les femmes lors de consultations médicales ou de visites dans des cliniques, mais les dispositifs de collecte d’urine peuvent également être envoyés à l’adresse des femmes.
Dans ces études, le test HPV-HR sur des urines tendait à être moins sensible mais plus spécifique que le test HPV réalisé sur des prélèvements cervicaux. Cependant, la perte de sensibilité était réduite si on utilisait un dispositif spécial permettant de recueillir le premier jet urinaire.
Pour le moment, le test sur des urines ne peut pas remplacer le prélèvement vaginal.
Différents types de test HPV
Protéine p16/Ki-67
En raison de sa forte sensibilité et sa faible spécificité du test HPV responsable d'une valeur prédictive positive faible (en clair, il va détecter la majorité des femmes porteuses du virus, mais beaucoup de femmes ayant un test positif ne sont pas porteuses du virus), la recherche se focalise sur des marqueurs plus spécifiques. Deux marqueurs sont particulièrement étudiés : la protéine p16 et la protéine Ki-67.
Immuno-marquage p16/Ki67
Double coloration au frottis cytologique p16/Ki67
p16 est un suppresseur de tumeur et Ki-67 est un marqueur cellulaire de la prolifération. La surexpression de p16 et l'expression de Ki-67 dans des situations physiologiques s'excluent mutuellement et ne se produisent pas dans la même cellule épithéliale cervicale. Par conséquent, la co-expression de p16 / Ki-67 implique une dérégulation du cycle cellulaire induit par HR-HPV et la détection de la co-expression de p16 / Ki-67 peut servir de marqueur pour prédire la transformation cellulaire par la papillomavirus oncogène et la présence des lésions épithéliales de haut grade.
Toutes les patientes atteintes d'un cancer du col de l'utérus ont montré une double coloration positive pour P16 / Ki-67. D'autres études ont en outre confirmé que le taux positif de p16 / Ki-67 augmentait considérablement avec la gravité des anomalies cytologiques et histologiques. La sensibilité et la spécificité de la double coloration p16 / Ki-67 pour CIN2 + étaient respectivement de 74,9 % -90,9 % et 72,1 % -95,2 %. Le taux positif de CIN2 + détecté par la double coloration p16 / Ki-67 était de 92,7 %, ce qui était plus sensible que 71,1 % par le génotypage HPV16 / 18 seul. Par rapport à la détection du VPH, la double coloration p16 / Ki-67 a une spécificité plus élevée dans la détection de la CIN2 + et peut réduire considérablement le nombre de patientes référées à la colposcopie, en particulier pour les jeunes femmes présentant un taux élevé d'infection par le VPH.
La co-expression de p16 / Ki-67 peut être détectée avec des anticorps contre p16 et Ki-67. Le signal brun cytoplasme / nucléaire détecte le p16 seul, et le signal nucléaire rouge détecte le Ki-67 seul. Les cellules positives à double coloration p16 / Ki-67 avaient des signaux de cytoplasme brun pour l'expression de p16, et les signaux nucléaires rouge foncé à brun rouge reflétaient la colocalisation de p16 et Ki-67 dans la même cellule.
Résultat
Le test HPV devrait désigner la détection des acides nucléiques des génotypes de papillomavirus humains oncogènes et non les infections à HPV en elles-mêmes. Il ne doit pas être considéré comme positif s'il y a uniquement des virus non oncogènes. Si une infection à VPH est bien un précurseur nécessaire pour l’apparition d’un cancer du col de l’utérus, un test VPH positif ne permet pas de confirmer que la femme présente une lésion précancéreuse. En cas de résultat positif, le laboratoire n'est pas obligé de préciser les types des virus oncogènes détectés, car cela n'a aucune incidence dans le traitement.
Diagnostic des lésions précancéreuses
La colposcopie est la pierre angulaire de la stratégie de diagnostic des lésions précancéreuses après le test de dépistage. Des critères minimums de qualité doivent être respectés afin d'améliorer la qualité de la prévention du cancer du col.
Mais la variabilité de cet examen est grande par le même observateur et entre les observateurs.
En France, une charte de qualité élaborée par la Société Française de Colposcopie et de Pathologie Cervico-Vaginale définit les critères suivants : une formation diplômante à la colposcopie, une formation postuniversitaire régulière et une pratique d'au moins 50 nouvelles colposcopies.
Colposcopie
La colposcopie consiste à examiner notamment le col et le vagin au moyen d'un appareil optique grossissant et d’une puissante source de lumière, ce qui permet d’analyser les caractéristiques de la couche épithéliale (surface) et des vaisseaux sanguins avoisinants. Elle doit préciser le niveau de la ligne de jonction pavimento-cylindrique si elle est vue est entièrement localisé en position exo-cervicale (ZT1), si elle est vue mais en certaines parties en position endocervicale (ZT2) ou si la jonction est non vue car en totalité dans l'endocol (ZT3).
Elle permet aux médecins de connaître les lésions à biopsier, seul examen faisant le diagnostic précis des lésions précancéreuses.
Classification des lésions cancéreuses après la biopsie
Les critères histologiques pour un diagnostic de lésion précancéreuse dépendent de l'aspect du noyau, de la présence de mitose anormale et d'une perte de maturation normale de l'épithélium. La CIN est divisée en grade I, II ou III, selon l'étendue de l'aberration de la stratification cellulaire dans l'épithélium. Dans la lésion malpighienne intraépithéliale de bas grade, les cellules des deux tiers supérieurs de l'épithélium, bien que présentant certaines anomalies nucléaires, ont subi une différenciation cytoplasmique. Les cellules du tiers inférieur ne présentent pas de signes de différenciation cytoplasmique ou de maturation normale (perte de polarité des cellules). Les figures mitotiques sont rares et, si elles sont présentes, sont normales. Dans la lésion malpighienne intraépithéliale de haut grade, les changements anormaux de la lésion malpighienne intraépithéliale de bas grade impliquent les deux tiers inférieurs de l'épithélium.
La classification est basée sur l’épaisseur de l’épithélium malphighien anormal : plus les cellules anormales sont retrouvées sur une épaisseur importante à partir du col de l’utérus membrane basale jusque vers la surface, plus le degré de CIN est élevé. L'ancienne classification de l'OMS de 2003, bien que largement utilisée bien qu'une nouvelle classification en 2014. Le terme CIN2+ regroupe les CIN II et CIN III.
Néoplasie intra-épithéliale de grade I ou CIN I
La lésion malpighienne intra-épithéliale de bas grade ne doit pas toujours conduire à des examens complémentaires, car bon nombre de ces lésions malpighiennes guérissent spontanément. Mais cette guérison va prendre plusieurs années, jusqu'à dix ans. La conduite à tenir doit résulter d'une discussion entre la femme et son médecin. Plusieurs paramètres peuvent influencer la conduite à tenir : l'âge, le nombre d'enfants, le désir ou pas d'enfants ou d'autres enfants, la disponibilité de la patiente à se rendre aux consultations...
La lésion intraépithéliale cervicale de bas grade ou CIN1, peut être considérée comme l'expression transitoire d'une infection autolimitée du papillomavirus humain. Une étude rétrospective multicentrique comprenant 434 femmes montre une progression vers une lésion intraépithéliale cervicale de haut grade (CIN2) a été trouvée dans un total de 32 (7,4 %) cas pendant cinq ans de suivi. Un diagnostic histopathologique de HSIL (CIN3) a été trouvé chez quatre patients (0,9 %) et aucun cas de cancer invasif n'a été détecté.
Néoplasie intra-épithéliale de grade II ou CIN II
Néoplasie intra-épithéliale de grade III ou CIN III-CIN2+
Carcinome in situ
Tableau synthétique
| Classification 2003 | Classification 2014 | Caractéristique histologique | Stade l'infection virale | Expression du géne p16 |
|---|---|---|---|---|
| Condylome | Lésion malpighienne intraépithéliale de bas grade | Présence de koilocytes dans les cellules superficielles et intermédiaires de l épithelium malphigien | Infection productive | Non |
| Néoplasie intra-épithéliale de grade I ou CIN I | Lésion malpighienne intraépithéliale de bas grade | Présence de koilocytes dans les cellules superficielles et intermédiaires de l épithelium malphigien | Infection productive | Non |
| Néoplasie intra-épithéliale de grade II ou CIN II | Lésion malpighienne intraépithéliale de haut grade | Altération cellulaire importante par altération chromosomique sur plus de la moitié de l’épaisseur de l épithelium malphigien | Infection productive et transformante | Non |
| Néoplasie intra-épithéliale de grade III ou CIN III | Lésion malpighienne intraépithéliale de haut grade | Altération cellulaire importante par altération chromosomique sur toute de l’épaisseur de l épithelium malphigien | Infection transformante | Oui |
| Carcinome in situ | Carcinome in situ | Altération cellulaire importante par altération chromosomique sur toute de l’épaisseur de l épithelium malphigien | Infection transformante | Oui |
Prévention tertiaire du cancer du col de l’utérus : le traitement des lésions précancéreuses du col de l’utérus
Il n'y a pas de traitement médicamenteux des lésions précancéreuses du col.
Moyens de traitement
Les moyens de traitement des lésions cancéreuses se divisent en deux groupes : les moyens qui détruisent la lésion sans possibilité d'analyse histologique permettant de faire une analyse complète de la lésion précancéreuse, et les moyens qui enlèvent la lésion avec possibilité d'analyse complète de la lésion.
Traitement destructeur
Ces traitements ne nécessitent pas d'hospitalisation.
Cryothérapie
La cryochirurgie est aussi appelée cryoablation, ablation cryochirurgicale ou cryothérapie. Cette intervention a recours au froid extrême (azote liquide ou dioxyde de carbone liquide) pour geler et détruire les cellules ou les tissus anormaux. Un gaz extrêmement froid est appliqué sur la tumeur en le faisant passer par la cryosonde. Le tissu gèle et une boule de glace se forme. Après la congélation du tissu, on réchauffe la cryosonde et la retire de la tumeur. Le tissu gelé dégèle et forme du tissu cicatriciel. Il est possible qu'on doive répéter le cycle gel-dégel.
Cette technique se fait au cabinet.
Laser
On utilise le laser pour détruire la lésion précancéreuse sans l'enlever ; on appelle cette procédure la vaporisation.
Électrocoagulation
C'est une destruction au bistouri électrique.
Traitement enlevant la lésion
Ces techniques nécessitent une hospitalisation ; le plus souvent une hospitalisation de jour. Elle se pratique dans un bloc chirurgical avec une anesthésie locale ou loco-régionale.
Quelle que soit la technique, elle doit impérativement enlever la totalité de la zone jonction. L'examen histologique du cône cervical permet un diagnostic histologique définitif et évalue la distance entre la lésion CIN et le bord de la résection. La résection doit passer à plus de 1 mm de lésion précancéreuse. Ces techniques peuvent entraîner des conséquences sur la fertilité et sur une grossesse. Ces conséquences sont proportionnelles aux dimensions de la pièce de résection. Elles concernent surtout la conisation chirurgicale.
Excision électrochirurgicale à l’anse
Lors de la technique d’excision électrochirurgicale à l’anse, ou LEEP, une boucle de fil métallique mince chauffée à l’électricité permet d'enlever le tissu anormal du col de l’utérus. La boucle (anse) de fil agit comme un scalpel pour enlever le tissu. La LEEP peut aussi être appelée excision à l'anse ou excision à l'anse large de la zone de transformation (LLETZ).
Conisation chirurgicale dite à froid
La colonisation est l'ablation au bistouri d'une partie du col de l'utérus sous forme d'une pièce opératoire conique.
Laser
Le laser (faisceau de lumière intense) est utilisé pour faire des incisions sans saignement dans les tissus. Cette intervention porte aussi le nom de traitement au laser, de photoablation ou de photocoagulation.
Quel traitement ?
Toute lésion CIN II ou CIN III devra être détruite.
Le traitement des lésions malpighiennes intraépithéliales de bas grade
Les lésions histologiques dites de bas grade (CIN 1) représentent l’expression transitoire d’une infection productive qui n’évolue que rarement et lentement (± 5 ans) vers une lésion histologique de haut grade. Ces lésions de bas grade ont une propension importante à régresser spontanément : environ 60 % ont disparu au bout de 3 ans et près de 90 %, après 10 ans de surveillance. Elles sont très fréquentes chez les jeunes femmes.
Le traitement des lésions malpighiennes intraépithéliales de haut grade
Sans expression du gène p16
Avec expression du gène p16
Le traitement des carcinomes in situ
Après le traitement
Un suivi est indispensable en se basant sur des frottis cytologiques et la disparition de l'infection HPV par les tests HPV. Ces tests devront être des tests génotypés, car les femmes atteintes d'un HPV 16 ont plus risque de récidive. Les risques de récidive dépendent aussi de la marge entre la résection et la lésion précancéreuse.
Les politiques de dépistage selon les pays
La politique de prévention et de dépistage du cancer du col de l’utérus varie considérablement en fonction du revenu national brut du pays.
Alors que dans les pays dont le revenu national brut est supérieur à 12 475 $, la prévention et le dépistage du cancer du col de l'utérus sont réalisés par des frottis périodiques et/ou la recherche périodique de HPV, cette politique est impossible dans les pays à revenus intermédiaires ou bas : absence de personnel médical qualifié pour rechercher les anomalies cellulaires, absence de système de soins remboursant les examens, population incapable de payer les frais médicaux. Dans ces pays qui rassemblent la majorité des cancers du col de l'utérus, la primauté est donnée au dépistage par l'acide acétique, et aux traitements des cas de lésions précancéreuses par cryothérapie, qui présentent l'avantage de pouvoir être effectués le même jour.
L'OMS a lancé en 2018 une initiative mondiale pour intensifier les interventions de prévention, de dépistage et de traitement afin d'éliminer le cancer du col utérin en tant que problème de santé publique au XXIe siècle. Cette initiative repose sur 3 axes :
- 90 % des filles vaccinées à l'âge de 15 ans,
- 70 % des femmes dépistées par deux frottis réalisés à 35 et 45 ans,
- 90 % des patientes atteintes porteuses de lésion pré cancéreuses traitées.
Recommandations de l'OMS
En France
Le dépistage par frottis cytologique a historiquement été largement pratiqué à titre individuel, permettant une baisse forte du nombre de cas et de décès par cancer du col.
En France, à partir des années 1990, plusieurs expérimentations locales de dépistage organisé (DOCCU) sont menées dans plusieurs départements. En 2009, un programme de dépistage existe dans quatre départements (Isère, Bas-Rhin, Haut-Rhin et Martinique). En 2010, ce programme est élargi à 9 départements supplémentaires, soit 13 au total, correspondant à 13 % environ de la population féminine française.
En 2017 le Grand Est organise également sa généralisation. La généralisation à l'échelle nationale du « DOCCU » est annoncée en 2018 par le ministère des Solidarités et de la Santé, avec des premières actions prévues en 2019 même si des rapports de 2007 la préconisaient avant la mise en place du remboursement à 65 % du vaccin anti-HPV. En juin 2019 Ameli en parle toujours au futur sur la page pourtant mise à jour en mai 2019.
Parallèlement, avec de bons résultats obtenus par le test HPV, les recommandations publiées en 2019 modifient les outils de dépistage en fonction de l'âge de la patiente. Tandis que le frottis cytologique reste l'outil de référence pour les femmes de moins de 30 ans, le test HPV est recommandé pour les femmes entre 30 et 65 ans.
Une vaccination contre le papillomavirus humain est fortement recommandée chez les très jeunes femmes, puis chez les jeunes hommes, la vaccination ne substituant toutefois pas au dépistage, dont la nécessité est affirmée y compris pour les femmes vaccinées.
En Europe
| Pays | Politique organisé de dépistage | Vaccination | Outil de dépistage | Fréquence de dépistage |
|---|---|---|---|---|
| Albanie | ||||
| Allemagne | ||||
| Andorre | ||||
| Arménie | ||||
| Autriche | ||||
| Azerbaïdjan | ||||
| Belgique | ||||
| Biélorussie | ||||
| Bulgarie | ||||
| Bosnie-Herzégovine | ||||
| Croatie | ||||
| Chypre | ||||
| Danemark | ||||
| Espagne | ||||
| Estonie | ||||
| Finlande | ||||
| France | ||||
| Géorgie | ||||
| Gréce | ||||
| Hongrie | ||||
| Irlande | ||||
| Islande | ||||
| Lettonie | ||||
| Liechtenstein | ||||
| Lituanie | ||||
| Luxembourg | ||||
| Macédoine du Nord | ||||
| Malte | ||||
| Moldavie | ||||
| Monaco | ||||
| Monténégro | ||||
| Norvège | ||||
| Pays-Bas | ||||
| Pologne | ||||
| Portugal | ||||
| Roumanie | ||||
| Royaume-Uni | ||||
| Russie | ||||
| Saint-Marin | ||||
| Serbie | ||||
| Slovaquie | ||||
| Slovénie | ||||
| Suède | ||||
| Suisse | ||||
| Tchéquie | ||||
| Ukraine |
Aux États-Unis
En Asie
Philippines
Le frottis du col utérin a été introduit aux Philippines dans les années 1990 pour les femmes de 35 à 55 ans, une fois dans sa vie. En 2005, la politique a été déplacée vers l'approche à une seule visite utilisant l'inspection visuelle à l'acide acétique (IVA) suivie de la cryothérapie, car il s'agissait d'une approche plus pratique que le frottis atteignant seulement 7,7 % des femmes. La recommandation nationale actuelle est de cibler les femmes de 25 à 55 ans, l'IVA étant effectuée à des intervalles de cinq à sept ans. La colposcopie avec frottis vaginal ou biopsie n'est recommandée que comme test diagnostique de confirmation après un test IVA positif.
En Australie
En 1991, l'Australie a lancé un programme de dépistage organisé du CCU, qui lui a permis de réduire de moitié l'incidence de cancer (initialement de 13,5 cas pour 100 000 femmes) ainsi que la mortalité associée. En 2007, l'Australie fut le premier pays au monde a introduire une vaccination généralisée des jeunes filles étendue ensuite aux garçons. En 2017 ce pays remplace le dépistage cytologique tous les deux ans pour le test HPV tous les cinq ans. Des chercheurs de Cancer Council NSW de Sydney prédisent que l'Australie sera le premier au monde à pouvoir « éliminer » le cancer du col de l'utérus, avec une incidence annuelle standardisée inférieure à 2 pour 100 000 femmes et une mortalité annuelle standardisée inférieure à 1 pour 100 000 femmes, avant 2034.
Sources
Liste des abréviations utilisées dans l'article
| Acronyme | Signification |
|---|---|
| CCU | Cancer du col de l'utérus |
| HPV | Papillomavirus humain |
| JPC | Jonction pavimento-cylindrique |