
Streptozotocine
| streptozotocine | |
| |
| Identification | |
|---|---|
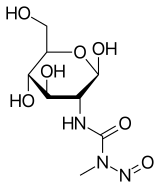
| Nom UICPA | 2-désoxy-2-({[méthyl(nitroso)amino]carbonyl}amino)-β-D-glucopyranose |
| Synonymes |
streptozocine |
| No CAS | 18883-66-4 |
| Code ATC | L01AD04 |
| DrugBank | DB00428 |
| PubChem | 29327 |
| ChEBI | 9288 |
| SMILES | |
| InChI |
Std. InChI : vue 3D InChI=1S/C8H15N3O7/c1-11(10-17)8(16)9-4-6(14)5(13)3(2-12)18-7(4)15/h3-7,12-15H,2H2,1H3,(H,9,16)/t3-,4-,5-,6-,7+/m1/s1 Std. InChIKey : ZSJLQEPLLKMAKR-GKHCUFPYSA-N |
| Propriétés chimiques | |
| Formule |
C8H15N3O7 |
| Masse molaire | 265,220 6 ± 0,010 2 g/mol C 36,23 %, H 5,7 %, N 15,84 %, O 42,23 %, 265,221 g/mol |
| Données pharmacocinétiques | |
| Biodisponibilité | 17 - 25% (100% si IV) |
| Métabolisme | Hépatique, rénal |
| Demi-vie d’élim. | 35 à 40 minutes |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antinéoplasique |
| Voie d’administration | IV |
| Grossesse | Contre-indiqué |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
La streptozotocine (STZ) est une molécule de la famille des nitroso-urées, utilisée comme agent alkylant à visée antinéoplasique ou comme antibiotique. Elle est particulièrement toxique envers les cellules β des îlots de Langerhans chez les mammifères, elle est à ce titre indiquée dans le traitement des insulinomes et employée en recherche médicale dans l’induction chimique du diabète de type 1 chez des modèles animaux.
Historique
La streptozotocine a été identifiée vers la fin des années 1950 en tant qu’antibiotique naturel à large spectre, isolée à partir d’une souche de la bactérie Gram-positive Streptomyces achromogenes var. streptozoticus. Des scientifiques du laboratoire pharmaceutique Upjohn, basé à Kalamazoo (Michigan) et maintenant partie de Pfizer, ont découvert en 1958-1959 cette molécule dans un échantillon de sol contaminé par la bactérie et prélevé dans « un sol sablonneux, non cultivé, dans une région de prairie » à Blue Rapids (Kansas).[source insuffisante] Un brevet leur a été accordé en . En 2019, Balskus et al. ont apporté de nouveaux éléments de compréhension de la biosynthèse de la streptozotocine, en mettant en évidence le cluster de gènes responsable de la production chez Streptomyces achromogenes et en découvrant la fonction de la SznF, une métallo-enzyme à fer non-héminique, qui permet de former la liaison N-N dans le pharmacophore N-nitroso-urée par réarrangement oxydatif.
Durant les années 1960, les scientifiques ont constaté que la streptozotocine était sélectivement cytotoxique envers les cellules β des îlots de Langerhans, ce qui permet d’entraver l’insulinosécrétion. Ces découvertes ont suscité un intérêt concernant l’utilisation de la molécule dans des modèles animaux du diabète sucré et dans le traitement des cancers des cellules β. Dans les années 1970, le National Cancer Institute entreprend des études sur l’indication de la streptozotocine en tant qu’anticancéreux. Le médicament obtient une autorisation de mise sur le marchée par la FDA en 1982, sous le nom commercial Zanosar. Le brevet ayant expiré depuis longtemps, de nombreuses formulations génériques sont aujourd'hui disponibles.
Mécanismes d'action
La structure de la streptozotocine correspond à un 2-désoxy-D-glucose substitué en C2 par un groupe N-nitroso-N-méthylurée. Elle entre dans les cellules grâce au transporteur GLUT2, mais n’est pas reconnue par les autres transporteurs de glucose. Cela explique sa toxicité relative envers les cellules β, puisque celles-ci ont un niveau d’expression de GLUT2 très élevé. La streptozotocine peut également pénétrer dans les hépatocytes. Comme d'autres agents alkylants, elle exerce sa toxicité en causant la méthylation des bases puriques de l'ADN, causant des adduits covalents, et peut même entraîner des ruptures des brins d'ADN. La streptozotocine est également une molécule donneuse de NO qui génère des ROS, contribuant à la déterioration de l'ADN. Tous ces dommages à l'ADN stimulent la voie de réparation PARP, ayant pour conséquences une diminution de l'ATP et une augmentation du NAD+ ; la contribution de ces dernières est certainement plus importante dans la diabétogenèse que la génotoxicité seule.
Injectée à des doses faibles et répétées (20 à 40 mg/kg) chez le rat ou la souris, la streptozotocine diminue l'insulinosécrétion sans pour autant entraîner la mort cellulaire, ce qui permet de mimer chez l'animal l’insulite (en) rencontrée dans le diabète de type 1. Le déclenchement de la réaction inflammatoire des îlots β est rendu possible par la production de cytokines pro-inflammatoires et par le recrutement de macrophages — alors que la pathologie humaine est associée à un recrutement de lymphocytes T.
À des doses élevées (100 à 200 mg/kg) et en injection unique, la streptozotocine entraîne la destruction rapide des cellules β. La régénération spontanée des cellules est toutefois possible, ce qui limite la pertinence du modèle murin.
Utilisations
La streptozotocine est titulaire d’une AMM dans le traitement des adénocarcinomes métastatiques des îlots de Langerhans et des tumeurs carcinoïdes métastasées. En raison de sa forte toxicité rénale, hépatique et hématologique, et de son efficacité mitigée, son utilisation est généralement limitée aux patients pour lesquels le cancer ne peut être réséqué par chirurgie ou après échec d’une chirurgie. Chez les patients traités, la streptozotocine permet de réduire la taille de la tumeur et d’atténuer les symptômes, en particulier l'hypoglycémie secondaire à la sécrétion excessive d'insuline par les insulinomes. La posologie classique est de 500 mg/m2 par administration, réalisée en IV, à la fréquence d’une injection par jour pendant 5 jours. Les cures doivent être espacées de 6 semaines.
Comme l'alloxane, la streptozotocine est utilisée depuis longtemps dans la recherche scientifique pour créer des modèles animaux de diabète sucré et d'insulite à faible dose, et d'hyperglycémie à forte dose, notamment chez les souris et les rats mais aussi chez les lapins ou les poissons. Les modèles de diabète chimiquement induits sont peu coûteux, relativement simples d'exécution et rapides, en comparaison aux modèles génétiques (souris NOD (en)). Ces modèles sont potentiellement intéressants pour tester de nouvelles formulations de l'insuline, pour étudier la transplantation d'îlots pancréatiques (en), ou pour tester des médicaments empêchant la mort des cellules β. Toutefois, les modèles d'induction chimique ont de nombreux inconvénients : les agents chimiques peuvent être toxiques pour d'autres organes, les résultats sont variables selon la lignée, le sexe et le régime alimentaire, il n'existe pas de protocole standardisé de préparation et d'administration des produits chimiques, et le diabète induit est généralement moins stable et potentiellement réversible.
La streptozotocine a également été employée pour modéliser la perte de mémoire dans la maladie d'Alzheimer chez la souris.