Peroxyde de diacétyle
| Peroxyde de diacétyle | |
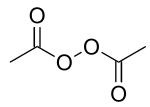 Structure du peroxyde de diacétyle |
|
| Identification | |
|---|---|
| Nom UICPA | éthaneperoxoate d'acétyle |
| No CAS | 110-22-5 |
| NoECHA | 100.003.409 |
| No CE | 203-748-8 |
| PubChem | 8040 |
| SMILES | |
| InChI |
Std. InChI : vue 3D InChI=1S/C4H6O4/c1-3(5)7-8-4(2)6/h1-2H3 Std. InChIKey : ZQMIGQNCOMNODD-UHFFFAOYSA-N |
| Propriétés chimiques | |
| Formule |
C4H6O4 [Isomères] |
| Masse molaire | 118,088 ± 0,004 8 g/mol C 40,68 %, H 5,12 %, O 54,19 %, |
| Propriétés physiques | |
| T° fusion | 26,5 °C |
| T° ébullition |
121,4 °C (fort risque d'explosion) |
| Solubilité | faiblement soluble dans l'eau froide |
| Masse volumique | 1,18 g·cm-3 à 20 °C |
| Point d’éclair | 44,5 °C |
| Pression de vapeur saturante | 2,8 kPa à 63 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
Le peroxyde de diacétyle est un composé chimique de formule CH3COO–OOCCH3. Il s'agit d'un solide cristallisé à l'odeur aigre, explosif, généralement distribué dans le commerce sous forme de solution à 25 % dans du phtalate de diméthyle.
Propriétés et précautions
Le composé pur est rarement étudié en raison des risques d'explosion qu'il présente, mais la solution à 25 % est également susceptible d'exploser si le solvant s'évapore suffisamment pour concentrer le peroxyde jusqu'à former un précipité. Le peroxyde de diacétyle sec se comporte de façon imprévisible. Il peut ainsi exploser violemment au contact de l'éther diéthylique ou de n'importe quel solvant volatil. Il est recommandé d'utiliser rapidement les solutions de peroxyde de diacétyle et de ne pas les conserver, afin de prévenir les risques d'explosion par évaporation du solvant, et de ne pas les chauffer au-dessus de 30 °C.
Il est essentiel d'empêcher à chaque instant la formation de cristaux, même de traces, tout au long des processus chimiques étudiés, car le peroxyde cristallisé est sensible à la friction et au choc, et le risque de détonation est alors élevé : une solution aqueuse d'acétate de sodium CH3COONa peut ainsi exploser en présence de fluor F2 en raison de la formation de peroxyde de diacétyle, et un accident survenu fin 2010 au département Chimie de l'université Northwestern lors de la préparation d'un dérivé soluble d'iodosobenzène C6H5IO a été imputé à la formation inopinée de peroxyde de diacétyle par réaction entre de l'anhydride acétique CH3COOOCCH3 résiduel et de l'acide peracétique CH3COOOH au cours d'un protocole modifié par rapport à une publication de 1999 — concentration accrue de peroxyde d'hydrogène H2O2 en présence d'anhydride acétique.
La plupart des composés chimiques réagissent avec les peroxydes au moins en produisant de la chaleur. De nombreux matériaux explosent ou produisent des gaz à leur contact. Les solutions de peroxydes diluées à moins de 70 % sont généralement sûres, mais, même alors, la présence d'impuretés telles que des métaux de transition (par exemple cobalt, fer, nickel, manganèse, vanadium) est susceptible de provoquer leur décomposition rapide avec apparition de points chauds déclenchant une explosion.
D'une manière générale, les peroxydes de ce type sont de bons oxydants. Les composés organiques peuvent s'enflammer au contact de peroxyde de diacétyle concentré, tandis que les composés très réduits tels que les sulfures, les nitrures et les hydrures peuvent réagir de façon explosive.
