Nitrite de sodium
| Nitrite de sodium | |||

| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Nitrite de sodium | ||
| No CAS | 7632-00-0 | ||
| NoECHA | 100.028.687 | ||
| No CE | 231-555-9 | ||
| Code ATC | V03AB08 | ||
| No E | E250 | ||
| Apparence | solide de formes variables hygroscopique, blanc a jaune | ||
| Propriétés chimiques | |||
| Formule | NNaO2NaNO2 | ||
| Masse molaire | 68,995 3 ± 0,000 8 g/mol N 20,3 %, Na 33,32 %, O 46,38 %, |
||
| Propriétés physiques | |||
| T° fusion | (décomposition) : 280 °C | ||
| T° ébullition | se décompose au-dessous du point d'ébullition à 320 °C | ||
| Solubilité | dans l'eau à 20 °C : 820 g l−1 | ||
| Masse volumique | 2,2 g cm−3 | ||
| Cristallographie | |||
| Système cristallin | orthorhombique | ||
| Précautions | |||
| SGH | |||
|
H272, H301 et H400
H272 : Peut aggraver un incendie ; comburant H301 : Toxique en cas d'ingestion H400 : Très toxique pour les organismes aquatiques |
|||
| Transport | |||
Code Kemler : 56 : matière comburante (favorise l'incendie), toxique Numéro ONU : 1500 : NITRITE DE SODIUM Classe : 5.1 Code de classification : OT2 : Matières comburantes toxiques : Solides ; Étiquettes :  5.1 : Matières comburantes  6.1 : Matières toxiques Emballage : Groupe d'emballage III : matières faiblement dangereuses. |
|||
| Écotoxicologie | |||
| DL50 | 85 mg kg−1 (rats)[réf. souhaitée] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
|
modifier |
|||
Le nitrite de sodium, de formule NaNO2, est le nitrite le plus important dans l'industrie chimique. Son code est E250.
L'ancienne méthode de fabrication était basée sur la réduction du nitrate de sodium par le plomb métallique à 420 °C :
Le nitrite de sodium s'obtient de nos jours comme sous-produit lors de la synthèse industrielle de l’acide nitrique. Le mélange de monoxyde d'azote et de dioxyde d'azote produit lors de cette synthèse est absorbé par une solution d’hydroxyde de sodium, ce qui conduit à du nitrite et à du nitrate de sodium.
Usages
Utilisations industrielles
La plupart des utilisations industrielles sont basées soit sur les propriétés d'oxydation du nitrite de sodium, soit sur sa capacité de libérer de l'acide nitreux dans des conditions acides : le nitrite de sodium est « une source avantageuse d'acide nitreux pour les réactions de nitrosation et pour la diazotisation des amines aromatiques et la fabrication des composés du groupe azo ».
Le nitrite de sodium est un inhibiteur de la polymérisation. Il intervient dans la fabrication de certains composés fluorés, dans la synthèse des teintures, dans le traitement des métaux. L'essentiel de la production de nitrite de sodium est destiné aux applications relevant de l'industrie lourde.
Utilisations alimentaires et critiques
Le nitrite de sodium est utilisé dans la fabrication de la plupart des charcuteries, à la fois comme conservateur alimentaire et comme conservateur de couleur. Il permet également d'accélérer la transformation charcutière des produits d'élevage.
D'après certains fabricants d'additif au nitrite et d'après certains transformateurs industriels de la charcuterie, « le nitrite de sodium est indispensable comme inhibiteur de la croissance des spores de Clostridium botulinum, responsables du botulisme dans les viandes réfrigérées » et plus spécifiquement dans les charcuteries. Son efficacité dépend de plusieurs facteurs, dont le niveau de nitrite résiduel, le pH, la concentration en sel, la présence d'ions réducteurs et la teneur en fer. Il faut toutefois remarquer que le nitrite de sodium n'est pas considéré comme efficace contre les entérobactéries pathogènes comme Salmonella et Escherichia coli.
En raison de sa toxicité, le nitrite de sodium n'est jamais utilisé pur. Il est incorporé à certaines charcuteries sous forme de sel nitrité (mélange sel de cuisine plus nitrite de sodium en proportion de 0,6 %). Le sel nitrité est un additif alimentaire qui, selon la Libre.be, « est suspecté de jouer un rôle dans le développement du cancer colorectal, le troisième cancer le plus mortel en France ». Pour le magazine Que choisir, « L'utilisation des nitrites en charcuterie est reconnue cancérigène ». Sciences et Avenir souligne cependant que la charcuterie demeure nettement moins dangereuse que le tabac. Les lobbies de l'industrie agroalimentaire tentent d'empêcher l'interdiction du nitrite de sodium en mettant en avant ses fonctions de conservation. Selon le magazine d'investigation télévisuel mensuel Cash Investigation, il existerait des alternatives aux nitrites. De nombreuses charcuteries sont fabriquées sans recourir au nitrite ou au nitrate, aussi bien en production-transformation traditionnelle fermière qu'en transformation artisanale ainsi qu'en transformation industrielle. Parmi les exemples connus : le jambon de Parme, le jambon de San Daniele, le jambon fermier corse ou les autres charcuteries fermières de la Corse. En Espagne, certains jambons dits « ibériques » sont fabriqués sans additif nitré mais la majorité de la transformation industrielle est traitée au nitrite ou au nitrate. Certains transformateurs européens proposent une large gamme d'élaborations sans nitrate ou nitrite, par exemple en Italie en Espagne, au Danemark ou en Allemagne. L'utilisation de nitrite ou de nitrate reste toutefois utile dans les transformations effectuées par des personnes qui ne sont pas au fait des règles d'hygiène élémentaire et par les fabricants qui ne sont pas au fait des méthodes de transformation adaptées.
Un rapport du cabinet d'étude berlinois Civic Consulting remis à la Commission européenne en confirme (page 6) que des solutions techniques permettent de se passer des additifs nitrés, mais indique également (page 6) que les industriels consultés ne sont pas favorables à cette suppression. Dans un communiqué, les industriels de la charcuterie française insistent sur ce point, qui suscite la polémique.
Utilisation médicale
Antidote lors d'intoxication au cyanure, le nitrite de sodium est injecté par voie intraveineuse immédiatement après l'ingestion accidentelle de cyanure. Il permet alors de minimiser la fixation des cyanures au Fe(II) de l'hémoglobine (très forte affinité) par formation de méthémoglobine (le fer de l'hème est oxydé en Fe(III), dont l'affinité pour les ions cyanure est alors diminuée. C'est pourquoi le nitrite de sodium fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en ). Il est également utilisé en chirurgie cardiaque et dans certains traitements en cardiologie et en angiologie, dans des conditions contrôlées qui tiennent compte de sa toxicité.
Toxicité
Méthémoglobinémie
La méthémoglobinémie est une intoxication provoquée par un taux trop important de méthémoglobine dans le sang. En se fixant sur l'hémoglobine, le NO issu du nitrite produit une oxydation du fer ferreux en fer ferrique. Dans l'hémoglobine normale, les noyaux hémiques des sous unités de l'hémoglobine lient un fer ferreux (Fe2+) qui va lier l'oxygène. Dans le cas de la méthémoglobinémie, le noyau hémique va lier un fer ferrique (3+) qui est incapable de lier l'oxygène.
Cette transformation rend impossible la fixation et le transport de l'oxygène des alvéoles pulmonaires vers les tissus. La méthémoglobinémie induit des symptômes dès que le taux de méthémoglobine atteint 10 % des globules rouges (coloration de la peau et des muqueuses vers la cyanose, céphalées, vertiges, tachycardie, etc.). Les très jeunes enfants y sont plus susceptibles que les adultes car pendant les premiers mois de la vie, l'hémoglobine reste d'origine fœtale.
Cancérogénicité
Nitrosamines
Le corps humain produit naturellement des amines. En rencontrant les éléments nitrés des charcuteries, les amines peuvent donner naissance à des nitrosamines. Elles peuvent apparaître dans les charcuteries lors de la fabrication, lors de la cuisson (cuisson à plus de 130 °C), et lors de la digestion humaine, à cause des conditions acides de l'estomac. La molécule finale correspond à l'addition d'un radical nitroso et le produit formé n'est stable qu'avec les amines secondaires.
Les nitrosamines comptent parmi les plus puissants agents cancérogènes connus[source secondaire souhaitée]. On les trouve également dans la fumée des cigarettes, sous forme de TSNA (en) ("Tobacco-specific nitrosamines"). L'exposition aux nitrosamines par nitrosation en milieu acide (au niveau de l'estomac) du nitrite de sodium ajouté à la charcuterie est classée dans le groupe 2A (probablement cancérogènes pour l’homme) par le CIRC[réf. souhaitée].
L'industrie charcutière est parvenue à réduire la fréquence des nitrosamines dans certains produits, sans toutefois réussir à les supprimer complètement. Dans Évaluation du risque lié aux nitrosamines dans les produits à base de viande, le CEPROC indique les recommandations à donner aux consommateurs pour cuire les produits nitrités (saucisse, lardon, poitrine, etc.) :
« 1. Préférer les modes de cuisson à feu doux (vapeur, marmite) plutôt que la cuisson à feu vif […] ;
2. Pour les cuissons au barbecue […] Ne griller que les produits (lardons, poitrine) pour lesquels la cuisson à la poêle ou au barbecue est prévue ;
3. Utiliser une précuisson à l’eau ou à la vapeur qui permet de coaguler les protéines pour ensuite limiter le temps de chauffage en chaleur sèche à la poêle ou au barbecue ;
4. Décongeler les produits congelés avant cuisson. Cela permet d’éviter un temps trop élevé de chauffage fort ;
5. Respecter les règles d’hygiène et la chaîne du froid. »
Sa formation peut être soit limitée, soit renforcée par l'absorption d'acide ascorbique. La présence de lipides favorise la formation tandis que son absence l'inhibe.
Nitrosamides
Une nitrosamide (ou amide nitreuse) est un composé chimique possédant le groupe fonctionnel R-C(=O)N(NO)-R’. Comme les nitrosamines, les nitrosamides forment une famille de composés chimiques azotés et oxydés qui peuvent être impliqués dans la cancérogenèse, en particulier dans le cancer du colon. Plus instables que les nitrosamines, les nitrosamides sont plus difficiles à étudier. Les réactions de nitrosation conduisent à la formation de nitrosamines ou de nitrosamides selon qu’il s’agit de l’ajout d’ions nitrosonium NO+ sur une amine ou une amide.
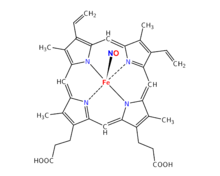
Hème nitrosylé
Dans la chair nitrée, l'oxyde nitrique NO, issu de la décomposition des sels de nitrate et de nitrite, se fixe à la myoglobine Fe2+ et forme la nitroso-myoglobine NO-Mb. Lorsque cette chair nitrée est soumise à la chaleur, la nitroso-myoglobine se transforme, son pigment nitré (l'hème nitrosylé, appelé aussi « nitrosohème » ou « fer nitrosylé », de couleur rouge foncé) se métamorphose et donne naissance à un nouveau pigment, appelé « nitrosylhémochrome », de couleur rose. La salaison donne ainsi une nouvelle teinte qui ne ressemble pas exactement à la couleur de la viande fraîche (c'est un rose framboisé qui n'a guère d'équivalent) mais correspond au ton vif attendu par le consommateur.
Les données épidémiologiques indiquent une association positive entre consommation de fer héminique et cancer colorectal. L’hème catalyse deux types de réactions : la lipoperoxydation et la formation de composés N-nitrosés. De plus, l’hème peut avoir un effet direct sur les cellules de la muqueuse.
Dans les charcuteries nitritées, contrairement à la viande rouge, l’hème est sous forme nitrosylé en raison de l’ajout de nitrites qui se retrouvent principalement sous forme d’ions nitrite NO2−. Les réactions produites lors de la fabrication de la charcuterie peuvent modifier la molécule d'hème vers la forme appelée « nitrosylée », qui permet à son tour la formation d'agents cancérigènes, comme les peroxydes.
Les réactions de nitrosylation conduisent à la formation de S-nitrosothiols ou de fer nitrosylé FeNO à la suite de l’ajout d’un ion nitrosyl NO− sur des métaux ou des groupements thiol. Les nitrites, utilisés sous forme d’acide nitreux, favorisent ce type de réaction et conduisent à la formation d’oxyde d’azote et d’hème nitrosylé.
Réactions
Au laboratoire, le nitrite de sodium peut être utilisé pour détruire l'excès d'azoture de sodium :
- 2 NaN3 + 2 NaNO2 + 2 H+ → 3 N2 + 2 NO + 2 Na+ + 2 H2O.
Au-dessus de 330 °C, le nitrite de sodium se décompose (dans l'air) en oxyde de sodium, monoxyde d'azote et dioxyde d'azote :
- 2 NaNO2 → Na2O + NO + NO2.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium nitrite#Chemical reactions » (voir la liste des auteurs).