Nicotinamide adénine dinucléotide
| Nicotinamide adénine dinucléotide | |
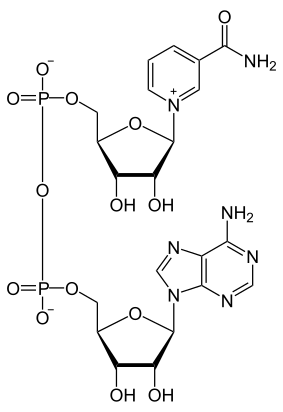
  Structure du NAD+ (à gauche) et du NADH (à droite) |
|
| Identification | |
|---|---|
| Nom UICPA | adénosine 5’-{3-[1-(3-carbamoylpyridinio)-1,4-anhydro-D-ribitol-5-yl] dihydrogen diphosphate} |
| Synonymes |
NAD+, coenzyme I, DPN+ |
| No CAS | 53-84-9 |
| NoECHA | 100.000.169 |
| No CE | 200-184-4 |
| No RTECS | UU3450000 |
| DrugBank | DB01907 |
| PubChem | 5892 |
| ChEBI | 15846 |
| SMILES | |
| InChI |
InChI : vue 3D InChI=1/C21H27N7O14P2/c22-17-12-19(25-7-24-17)28(8-26-12)21-16(32)14(30)11(41-21)6-39-44(36,37)42-43(34,35)38-5-10-13(29)15(31)20(40-10)27-3-1-2-9(4-27)18(23)33/h1-4,7-8,10-11,13-16,20-21,29-32H,5-6H2,(H5-,22,23,24,25,33,34,35,36,37)/t10-,11-,13-,14-,15-,16-,20-,21-/m1/s1 Std. InChI : vue 3D InChI=1S/C21H27N7O14P2/c22-17-12-19(25-7-24-17)28(8-26-12)21-16(32)14(30)11(41-21)6-39-44(36,37)42-43(34,35)38-5-10-13(29)15(31)20(40-10)27-3-1-2-9(4-27)18(23)33/h1-4,7-8,10-11,13-16,20-21,29-32H,5-6H2,(H5-,22,23,24,25,33,34,35,36,37)/p+1/t10-,11-,13-,14-,15-,16-,20-,21-/m1/s1 Std. InChIKey : BAWFJGJZGIEFAR-NNYOXOHSSA-O |
| Apparence | solide |
| Propriétés chimiques | |
| Formule |
C21H27N7O14P2 [Isomères] |
| Masse molaire | 663,425 1 ± 0,024 3 g/mol C 38,02 %, H 4,1 %, N 14,78 %, O 33,76 %, P 9,34 %, |
| Écotoxicologie | |
| DL50 | 4 333 mg kg−1 (souris, i.p.) |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
Le nicotinamide adénine dinucléotide (NAD) est une coenzyme présente dans toutes les cellules vivantes. Il s'agit d'un dinucléotide, dans la mesure où la molécule est constituée d'un premier nucléotide, dont la base nucléique est l'adénine, uni à un second nucléotide, dont la base est le nicotinamide. Le NAD existe sous une forme oxydée, notée NAD+, et une forme réduite, notée NADH.
Le NAD intervient dans le métabolisme comme transporteur d'électrons dans les réactions d'oxydoréduction, le NAD+ comme oxydant et le NADH comme réducteur. Le NAD intervient également dans quelques autres processus cellulaires, notamment certaines modifications post-traductionnelles — ADP-ribosylation — des protéines nouvellement synthétisées. En raison de l'importance de ces fonctions cellulaires, les enzymes impliquées dans le métabolisme du NAD font l'objet de diverses recherches pharmaceutiques.
Le NAD peut être synthétisé in vivo à partir du tryptophane et de l'aspartate, deux acides aminés protéinogènes, ainsi que de la vitamine B3 (niacine). Des composés semblables sont libérés par des réactions qui dégradent la structure du NAD, mais ces composés sont généralement récupérés par des voies dites de sauvetage, qui les recyclent sous leur forme active. Une fraction du NAD est également convertie en nicotinamide adénine dinucléotide phosphate (NADP), une coenzyme dont la biochimie est très proche de celle du NAD mais dont le rôle métabolique est sensiblement différent.
Le signe + de la graphie NAD+ représente la charge électrique formelle de l'hétéroatome d'azote du nicotinamide, qui disparait dans le NADH, mais le NAD+ est en réalité un anion de charge -1 à pH physiologique, tandis que le NADH est un dianion, de charge -2.
Propriétés
Chimie

Comme tous les dinucléotides, le nicotinamide adénine dinucléotide est constitué de deux nucléosides unis par un groupe diphosphate. Chacun de nucléosides contient un résidu de ribose, l'un étant lié à un résidu d'adénine sur l'atome de carbone en position 1’, tandis que l'autre est lié, sur la position équivalente de l'autre nucléotide, à un résidu de nicotinamide. Ce dernier peut prendre deux orientations différentes, ce qui donne deux diastéréoisomères ; seul le diastéréoisomère à nicotinamide β est présent dans les systèmes biologiques. Les deux nucléotides sont unis par un pont diphosphate entre leurs atomes de carbone en position 5’.
Le NAD intervient dans les réactions d'oxydoréduction comme accepteur d'électrons (NAD+, oxydant) ou donneur d'électrons (NADH, réducteur) :
-
RH2 + NAD+
NADH + H+ + R.
Deux électrons sont transférés au NAD+, mais avec un seul proton, de sorte que l'autre proton est libéré sous forme d'ion H+. Plus précisément, un électron est transféré à l'hétéroatome d'azote du cycle pyridine, dont la charge électrique passe de +1 à 0, tandis qu'un atome d'hydrogène est transféré sur l'atome de carbone en position 4, à l'opposé de l'atome d'azote dans le cycle pyridine. Le potentiel standard du couple rédox NAD+/NADH vaut –0,32 V, ce qui en fait un réducteur fort. Cette réaction est aisément réversible, de sorte que le coenzyme peut continuellement osciller entre les états oxydé et réduit au gré des oxydations et réductions auxquelles elle participe, sans être dégradée.
Physique

Le nicotinamide adénine dinucléotide oxydé et réduit se présente sous la forme de poudres blanches à grains amorphes, hygroscopique et très soluble dans l'eau. Il est stable sous forme solide s'il est conservé à sec à l'abri de la lumière. Les solutions de NAD+ sont incolores et demeurent stables pendant à peu près une semaine à 4 °C et pH neutre, mais se décomposent rapidement à pH acide ou basique ; en se décomposant, il forme des composés qui agissent comme inhibiteurs d'enzymes dont ils sont coenzymes.
Le NAD+ et le NADH sont tous les deux très absorbants dans l'ultraviolet du fait de la présence d'adénine dans la molécule. Le pic d'absorption du NAD+ s'observe à une longueur d'onde de 259 nm, avec une absorptivité molaire de 16 900 M−1·cm−1. Le NADH absorbe l'ultraviolet à plus grande longueur d'onde, avec un second pic d'absorption à 339 nm pour une absorptivité de 6 220 M−1·cm−1. Cette différence entre les spectres d'absorption du NAD+ et du NADH offre un moyen simple de mesurer la conversion de l'un en l'autre lors des dosages enzymatiques (en) en mesurant l'absorption à 340 nm à l'aide d'un spectrophotomètre.
Le NAD+ et le NADH diffèrent également du point de vue de leur fluorescence : le NADH en solution présente un pic d'émission à 460 nm avec une durée de vie à l'état excité de 0,4 ns tandis que le NAD+ ne présente pas de fluorescence. Les caractéristiques du signal de fluorescence varient lorsque le NADH se lie aux protéines, de sorte que ces variations peuvent être mises à profit pour mesurer les constantes de dissociation, déterminantes dans l'étude de la cinétique enzymatique. Ces variations sont également étudiées par microscopie à fluorescence afin de mesurer les changements d'état rédox des cellules vivantes.
Concentration cellulaire des formes oxydée et réduite du NAD — et du NADP
La quantité totale de NAD+ et de NADH dans le foie de souris est d'environ 1 µmol·g-1 de matière humide, ce qui représente environ dix fois la concentration en NADP+ et NADPH dans les mêmes cellules. La concentration réelle de NAD+ dans le cytosol de ces cellules est plus difficile à mesurer, les estimations avoisinant 0,3 mmol·L-1 pour les cellules animales et 0,1 à 0,2 mmol/L chez la levure. Cependant, plus de 80 % de la fluorescence du NADH des mitochondries provient de formes liées à des protéines, de sorte que la concentration des formes libres en solution est bien plus faible.
Les données relatives aux autres compartiments cellulaires sont limitées, cependant la concentration de NAD+ dans les mitochondries est semblable à celle du cytosol. Le NAD+ y est importé par un transporteur membranaire spécifique car cette coenzyme ne peut diffuser à travers la bicouche lipidique des membranes.
L'équilibre entre les formes réduite et oxydée du NAD est appelé ratio [NAD+]/[NADH]. Ce ratio est indicateur important de l'état rédox de la cellule, qui reflète à la fois l'activité métabolique de la cellule et sa bonne santé. Les effets du ratio [NAD+]/[NADH] sont complexes, dans la mesure où il contrôle l'activité de plusieurs enzymes clés, dont la glycéraldéhyde-3-phosphate déshydrogénase et la pyruvate déshydrogénase. Dans les tissus sains de mammifères, ce ratio entre espèces libres dans le cytoplasmes vaut typiquement 700, ce qui favorise les réactions d'oxydation. Le ratio de [NAD+]/[NADH] total est bien plus faible, les estimations chez les mammifères étant de l'ordre de 3 à 10. À l'opposé, le ratio des espèces libres [NADP+]/[NADPH] est généralement de l'ordre 0,005, de sorte que c'est la forme réduite NADPH de cette coenzyme qui est largement prédominante. Ces différences sont essentielles pour comprendre le rôle fondamentalement différent du NAD et NADP dans le métabolisme.
Biosynthèse
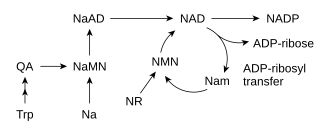
La biosynthèse du NAD+ est réalisée à travers deux voies métaboliques : par une voie de novo à partir de précurseurs élémentaires, ou par une voie de sauvetage à partir de produits de dégradation, tels que le nicotinamide.
Synthèse de novo
La plupart des êtres vivants produisent le NAD+ à partir de précurseurs élémentaires. Le détail des réactions dépend des organismes, mais ils ont en commun de passer par l'acide quinoléique (QA) à partir d'un acide aminé, en l'occurrence le tryptophane (Trp) chez les animaux et certaines bactéries, ou l'aspartate (Asp) chez les plantes et d'autres bactéries. L'acide quinolinique est converti en acide nicotinique mononucléotide (NaMN) par transfert sur du phosphoribose, puis l'ensemble est transféré sur une unité adénylate pour former l'acide nicotinique adénine dinucléotide (NaAD), et le résidu d'acide nicotinique est finalement aminé en nicotinamide pour former le NAD.
Une partie du NAD+ peut ensuite être phosphorylé en NADP+ par la NAD+ kinase. La plupart des êtres vivants utilisent l'ATP comme donneur de groupe phosphate, mais certaines bactéries telles Mycobacterium tuberculosis et certaines archées telles que l'hyperthermophile Pyrococcus horikoshii (en) utilisent le polyphosphate inorganique comme donneur de phosphoryle.
Voies de sauvetage

Outre l'assemblage de novo à partir de précurseurs tels que des acides aminés, les cellules disposent de voies métaboliques de sauvetage des composés à base de pyridine, telles que la voie de sauvetage des nucléotides. Les trois précurseurs vitaminiques utilisés par ces voies de sauvetage sont l'acide nicotinique (NA), le nicotinamide (Nam) et le N-ribosylnicotinamide (NR). Ces composés peuvent être obtenus dans l'alimentation et sont désignés collectivement vitamine B3 ou niacine ; ils peuvent également se former dans les cellules par dégradation du NAD+ cellulaire. Certaines des enzymes intervenant dans ces voies de sauvetage sont concentrées dans le noyau de la cellule, ce qui permet de compenser l'utilisation intensive de cette coenzyme dans cet organite. Certaines publications font état de l'absorption directe par les cellules de mammifère du NAD+ de leur milieu extracellulaire.
Chez l'homme, les réactions de sauvetage sont essentielles bien que la voie de novo soit également présente. Une carence en vitamine B3 provoque la pellagre, une maladie survenant notamment en contexte de malnutrition. Les besoins cellulaires élevés en NAD proviennent de la consommation continuelle de cette coenzyme au cours de réactions telles que les modifications post-traductionnelles, dans la mesure où son utilisation dans les réactions d'oxydoréduction n'altère pas sa concentration cellulaire.
Les voies de sauvetage utilisées chez les microorganismes sont différentes de celles des mammifères. Certains pathogènes, tels que la levure Candida glabrata et la bactérie Haemophilus influenzae sont incapables de produire leur NAD mais possèdent des voies de sauvetage et sont par conséquent dépendantes de la disponibilité de ces précurseurs. La bactérie intracellulaire Chlamydia trachomatis est quant à elle totalement dépourvue de gène en rapport avec la biosynthèse ou le sauvetage du NAD et du NADP, ce qui fait qu'elle doit acquérir ces coenzymes de son hôte.
Fonctions biochimiques
Le nicotinamide adénine dinucléotide assure plusieurs fonctions biochimiques dans le métabolisme des cellules. Il intervient comme coenzyme dans les réactions d'oxydoréduction, comme donneur de groupes ADP-ribose dans les réactions d'ADP-ribosylation, comme précurseur du messager secondaire ADP-ribose cyclique, ainsi que comme substrat des ADN ligases bactériennes et des sirtuines, ces dernières utilisant le NAD+ pour la désacétylation des histones. De surcroît, le NAD+ peut être libéré des cellules spontanément et par des mécanismes régulés, ce qui lui confère également des fonctions extracellulaires.
Interaction avec les oxydoréductases

Le rôle principal du NAD+ est celui de transporteur d'électrons d'une molécule à une autre. Les réactions de ce type sont catalysées par un grand groupe d'enzymes appelées oxydoréductases. Lorsqu'il se lie à une protéine, le NAD+ et le NADH se glissent généralement dans un type de structure appelé pli Rossmann, du nom du scientifique qui, le premier, identifia la récurrence de ce motif structurel dans les protéines qui se lient à des nucléotides. Ce motif contient au moins trois feuillets β parallèles reliés par deux hélices α qui alternent selon la séquence β–α–β–α–β. Cette structure conduit à un groupe de feuillets β flanqué par deux hélices α d'un même côté. Dans la mesure où chaque pli Rossmann se lie à un nucléotide, les domaines qui se lient au NAD+ contiennent deux plis Rossmann appariés. Cette structure n'est cependant pas universelle pour toutes les enzymes à NAD, certaines bactéries possédant pas exemple des enzymes impliquées dans le métabolisme des acides aminés qui se lient au NAD+ mais sont dépourvus de pli Rossmann.
Lorsqu'il se lie au site actif d'une oxydoréductase, le cycle du nicotinamide est positionné de telle sorte qu'il peut accepter l'équivalent d'un anion hydrure H− de l'autre substrat. Selon l'enzyme considérée, le donneur d'hydrure se trouve devant ou derrière le plan du cycle du nicotinamide tel que représenté ci-dessous, ce qui définit deux classes d'oxydoréductases : celles de classe A transfèrent l'anion hydrure depuis l'avant du plan, tandis que celle de classe B le transfèrent depuis l'arrière du plan.
(en) Les oxydoréductases de classe A transfèrent l'anion hydrure du substrat depuis l'avant du plan du cycle du nicotinamide, tandis que celle de classe B le transfèrent depuis l'arrière de ce plan.
L'atome C4 étant prochiral, cette propriété peut être mise à profit dans l'étude de la cinétique de l'enzyme afin d'obtenir des informations sur le mécanisme réactionnel de la catalyse qu'elle réalise : on procède en présentant à l'enzyme un substrat enrichi en deutérium afin de réduire le NAD+ avec du deutérium plutôt qu'avec de l'hydrogène, ce qui permet de déterminer lequel des deux stéréoisomères de NADH est produit.
Bien que les protéines se lient au NAD+ et au NADP+ de manière semblable, les enzymes présentent presque toujours une très grande sélectivité pour l'une ou l'autre de ces coenzymes. Cette spécificité rend compte du rôle métabolique distinct de ces deux coenzymes et provient de jeux de résidus d'acides aminés différents entre les sites de liaison de ces deux types d'enzymes. Ainsi, une liaison ionique se forme dans le site actif des enzymes à NADP entre le groupe phosphate supplémentaire du NADP+ et un résidu d'acide aminé basique, tandis que les enzymes à NAD possèdent à cet endroit un résidu de charge électrique opposée, c'est-à-dire négative, ce qui réduit considérablement l'affinité de leur site pour le NADP+. Il existe cependant des exceptions à cette règle générale, et certaines enzymes telles que l'aldose réductase, la glucose-6-phosphate déshydrogénase et la 5,10-méthylènetétrahydrofolate réductase peuvent utiliser les deux coenzymes chez certaines espèces.
Fonctions dans la respiration cellulaire
Les réactions d'oxydoréduction catalysées par les oxydoréductases sont critiques à tous les niveaux du métabolisme, mais l'un des aspects particulièrement vitaux du couple rédox NAD+/NADH a trait à son rôle dans l'oxydation des nutriments dans le cadre de la respiration cellulaire. L'énergie métabolique est contenue dans les électrons à haut potentiel de transfert qui réduisent le NAD+ en NADH, par exemple lors de la dégradation des acides gras par β-oxydation et du glucose par glycolyse puis oxydation par le cycle de Krebs de l'acétyl-CoA produite au cours de ces voies métaboliques. Chez les eucaryotes, le NADH produit dans le cytoplasme est importé dans les mitochondries à l'aide de « navettes » mitochondriales, comme la navette malate-aspartate ; il existe, chez les plantes, des navettes semblables également pour les chloroplastes. Le NADH mitochondrial, quant à lui, est oxydé à travers la chaîne respiratoire jusqu'à transférer ses électrons à un accepteur final, qui est par exemple l'oxygène O2 chez les organismes aérobies : il se forme dans ce cas de l'eau H2O. L'énergie libérée par ces oxydations est récupérée sous forme d'un gradient électrochimique généré à travers la membrane mitochondriale interne par les pompes à protons de la chaîne respiratoire sous la forme d'un gradient de concentration de protons dont la dissipation permet à l'ATP synthase de phosphoryler l'ADP en ATP ; ce processus est appelé phosphorylation oxydative.
Étant donné que les formes oxydée et réduite du nicotinamide adénine dinucléotide interviennent dans cet ensemble de réactions, la cellule maintient une concentration significative en NAD+ et en NADH, avec un ratio [NAD+]/[NADH] >> 1 en accord avec le rôle essentiellement oxydant de cette coenzyme. A contrario, le NADP intervient essentiellement comme réducteur dans les biosynthèses, telles que la photosynthèse et la biosynthèse des acides gras, de sorte que le ratio [NADP+]/[NADPH] << 1.
Bien que le NAD soit une coenzyme essentiellement catabolique sous forme oxydée NAD+, il intervient également dans certaines voies anaboliques, telles que la néoglucogenèse. Ce besoin en NADH pour l'anabolisme pose un problème aux procaryotes qui se nourrissent de nutriments qui ne libèrent que de petites quantités d'énergie. Par exemple, les bactéries nitrifiantes telles que Nitrobacter oxydent le nitrite NO2− en nitrate NO3−, ce qui libère suffisamment d'énergie pour pomper des protons et produire de l'ATP, mais pas assez pour produire du NADH directement. Ces bactéries sont par conséquent contraintes d'utiliser une nitrite réductase pour produire le complément d'énergie nécessaire à la production de NADH en remontant partiellement la chaîne respiratoire à contre-sens.
Fonctions non rédox



Le nicotinamide adénine dinucléotide est également consommé lors de réactions de transfert d'unités ADP-ribose. En effet, les ADP-ribosyltransférases sont des enzymes qui assurent ce type de transfert à des protéines nouvellement synthétisées, dans le cadre de modifications post-traductionnelles appelées ADP-ribosylation. L'ADP-ribosylation consiste aussi bien en un transfert d'un unique groupe ADP-ribosyle à une protéine, c'est-à-dire une mono(ADP-riobylation), ou en un transfert de nombreuses unités ADP-ribosyle en longues chaînes ramifiées, c'est-à-dire une poly(ADP-ribosylation). La mono(ADP-ribosylation) a été identifiée pour la première fois sur un groupe de toxines bactériennes, notamment la toxine cholérique, mais elle intervient également dans le cadre d'une signalisation cellulaire normale. La poly(ADP-ribosylation), quant-à-elle, est réalisée par des poly(ADP-ribose) polymérases. Les structures poly(ADP)-ribose interviennent dans la régulation de plusieurs processus cellulaires et sont particulièrement importantes dans le noyau par exemple dans la réparation de l'ADN et la maintenance des télomères. Outre ces fonctions intracellulaires, il existe également des ADP-ribosyltransférases extracellulaires, dont le rôle demeure cependant encore obscur. Le NAD+ peut également être ajouté à un ARN cellulaire comme modification de l'extrémité 5’.
Le NAD intervient également dans la signalisation cellulaire comme précurseur de l'ADP-ribose cyclique, produit à partir du NAD+ par des ADP-ribosyle cyclases (EC 3.2.2.6) dans le cadre d'un mécanisme par messager secondaire. Il agit en particulier sur le métabolisme du calcium en induisant la libération du calcium à partir de ses points de stockage intracellulaires en se liant à une classe de canaux calciques appelée récepteurs de la ryanodine qui sont situés dans la membrane d'organites tels que le réticulum endoplasmique.
Le NAD+ est également consommé par des sirtuines, comme la Sir2, qui sont des histone désacétylases NAD-dépendantes. Ces enzymes agissent en transférant des groupes acétyle sur la partie ADP-ribose du NAD+ depuis leur protéine substrat, ce qui clive la coenzyme en libérant du nicotinamide et de l’O-acétyl-ADP-ribose. Les siruines semblent impliquées essentiellement dans la régulation de la transcription à travers la désacétylation des histones et la modification de la structure du nucléosome. L'étude de l'activité de ces enzymes est particulièrement intéressante compte tenu de leur importance dans la régulation du vieillissement (sénescence). Les sirtuines sont également capables de désacétyler d'autres protéines que les histones.
Les ADN ligases bactériennes sont d'autres enzymes dépendantes du NAD. Elles utilisent en effet l'un des nucléotides constituant le NAD, en l'occurrence l'AMP, qu'elles transfèrent au phosphate de l'extrémité 5’ de l'un des brins d'ADN. Cet intermédiaire est ensuite attaqué par l'hydroxyle 3’ de l'autre brin d'ADN, ce qui donne une nouvelle liaison phosphodiester. Ce mécanisme diffère de celui utilisé par les eucaryotes, chez lesquels c'est l'ATP qui est utilisé comme donneur d'unité AMP pour former l'intermédiaire ADN-AMP.
Fonctions extracellulaires
Le NAD intervient également comme molécule de signalisation cellulaire impliquée dans la communication intercellulaire. Du NAD+ est libéré par des neurones dans les vaisseaux sanguins, la vessie, le gros intestin, de cellules neurosécrétrices et dans le cerveau au niveau des synaptosomes (en), et pourrait agir comme neurotransmetteur des nerfs vers des cellules effectrices des muscles lisses. Des recherches complémentaires sont encore nécessaires pour comprendre les mécanismes sous-jacents à ces fonctions extracellulaires du NAD et leur importance pour la santé et les maladies humaines.
Pharmacologie et utilisation médicale
Les enzymes qui produisent et qui utilisent le NAD+ et le NADH sont importantes à la fois en pharmacologie et du point de vue de la recherche de nouveaux traitements. La conception de médicaments nouveaux et leur développement utilise le NAD de trois façons différentes : directement comme cible de médicaments, en concevant des inhibiteurs ou des activateurs agissant sur les enzymes qui utilisent le NAD, et enfin en inhibant la biosynthèse du NAD.
Le NAD lui-même n'est utilisé comme traitement d'aucune maladie, mais a cependant été étudié pour son application éventuelle dans le traitement de maladies neurodégénératives telles que la maladie d'Alzheimer et la maladie de Parkinson. La preuve des bienfaits du NAD contre les maladies neurodégénératives est en discussion. Certaines études sur les souris ont donné des résultats prometteurs et des essais cliniques chez l'homme ont montré un effet sur la maladie de Parkinson, sur la fatigue chronique, sur la dépression, sur la maladie d'Alzheimer mais les résultats concernant la maladie de Parkinson sont discutés.
Le NAD est également la cible directe de l'isoniazide, un médicament utilisé dans le traitement de la tuberculose, infection à Mycobacterium tuberculosis. L'isoniazide est un promédicament activé par une peroxydase une fois dans la cellule bactérienne pour donner un radical libre. C'est ce radical qui réagit avec le NADH, produisant des adduits qui agissent comme inhibiteurs très puissants de l'énoyl-ACP réductase et de la dihydrofolate réductase. Une expérience conduite dans le cadre de recherches contre les effets du vieillissement (sénescence) a montré que la communication intracellulaire entre le noyau et les mitochondrie s'est améliorée chez la souris après absorption d'un supplément de NAD pendant une semaine.
Il est possible de concevoir des inhibiteurs fondés sur le NAD qui sont spécifiques à une enzyme précise, et ce bien qu'un grand nombre d'oxydoréductases utilisent le NAD comme coenzymes et se lient à lui avec une structure tridimensionnelle hautement conservée. C'est par exemple le cas des molécules à base d'acide mycophénolique et de tiazofurine, qui inhibent l'IMP déshydrogénase au niveau du site de liaison au NAD+ ; cette enzyme étant important pour le métabolisme des purines, ces composés peuvent être à la base de médicaments anticancéreux, antiviraux et immunosuppresseurs. D'autres médicaments agissent non pas comme inhibiteurs mais comme activateurs d'enzymes intervenant dans le métabolisme du NAD. Les sirtuines sont particulièrement intéressantes à cet égard compte tenu du fait que l'activation de ces enzymes de désacétylation accroît la durée de vie des organismes. Des composés tels que le resvératrol accroissent l'activité de ces enzymes, ce qui laisse entrevoir la possibilité de les utiliser pour retarder les effets du vieillissement à la fois d'organismes modèles vertébrés et invertébrés. La nicotinamidase, qui convertit le nicotinamide en acide nicotinique, fait également l'objet de recherches pharmaceutiques car cette enzyme, absente chez l'homme, est présente chez la levure et les bactéries.
En bactériologie, un supplément en NAD, appelé parfois facteur V, dans le milieu de culture peut être utilisé avec certaines bactéries fastidieuses.
Histoire
Le NAD+ a été découvert en 1906 par les biochimistes britanniques Arthur Harden et William John Young (en). Ils observèrent le fait qu'ajouter des extraits de levure bouillis et filtrés à des extraits de levure non bouillis accélérait significativement leur vitesse de fermentation. Ils appelèrent coferment la substance inconnue à l'origine de ce phénomène. À la suite d'un processus long et délicat de purification de ces extraits de levure, ils obtinrent un facteur thermostable dont la nature nucléotidique fut établie par le biochimiste suédois Hans von Euler-Chelpin. Le rôle de cette coenzyme dans les transferts d'ions hydrure fut établi en 1936 par l'Allemand Otto Heinrich Warburg, qui identifia également le résidu de nicotinamide comme étant le site de la réaction d'oxydoréduction.
Les précurseurs vitaminiques du NAD+ ont commencé à être identifiés en 1938 lorsque de Conrad Elvehjem (en) a montré que la nicotinamide présente dans le foie possède une action « anti langue noire » chez le chien affligé d'un syndrome apparenté à la pellagre, puis qu'il démontra que la niacine intervient dans la biosynthèse du NAD+, alors appelée « coenzyme I ». Au début des années 1940, Arthur Kornberg identifia la première enzyme de la biosynthèse du NAD+. Puis les biochimistes américains Morris Friedkin et Albert L. Lehninger (en) établirent en 1949 que le NADH assure l'intégration entre des voies métaboliques telles que le cycle de Krebs et la production d'ATP par la phosphorylation oxydative. Les différents métabolites et enzymes intervenant dans la biosynthèse du NAD+ furent établis en 1958 par Jack Preiss et Philip Handler, raison pour laquelle la voie de sauvetage à partir de l'acide nicotinique est appelée voie de Preiss-Handler. La voie de la nicotinamide riboside kinase a quant à elle été découverte en 2004 par Charles Brenner (en) et al..
Les fonctions non rédox du NAD+ et du NADP+ sont de découverte plus récente. La première d'entre elles à avoir été identifiée est l'utilisation du NAD+ comme donneur de groupe ADP-ribosedans les réactions d'ADP-ribosylation, observée au début des années 1960. Le métabolisme du NAD+ est resté un domaine d'intenses recherches jusqu'au XXIe siècle, avec un regain d'intérêt à la suite de la découverte des sirtuines en 2000.
Voir aussi
- Nicotinamide adénine dinucléotide phosphate
- Liste d'abréviations de biologie cellulaire et moléculaire