
Isotrétinoïne
| Isotrétinoïne | ||
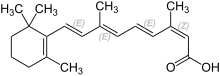
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide (2Z,4E,6E,8E)-3,7-diméthyl-9-(2,6,6-triméthylcyclohex-1-én-1-yl)nona-2,4,6,8-tétraénoïque | |
| Synonymes |
acide 13-cis-rétinoïque |
|
| No CAS | 4759-48-2 | |
| NoECHA | 100.022.996 | |
| No CE | 225-296-0 | |
| Code ATC | D10AD04, D10BA01 | |
| PubChem | 5282379 | |
| SMILES | ||
| InChI |
InChI : vue 3D InChI=1/C20H28O2/c1-15(8-6-9-16(2)14-19(21)22)11-12-18-17(3)10-7-13-20(18,4)5/h6,8-9,11-12,14H,7,10,13H2,1-5H3,(H,21,22)/b9-6+,12-11+,15-8+,16-14-/f/h21H |
|
| Propriétés chimiques | ||
| Formule |
C20H28O2 [Isomères] |
|
| Masse molaire | 300,435 1 ± 0,018 6 g/mol C 79,96 %, H 9,39 %, O 10,65 %, |
|
| Propriétés physiques | ||
| T° fusion | 172 à 175 °C | |
| Précautions | ||
| Directive 67/548/EEC | ||
|
Symboles : T : Toxique Phrases R : R61 : Risque pendant la grossesse d’effets néfastes pour l’enfant. R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette). S53 : Éviter l’exposition - se procurer des instructions spéciales avant l’utilisation. S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage. |
||
| Données pharmacocinétiques | ||
| Métabolisme | Foie | |
| Demi-vie d’élim. | 21 heures | |
| Excrétion |
Fèces et urine |
|
| Considérations thérapeutiques | ||
| Voie d’administration | Orale | |
| Grossesse | Contre-indiqué | |
| Unités du SI et CNTP, sauf indication contraire. | ||
|
modifier |
||
L'isotrétinoïne est une substance active médicamenteuse utilisée dans le traitement de l'acné. C'est un rétinoïde, c'est-à-dire un dérivé de la vitamine A présent naturellement dans le corps, produit par le foie en petite quantité. Il s'agit de la substance considérée comme la plus efficace[réf. à confirmer] contre l'acné, elle est généralement réservée afin de traiter les acnés sévères résistantes aux traitements antibiotiques associés à des topiques pendant 3 mois. L'isotrétinoïne est la substance active de divers médicaments comme Contracné, Curacné, Procuta ou Roaccutane.
|
Indiquée pour : Acné récalcitrant nodulaire grave |
|
Contre-indications : Grossesse et/ou Lactation |
|
Interactions : |
|
Effets secondaires : Grave : Cardiovasculaire : Nez, gorge et oreille : Endocrine : Œil : Gastro-intestinales : Hématologie : Muscle et/ou squelette : Neurologie : Psychologique : Respiratoire : Peau : Urogénital et reproduction : |
Indications
Acné sévère ayant résisté à tout autre traitement antiacnéique (antibiotique & topique). Traitement d'entretien du neuroblastome de haut risque.
Pharmacodynamie
Le mécanisme d'action de l'isotrétinoïne est mal connu. On évoque un effet anti-inflammatoire au niveau du derme, une modification des glandes sébacées et une suppression de leur activité.
Pharmacocinétique
Absorption
Orale (Roaccutane, Curacne, Procuta, ContreAcne) ou locale (Roaccutane Gel, Isotrex). Les aliments riches en matières grasses augmentent la biodisponibilité de la vitamine A et les aliments riches en calories facilitent l'absorption de la vitamine A.
Interactions
L'isotrétinoïne ne doit pas être administrée conjointement aux tétracyclines (hypertension intracrânienne) et ne doit pas être prescrite aux femmes enceintes. Il est également recommandé de ne pas trop s'exposer au soleil.
Historique
Le médicament a été à la base conçu pour les cancéreux traités par chimiothérapie. Dans les années 1970, le laboratoire Hoffmann-La Roche commença un programme de synthèse de rétinoïdes dans le but de réduire leurs effets secondaires. W. Bollag eut l'idée d'utiliser l'isomère 13-cis de l'acide rétinoïque. Celui-ci présente une efficacité thérapeutique dans des cas d'acnés vulgaires et sévères et des effets secondaires réduits par rapport à l'acide rétinoïque. Cette molécule, l'isotrétinoïne, fut commercialisée en 1982 pour le traitement des acnés sévères par voie orale.
Dates clés dans l'histoire de l'isotrétinoïne
1971 : Roche développe le Roaccutane, appelé Accutane aux États-Unis et au Canada.
1982 : la Food and Drug Administration (FDA) autorise le Roaccutane pour soigner les formes sévères d'acné ayant résisté à d'autres traitements.
1986 : Roche change la notice d'emballage du Roaccutane pour signaler que des utilisateurs ont rapporté des symptômes de dépression.
1988 : Public Citizen pétitionne la FDA pour une interdiction du Roaccutane.
1997 : les instances françaises de régulation exigent de Roche d'indiquer le suicide comme un effet secondaire possible.
Février 1998 : la FDA informe que la notice d'emballage du Roaccutane devra inclure un avertissement disant que des utilisateurs ont rapporté des réactions adverses incluant la dépression, des syndromes psychotiques et « rarement des idées de suicide, des tentatives de suicide et le suicide ».
: les instances anglaises et irlandaises de régulation[Lesquelles ?] exigent un avertissement sur le risque de troubles psychiatriques produits par Roaccutane [réf. souhaitée].
Décembre 1999 : Roche présente à la FDA un rapport sur les troubles psychiatriques, concluant qu'aucun des 168 constats de comportement suicidaire ne peut être directement lié à Roaccutane.
Mai 2000 : Roche change la notice d'emballage du Roaccutane et inclut les effets indésirables possibles de la dépression, rarement des pensées suicidaires, des tentatives de suicide et du suicide.
Septembre 2000 : durant une audition devant le Comité consultatif dermatologique et ophtalmologique de la FDA, un des médecins intervenants (invité par la FDA et non par le laboratoire Roche) indique qu'entre 1982 et 2000, la FDA a reçu des rapports faisant état de 37 cas de suicide chez des personnes traitées par Roaccutane (24 cas) ou venant d'arrêter le traitement (13 cas). Il fait également état pendant la même période de 110 cas d'hospitalisation pour dépression, idées suicidaires ou tentatives de suicide.
: les Archives de dermatologie (Archives of Dermatology) publient une recherche financée par Roche. L'étude porte sur 20 895 patients souffrant d'acné qui prennent soit Roaccutane (7 195) soit des antibiotiques (13 700) ; elle n'a trouvé aucun lien entre le Roaccutane et le risque accru de dépression, de suicide ou d'autres troubles psychiatriques.
: l'information du Roaccutane est changée pour prévenir de la dépression, de syndromes psychotiques et, « rarement, d'idées de suicide, de tentatives de suicide, de suicide et de comportements agressifs ou violents. »
Septembre 2003 : le Journal de l'Académie américaine de dermatologie (Journal of the American Academy of dermatology) publie une étude financée par Roche, qui n'a trouvé aucun accroissement significatif des prescriptions d'antidépresseurs chez les patients déjà sous Roaccutane.
: David Graham, scientifique de la FDA, dit à une commission d'enquête du Sénat des États-Unis que le médicament devrait être étudié pour son retrait possible.
: la FDA exige un test de grossesse et que celui-ci soit négatif avant de prescrire le médicament.
2007 : Création de l’Association des victimes du Roaccutane et génériques (AVRG) en France par Daniel Voidey.
2008 : Le Roaccutane est retiré du marché français, mais la molécule d'isotrétinoïne est toujours vendue sous forme de générique.
2015 : fin , l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) restreint les prescriptions initiales d’isotrétinoïne aux seuls dermatologues, les médecins généralistes pourront en revanche effectuer le suivi des patients.
| Isotrétinoïne (formes orales) | |
| Informations générales | |
|---|---|
| Princeps |
(pas pendant la grossesse ni le mois précédent) |
| Classe | Rétinoïde |
| Identification | |
| No CAS | 4759-48-2 |
| NoECHA | 100.022.996 |
| Code ATC | D10AD04 et D10BA01 |
| DrugBank | 00982 |
|
modifier |
|
| Isotrétinoïne (usage externe) | |
| Informations générales | |
|---|---|
| Princeps |
(pas pendant la grossesse) |
| Classe | Rétinoïde |
| Identification | |
| No CAS | 4759-48-2 |
| NoECHA | 100.022.996 |
| Code ATC | D10AD04 et D10BA01 |
| DrugBank | 00982 |
|
modifier |
|
Effets secondaires
De nombreux effets secondaires et indésirables constatés ou attendus chez les patients traités par isotrétinoïne sont similaires à ceux décrits chez les patients prenant de fortes doses de vitamine A (hypervitaminose A).
Les effets secondaires les plus fréquents touchent les muqueuses, les plus courants sont les suivants : douleurs et gonflement des lèvres (96 %), éruption cutanée sur le visage (55 %), nez sec (51 %), desquamation de la peau (50 %), démangeaisons (30 %), peau sèche (22 %), yeux rouges (19 %), chute de cheveux (13 %), irritation des yeux (11 %), éruption cutanée (< 10 %). Une sécrétion de sueur accrue et parfois persistante. Une sécheresse à l'intérieur du nez peut être associée à une légère hémorragie. Une inflammation des yeux légère à modérée peut être soulagée par une pommade ophtalmique. Dans de rares cas : chute de cheveux persistante après traitement, apparition d'angiomes (taches rouges).
De même on remarquera parfois des vertiges ainsi que diverses douleurs au début du traitement durant 1 à 2 jours. Environ 13 % des patients souffrent de douleurs articulaires pendant le traitement.
On peut aussi remarquer une desquamation de la peau de la paume des mains et de la plante des pieds, des infections de la peau, une sensibilité accrue aux coups de soleil, des symptômes urogénitaux non spécifiques, des symptômes gastriques non spécifiques, des maux de tête, une fatigue chez environ 5 % des patients. Une baisse de la vision nocturne a également été rapportée et a persisté dans de rares cas. Des cas de cataracte et de troubles de la vision ont également été signalés.
L'isotrétinoïne est également associée à des effets secondaires sexuels, à savoir une dysfonction érectile et une diminution de la libido.
Effets sur la croissance : un guide approuvé par la FDA en 2010 rapporte que l'isotrétinoïne « peut arrêter définitivement la croissance des os longs chez les adolescents qui n'ont pas fini de grandir » même si le médicament est donné à des doses indiquées pour le traitement de l'acné. Il existe plusieurs rapports spontanés de cas semblables (voir (en) Isotretinoin, notes 36 à 40). Dans la littérature rédigée en français, cet effet secondaire est aussi signalé mais sous une forme moins claire pour le grand public : il est fait mention de soudure prématurée des cartilages épiphysaires. La notice du Procuta mentionne : « Les os qui n'ont pas terminé leur développement pourraient interrompre prématurément leur croissance ».
La prise d'isotrétinoïne est associée à l'apparition de la maladie de Crohn.
Effets psychologiques
L'isotrétinoine peut provoquer de l'anxiété, de l'agressivité, des changements d'humeur et des crises de paniques. Un autre aspect psychologique important concerne les syndromes dépressifs pouvant conduire au suicide. Des cas sous isotrétinoïne ont été rapportés mais il n'est pas clair qu'il s'agit d'un effet secondaire du médicament ou s'ils sont liés au terrain. Un certain nombre d'études n'ont pas montré un taux de suicide ou de dépression plus important chez les patients traités. C'est le cas en Grande-Bretagne et au Canada, en Finlande et aux États-Unis. Une étude canadienne semble montrer une association entre la prise d'isotrétinoïne et le syndrome dépressif. Une étude suédoise trouve également cette corrélation mais le taux de suicide augmente avant même l'introduction du traitement, ce qui rend le lien de causalité délicat à établir. En 2019, une enquête a toutefois été rouverte au Royaume-Uni.
Tératogénicité
L'isotrétinoïne est tératogène. Environ 25 % des enfants exposés in utero à l'isotrétinoïne prise par voie orale au cours du premier trimestre de la grossesse sont atteints d'un syndrome polymalformatif associant des atteintes craniofaciales, cardiaques et du système nerveux central . Chez la femme en âge de procréer, une contraception efficace doit être débutée un mois avant le traitement et poursuivie un mois après son arrêt. Les règles de prescription médicale et de délivrance pharmaceutique de l'isotrétinoïne sont extrêmement strictes. Cependant, en France en 2008, une enquête relevait que 15 % seulement des patientes traitées par isotrétinoïne avaient bénéficié d'une stricte application de la règlementation (ordonnance conforme, information complète reçue et appliquée, délai respecté entre la prescription et la dispensation, ainsi que la contraception effective).
Voir aussi
Articles connexes
Liens externes
- Compendium suisse des médicaments : spécialités contenant isotrétinoïne
- Le site d'information de la SFD avec plus d'info sur l'acné et l'isotrétinoïne
- Un documentaire de la télé suisse dénonçant les effets psychiques et psychiatriques du médicament
