Inhibiteur compétitif
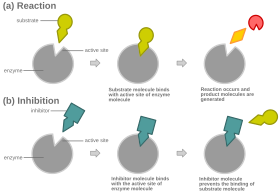
Un inhibiteur compétitif est un inhibiteur enzymatique qui agit en se liant à un site actif libre d'une enzyme à la place d'un substrat, ce qui bloque la réaction normalement catalysée par l'enzyme.
La plupart des inhibiteurs compétitifs agissent en se liant de manière réversible au site actif de l'enzyme, ce qui conduit souvent à des simplifications excessives dans la description du phénomène ; en réalité, il existe de nombreux mécanismes par lesquels une enzyme peut se lier à un substrat, à un inhibiteur, mais pas aux deux en même temps. Par exemple, les inhibiteurs allostériques peuvent exercer une inhibition compétitive, non compétitive ou incompétitive.
Mécanisme de compétition
Dans le cas d'une inhibition compétitive, une enzyme peut, à chaque instant, être liée à son substrat, à son inhibiteur compétitif, ou à aucun d'entre eux, mais ne peut pas être liée à la fois à son inhibiteur et à son substrat.
Un inhibiteur compétitif peut se lier à un site allostérique de l'enzyme libre et empêcher de ce fait l'enzyme de se lier au substrat tant qu'il y demeure. C'est par exemple le cas de la strychnine, qui agit comme inhibiteur allostérique du récepteur de la glycine (en) de la moelle épinière et du tronc cérébral des mammifères. La glycine est un important neurotransmetteur inhibiteur post-synaptique qui se lie à un site spécifique sur son récepteur ; la strychnine se lie à un autre site de ce récepteur, ce qui a pour effet de réduire l'affinité du récepteur pour la glycine, ce qui déclenche des convulsions dues à l'insuffisance de l'inhibition par la glycine.
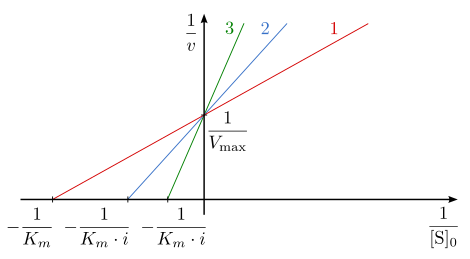
La vitesse maximum Vmax d'une enzyme demeure inchangée sous l'effet d'une inhibition compétitive, en revanche la constante de Michaelis KM augmente en raison de la réduction d'affinité de l'enzyme pour son substrat à la suite de l'action de l'inhibiteur. L'action d'un inhibiteur compétitif peut être surmonté par une élévation de la concentration en substrat, qui peut ainsi saturer le site actif de l'enzyme à la place de l'inhibiteur.