Dioxyde de carbone
| Dioxyde de carbone | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Structure du dioxyde de carbone. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | Dioxyde de carbone | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes |
Gaz carbonique, anhydride carbonique |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 124-38-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA | 100.004.271 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 204-696-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Code ATC | V03AN02 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 280 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 16526 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No E | E290 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | Gaz comprimé liquéfié, incolore et inodore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule |
CO2 [Isomères] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire | 44,009 5 ± 0,001 4 g/mol C 27,29 %, O 72,71 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −78,48 °C (sublimation à 760 mmHg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | −56,6 °C (5,12 atm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | dans l'eau à 20 °C : 88 ml/100 ml sous 1 bar de CO2, soit 1,69 g/kg d'eau (3,35 g à 0 °C, 0,973 g à 40 °C et 0,576 g à 60 °C) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique |
1,87 kg m−3 (gaz à 15 °C 1,013 bar) plus dense que l'air équation :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante |
5 720 kPa (20 °C) 569,1 mmHg (−82 °C) ; équation :

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosité dynamique | 0,07 mPa s à −78 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 31,3 °C ; 72,9 atm et 0,464 g cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | −56,6 °C à 5,11 atm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 3,840 × 10−5 cal cm−1 s−1 K−1 à 20 °C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 259 m s−1 (0 °C,1 atm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ΔfH0gaz | −393,52 kJ mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp |
équation :
équation :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés électroniques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re énergie d'ionisation | 13,773 ± 0,002 eV (gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe cristalline ou groupe d’espace | P42/mnm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètres de maille |
a = 3,535 Å b = 3,535 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 51,73 Å3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction |
 1,000 45 (1 atm) 1,000 45 (1 atm)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
H280, P403 et P410
H280 : Contient un gaz sous pression ; peut exploser sous l'effet de la chaleur P403 : Stocker dans un endroit bien ventilé. P410 : Protéger du rayonnement solaire. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A,
A : Gaz comprimé température critique = 31,1 °C Divulgation à 1,0 % selon la liste de divulgation des ingrédients |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 20 : gaz asphyxiant ou qui ne présente pas de risque subsidiaire Numéro ONU : 1013 : DIOXYDE DE CARBONE Classe : 2.2 Code de classification : 2A : Gaz liquéfié, asphyxiant ; Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  9.1
Code Kemler : 22 : gaz liquéfié réfrigéré, asphyxiant Numéro ONU : 2187 : DIOXYDE DE CARBONE LIQUIDE RÉFRIGÉRÉ Classe : 2.2 Code de classification : 3A : Gaz liquéfié réfrigéré, asphyxiant ; Étiquettes :  2.2 : Gaz ininflammables, non toxiques (correspond aux groupes désignés par un A ou un O majuscule);  9.1
Code Kemler : - Numéro ONU : 1845 : DIOXYDE DE CARBONE SOLIDE ; ou NEIGE CARBONIQUE Classe : 9 Code de classification : M11 : Autres matières qui présentent un risque pendant le transport mais qui ne correspondent à la définition d'aucune autre classe. Étiquettes :  9 : Matières et objets dangereux divers  9.1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO2, la molécule ayant une structure linéaire de la forme O=C=O. Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.
Le CO2 est utilisé par l'anabolisme des végétaux pour produire de la biomasse à travers la photosynthèse, processus qui consiste à réduire le dioxyde de carbone par l'eau, grâce à l'énergie lumineuse reçue du Soleil et captée par la chlorophylle, en libérant de l'oxygène pour produire des oses, et en premier lieu du glucose par le cycle de Calvin. Le CO2 est libéré, à travers le cycle de Krebs, par le catabolisme des plantes, des animaux, des fungi (mycètes, ou champignons) et des micro-organismes. Ce catabolisme consiste notamment à oxyder les lipides et les glucides en eau et en dioxyde de carbone grâce à l'oxygène de l'air pour produire de l'énergie et du pouvoir réducteur, sous forme respectivement d'ATP et de NADH + H+. Le CO2 est par conséquent un élément fondamental du cycle du carbone sur notre planète. Il est également produit par la combustion des énergies fossiles telles que le charbon, le gaz naturel et le pétrole, ainsi que par celle de toutes les matières organiques en général. C'est un sous-produit indésirable dans les processus industriels à grande échelle.
Des quantités significatives de CO2 sont par ailleurs rejetées par les volcans et autres phénomènes géothermiques tels que les geysers.
En janvier 2021, l'atmosphère terrestre comportait 415,13 ppmv (parties par million en volume) de CO2, soit 0,04153 %. Cette teneur était de 283,4 ppmv en 1839 d'après des carottes de glace prélevées dans l'Antarctique, soit une augmentation globale d'environ 46 % en 182 ans.
Le CO2 est un gaz à effet de serre majeur, transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu'il tend à bloquer la réémission vers l'espace de l'énergie thermique reçue au sol sous l'effet du rayonnement solaire. Il est responsable d'environ 26 % de l'effet de serre à l'œuvre dans l'atmosphère terrestre (la vapeur d'eau en assurant 60 %) ; l'augmentation de sa concentration est en partie responsable du réchauffement climatique constaté à l'échelle de notre planète depuis les dernières décennies du XXe siècle. Par ailleurs, l'acidification des océans résultant de la dissolution du dioxyde de carbone atmosphérique pourrait compromettre la survie de nombreux organismes marins avant la fin du XXIe siècle.
Caractéristiques physico-chimiques
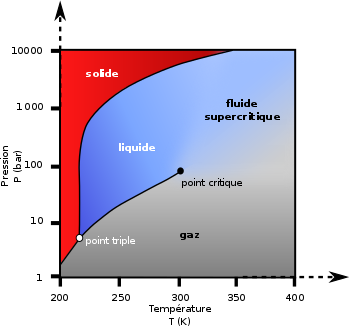
À pression atmosphérique, il se sublime à −78,5 °C (passage de l'état solide à l'état gazeux), mais ne fond pas (passage de l'état solide à l'état liquide).
La phase liquide ne peut exister qu'à une pression minimale de 519 kPa (soit 5,12 atm), et dans un intervalle de température allant de −56,6 °C (point triple) à 31,1 °C au maximum à 7,38 MPa (soit 72,8 atm) (point critique).
|
Pression de vapeur saturante
|
| Transition | Température | Chaleur latente |
|---|---|---|
| Vaporisation | 0 °C | 234,5 kJ kg−1 |
| Vaporisation | −16,7 °C | 276,8 kJ kg−1 |
| Vaporisation | −28,9 °C | 301,7 kJ kg−1 |
| Fusion | −56,6 °C | 199 kJ kg−1 |
Il existerait au moins cinq phases solides moléculaires (existant à « basse » pression, moins de 30 à 60 GPa) et trois phases solides polymériques (aux pressions plus élevées) du CO2 :
- phases moléculaires :
- I : la « glace sèche », jusqu'à 800 K et 11-12 GPa
- II : entre 400 et 5-600 K et une pression de 12 à environ 50 GPa
- III : au-delà de 12 GPA et moins de 500 K
- IV : au-delà de 11 GPa et plus de 500 K
- VII : de 600 à 900 K (jusqu'à 1000 K en incluant la partie supercritique) et 11 à 20 GPa
- phases polymériques :
- V : plus de 30 GPa et plus d'environ 1 300 K
- VI : température comprise entre environ 500 K et 1 300 K et pression supérieure à de 30 (à 1300 K) à 50 GPa (à 500 K)
- amorphe, à moins de 500 K et plus de 50 GPa
Solubilité aqueuse
Le CO2 se dissout dans l’eau et y forme de l’acide carbonique H2CO3 :
CO2 (aq) + H2O (l) 
Il est également liposoluble (soluble dans les corps gras).
L’acide carbonique n’est que modérément stable et il se décompose facilement en H2O et CO2. En revanche, lorsque le dioxyde de carbone se dissout dans une solution aqueuse basique (soude, potasse…), la base déprotone l’acide carbonique pour former un ion hydrogénocarbonate HCO–
3, aussi appelé ion bicarbonate, puis un ion carbonate CO2–
3. De cette façon, la solubilité du CO2 est considérablement augmentée. Le carbonate de potassium K2CO3 a par exemple une solubilité de 1,12 kg/l d'eau à 20 °C.
C'est ainsi que le calcaire se dissout dans l'eau, dans la plage de pH dans laquelle l'hydrogénocarbonate acide est stable, en produisant une solution d'hydrogénocarbonate(s) (de calcium et de magnésium…). Il est donc susceptible de précipiter lorsque le CO2 dissous est dégazé, comme dans la formation des stalagmites et des stalactites. Le calcaire a ainsi, en présence de CO2, une solubilité qui diminue quand la température augmente, à l'instar des gaz et au contraire de la plupart des solides (dont la solubilité augmente généralement avec la température).
Dans certaines conditions (haute pression + basse température) le CO2 peut être piégé dans des cages d'eau dites clathrates. C'est un des moyens possibles de séparation industrielle du CO2 contenu dans un gaz en pré- ou post-combustion. C'est aussi un des moyens envisagés de séquestration industrielle de CO2 ou de stockage géologique étudié, éventuellement corrélativement à la désalinisation d'eau de mer (il peut théoriquement même être substitué à l'hydrate de méthane).
Historique des connaissances

Le dioxyde de carbone est l'un des premiers gaz (avec la vapeur d'eau) à avoir été décrit comme étant une substance distincte de l'air. Au XVIIe siècle, le chimiste et médecin flamand Jean-Baptiste Van Helmont observa qu'en brûlant du charbon de bois en vase clos, la masse des cendres résultantes est inférieure à celle du charbon. Son interprétation était que la masse manquante s'était transmutée en une substance invisible qu'il nomme « gas » ou spiritus sylvestre (« esprit sauvage »).
Les propriétés du dioxyde de carbone furent étudiées plus en détail dans les années 1750 par le chimiste et physicien écossais Joseph Black. Il découvrit qu'en chauffant ou en versant un acide sur du calcaire (roche composée de carbonate de calcium), il en résultait l'émission d'un gaz, qu'il nomma « air fixe », mettant à mal la théorie du phlogiston encore enseignée à cette époque. Il observa que celui-ci est plus dense que l'air et qu'il ne peut ni entretenir une flamme, ni la vie d'un animal. Black découvrit également que lorsque le dioxyde de carbone est introduit dans une solution calcaire (hydroxyde de calcium), il en résulte un précipité de carbonate de calcium. Il utilisa ce phénomène pour illustrer le fait que le dioxyde de carbone est produit par la respiration animale et la fermentation microbienne.
En 1772, le chimiste anglais Joseph Priestley publia un ouvrage intitulé Impregnating Water with Fixed Air dans lequel il décrivit un processus consistant à verser de l'acide sulfurique (ou « huile de vitriol » comme on la nommait à cette époque) sur de la craie afin de produire du dioxyde de carbone, puis forçant le gaz à se dissoudre dans un bol d'eau. Il venait d'« inventer » l'eau gazeuse. Le procédé est ensuite repris par Johann Jacob Schweppe qui fonda, en 1790, à Londres une usine de production de soda connue sous le nom de Schweppes.
En 1781, le chimiste français Antoine Lavoisier mit en évidence le fait que ce gaz est le produit de la combustion du carbone avec le dioxygène.
Le dioxyde de carbone fut liquéfié pour la première fois en 1823 par Humphry Davy et Michael Faraday. La première description du dioxyde de carbone en phase solide fut écrite par Adrien Thilorier, qui en 1834 ouvrit un container pressurisé de gaz carbonique liquéfié et découvrit que le refroidissement produit par la rapide évaporation du liquide générait de la « neige » de CO2.
Utilisations
Le dioxyde de carbone est commercialisé sous différentes formes pour des usages variés, dans un marché dominé par des grandes entreprises comme Messer, Air liquide et Air Products. Pour l'industrie agro-alimentaire, la norme de référence en Europe est éditée par l'European Industrial Gases Association (de) (association européenne des gaz industriels). En France, elle représente 70 % de la consommation.
L'Agence internationale de l'énergie a publié en septembre 2019 un rapport sur les utilisations du CO2, qu'il évalue à 230 Mt/an, dont 130 Mt/an pour la fabrication d'engrais et 80 Mt/an pour la récupération assistée de pétrole et de gaz naturel. L'objectif de ce rapport est d'évaluer leur potentiel de contribution à la compensation des émissions de CO2. Il conclut que ce potentiel est faible à court terme, et restera à long terme très inférieur à celui de la capture et séquestration du dioxyde de carbone ; les pistes les plus prometteuses sont les utilisations dans les matériaux de construction, dans la fabrication de polymères et dans les serres.
Sous forme gazeuse
Le CO2 a de nombreuses utilisations, dont :
- l’extinction des feux : beaucoup de centres de données (salles de serveurs d’ordinateurs) ou de salles d'archives sont équipés d’un système qui, en cas d’incendie, remplit la salle de CO2 ce qui a pour effet d’éteindre le feu ;
- composant pétillant dans les boissons gazeuses ;
- en aquariophilie et culture sous serre pour une meilleure croissance des plantes ;
- en emballages à atmosphère contrôlée comme élément neutralisant ;
- en distribution d’eau potable, associé au carbonate, pour relever la dureté de l'eau (TH) des eaux trop agressives ;
- solubilisation du calcaire dans les eaux dures (TH supérieur à 25 °F) ;
- les pompes à bière : en étant en contact avec la surface de la bière, il évite son oxydation et prolonge sa conservation, contrairement à un compresseur utilisant de l'air (ambiant) ;
- on se sert aussi parfois du CO2 dans les grands abattoirs de porcs afin de les insensibiliser avant de les saigner ; il a été utilisé pour la conservation de la viande ;
- composant nécessaire au phénomène de photosynthèse qui permet aux végétaux de croître en transformant les matières inorganiques en matières organiques constituant ainsi leur bois ;
- fluide caloporteur dans certains types de réacteurs nucléaires tels que ceux de la filière UNGG en France ;
- il est utilisé de par sa diffusibilité (aptitude à se diffuser) pour la création du pneumopéritoine lors des cœlioscopies.
Sous forme liquide
Sous forme liquide, il est utilisé comme :
- réfrigérant pour congeler certains aliments ;
- réfrigérant dans l’industrie électronique ;
- agent d’extinction dans les extincteurs dits « au dioxyde de carbone », on parle parfois de neige carbonique parce qu'une partie du CO2 liquide se solidifie immédiatement à la sortie de l’extincteur en produisant une poudre blanche en mélange avec du dioxyde de carbone gazeux ;
- agent propulseur (et parfois également carbonatant) pour les boissons servies à la pression.
Quand il est utilisé comme fluide frigorigène, le CO2 porte la dénomination de nomenclature industrielle « R744 ». Son utilisation comme fluide frigorigène tend à se démocratiser ces dernières années : il est considéré comme « frigorigène naturel », et son potentiel de réchauffement global est très faible comparé aux fluides frigorigènes « traditionnels ».
À pression atmosphérique, le dioxyde de carbone n’est jamais sous forme liquide. Il passe directement de la forme solide à la forme gazeuse (sublimation).
Sous forme solide

Le dioxyde de carbone sous forme solide a de nombreuses appellations : « glace carbonique », « neige carbonique », « Carboglace », « glace sèche ». Il est issu de la solidification du CO2 liquide. On obtient de la neige carbonique qui est ensuite comprimée pour obtenir de la glace carbonique.
Dans sa phase solide, cette glace carbonique se sublime en ne laissant aucun résidu, avec une enthalpie de sublimation de 573 kJ kg−1 (soit 25,2 kJ mol−1), à −78,5 °C et à 1 atm. On lui a donc rapidement trouvé de multiples utilisations en tant que réfrigérant.
Il est commercialisé sous différentes présentations selon son usage :
- en granules (de la taille d'un grain de riz de 3 mm de diamètre) : essentiellement pour le nettoyage et le décapage cryogénique ;
- en bâtonnets (d'une longueur d'environ 16 mm) :
- pour la conservation, le transport des produits sous température dirigée (produits pharmaceutiques, transport de surgelés, transport d'échantillons, etc.),
- dans l'évènementiel : la glace carbonique dans l'eau forme un brouillard très dense qui glisse le long des parois du contenant ;
- pour la recherche fondamentale ou appliquée, par exemple :
- en chimie, comme réfrigérant en mélange avec un solvant organique (le plus souvent l'acétone) afin de mieux conduire la chaleur, plus rarement comme réactif. Dans ce domaine, on utilise le terme de « Carboglace » en France, ou juste « carbo » dans le langage parlé, et jamais le terme « glace sèche » qui est par contre privilégié au Québec ;
- pour la vinification : il ralentit la fermentation et évite l'oxydation ;
- en plaquette ou en blocs :
- pour le ravitaillement aérien (catering), les traiteurs, les pompes funèbres, etc. ;
- en pains :
- pour faire du brouillard épais (effets spéciaux, cinéma, vidéo).
Le dioxyde de carbone solide est également présent sous forme de neige carbonique aux pôles de la planète Mars, où il couvre pendant l'hiver local les calottes glaciaires (composées d'eau très majoritairement) et leurs périphéries, ainsi que sous forme de givre carbonique à plus basse latitude, en fin de nuit au début des printemps locaux (photographies prises par les atterrisseurs Viking, le rover Sojourner, l’atterrisseur Phoenix, et de nombreuses images HRSC). Des dépôts importants en sont géologiquement séquestrés au pôle sud.
En phase supercritique
Au-delà de son point critique, le dioxyde de carbone entre dans une phase appelée supercritique. La courbe d'équilibre liquide-gaz est interrompue au niveau du point critique, assurant à la phase supercritique un continuum des propriétés physico-chimiques sans changement de phase. C'est une phase aussi dense qu'un liquide mais assurant des propriétés de transport (viscosité, diffusion) proches de celles d'un gaz. Le dioxyde de carbone supercritique est utilisé comme solvant vert, les extraits étant exempts de trace de solvant.
Sous cette forme, il sert comme :
- agent d'extraction :
- décaféination du café,
- élimination de la 2,4,6-trichloroanisole (TCA) des bouchons de liège traités au chlore (ou à l'hypochlorite) pour éviter de donner un goût bouchonné au vin après sa mise en bouteille,
- extraction de composés chimiques ou biologiques,
- purification de composés chimiques (phase mobile en chromatographie, notamment en SFC) ;
- agent de transport et de stockage lors de la séquestration géologique du dioxyde de carbone (dans de rares applications industrielles) ;
- agent de refroidissement pour permettre la micronisation de principes actifs.
Sous-produit de processus industriels
C'est un sous-produit de processus industriels à grande échelle. Un exemple est la production d'acide acrylique qui est produit dans une quantité de plus de cinq millions de tonnes par an. Le défi dans le développement de ces procédés est de trouver un catalyseur et des conditions de procédé appropriés qui maximisent la formation du produit et minimisent la production de CO2.
Réactivité
Le dioxyde de carbone est une molécule très stable, avec une enthalpie standard de formation de −393,52 kJ mol−1. Le carbone présente une charge partielle positive, ce qui rend la molécule faiblement électrophile. Par exemple, un carbanion peut réaliser une addition nucléophile sur le CO2 et former un acide carboxylique après hydrolyse. Par ailleurs, le CO2 peut être utilisé pour former des carbonates organiques, par addition sur des époxydes.
Enfin, le CO2 peut être réduit, par exemple en monoxyde de carbone, acide formique, formaldéhyde, méthanol ou methane. La réaction implique un réducteur - dihydrogène, électrons ou hydrures - et le plus souvent un catalyseur métallique. Idéalement, ces catalyseurs doivent être sélectifs pour la réduction du CO2 en un produit unique. Le cuivre et le platine sont des catalyseurs hétérogènes efficaces pour l’hydrogénation du CO2 en méthanol. Quand les électrons sont apportés à un catalyseur moléculaire par une électrode, on cherche à identifier des catalyseurs qui minimisent la surtension nécessaire à la réaction, et à éviter la production compétitive d'hydrogène. Des porphyrines de fer peuvent être utilisée pour réduire le CO2 en CO. Des systèmes moléculaires artificiels permettent de mimer la photosynthèse en couplant l'absorption de lumière à un transfert d'électrons vers un catalyseur de réduction du CO2. Certaines métalloenzymes (CO-déshydrogenase, formate déshydrogénase) utilisent des cofacteurs à base de nickel, fer ou molybdène pour catalyser sélectivement, rapidement et presque sans surtension la réduction du CO2.
Toxicité
L'air extérieur contient, en 2019, environ 0,04 % de CO2 (412 ppm en janvier 2019).
À partir d'une certaine concentration dans l'air, ce gaz s'avère dangereux voire mortel à cause du risque d'asphyxie ou d'acidose, bien que le CO2 ne soit pas chimiquement toxique. La valeur limite d'exposition est de 3 % sur une durée de quinze minutes. Cette valeur ne doit jamais être dépassée. Au-delà, les effets sur la santé sont d'autant plus graves que la teneur en CO2 augmente. Ainsi, à 2 % de CO2 dans l'air, l'amplitude respiratoire augmente. À 4 % (soit 100 fois la concentration actuelle dans l’atmosphère), la fréquence respiratoire s'accélère. À 10 %, peuvent apparaître des troubles visuels, des tremblements et des sueurs. À 15 %, c'est la perte de connaissance brutale. À 25 %, un arrêt respiratoire entraîne la mort.
L'inhalation de dioxyde de carbone concentré entraîne un blocage de la ventilation, parfois décrit comme une violente sensation d'étranglement, un souffle coupé, une détresse respiratoire ou encore une oppression thoracique, pouvant rapidement mener à la mort si l'exposition est prolongée.
Des études signalent selon l'ANSES « des concentrations associées à des effets sanitaires intrinsèques du CO2 (seuil à environ 10 000 ppm correspondant à l'apparition d'une acidose respiratoire (baisse du pH sanguin), premier effet critique du CO2) ». Une acidose respiratoire peut survenir dès 1 % (10 000 ppm) de CO2 dans l'air, s'il est respiré durant trente minutes ou plus par un adulte en bonne santé avec une charge physique modérée, et probablement plus tôt chez des individus vulnérables ou sensibles. Ces taux « sont supérieurs aux valeurs limites réglementaire et/ou normative de qualité du renouvellement d'air en France et au niveau international, qui varient usuellement entre 1 000 et 1 500 ppm de CO2 ». Une petite étude expérimentale (ayant concerné 22 adultes) a conclu à un effet du CO2 sur la psychomotricité et la fonction intellectuelle (prise de décision, résolution de problèmes) dès de 1 000 ppm (étude de Satish et al., 2012), mais cette étude doit être confirmée par des travaux ayant une puissance statistique plus élevée. L'ANSES note qu'il y a finalement peu d'études épidémiologiques sur ce gaz commun, dont sur d'éventuels effets CMR (cancérigènes, mutagènes et reprotoxiques).
Le dioxyde de carbone étant un gaz incolore et lourd s'accumulant en nappes, il est difficilement détectable par une personne non expérimentée.
Dans l'air intérieur
Les humains passent de plus en plus de temps en atmosphère confinée (environ 80-90 % du temps dans un bâtiment ou un véhicule). Selon l'ANSES et divers acteurs en France, le taux de CO2 dans l'air intérieur des bâtiments (lié à l'occupation humaine ou animale et à la présence d'installations de combustion), pondéré par le renouvellement de l'air, est « habituellement compris entre 350 et 2 500 ppm environ ».
Dans les logements, les écoles, les crèches et les bureaux, il n'y a pas de relations systématiques entre les taux de CO2 et d'autres polluants, et le CO2 intérieur n'est statistiquement pas un bon prédicteur de polluants liés au trafic routier (ou aérien...) extérieur. Le CO2 est le paramètre qui change le plus vite (avec l'hygrométrie et le taux d'oxygène quand des humains ou des animaux sont rassemblés dans une pièce fermée ou mal aérée. Dans les pays pauvres de nombreux foyers ouverts sont sources de CO2 et de CO émis directement dans le lieu de vie.
Dans les écoles
Séjourner toute la journée dans un air dont le taux de CO2 atteint ou dépasse 600 ppm dégrade nos capacités cognitives (penser, raisonner, se souvenir, décider). Selon une étude publiée dans Environmental Health Perspectives, de faibles variations du taux de CO2 dans l'air affectent fortement nos capacités de pensée complexe et de prise de décision. Ce taux de 600 ppm est souvent atteint dans l'air intérieur où il dépasse souvent 1 000 ppm, plusieurs fois par jour avec par exemple une teneur moyenne de 3 110 mg/m3 de CO2 dans les salles de classes étudiées ; au détriment des capacités d'apprentissage des enfants.
Une étude menée dans 150 salles de classe pendant la pandémie de Covid-19 a montré que la qualité de l'air est insuffisante et augmente le nombre de contaminations par le coronavirus. Il est donc très important d'aérer régulièrement les salles de classe, même pendant l'hiver. Dans 60 % des salles de classe, la teneur en CO2 est supérieure à 2 000 ppm, des concentrations qui nuisent aux performances cognitives et donc à la capacité d'apprentissage. Dans les écoles à haut risque, le taux de CO2 moyen dépasse souvent 3 000 ppm, alors que les recommandations officielles françaises préconisent d'évacuer les locaux accueillant du public au-delà de 1 000 ppm.
Dans les salles de sport
Un cas particulier est celui des salles de sport où l'effort physique implique un besoin supplémentaire en oxygène et une augmentation du CO2 expiré par les joueurs (et les spectateurs). Par exemple, lors des matchs de hockey sur glace, le CO2 augmente de 92 à 262 ppm lors d'un match (surtout joué par des hommes adultes). Au centre de la patinoire, le taux de CO2 dépasse les 1000 ppm à chaque match (seuil max. recommandé par l'Institut norvégien de la santé publique). Les mesures in situ montrent qu'un joueur respire un air plus enrichi en CO2 que les spectateurs, et que le taux de CO2 descend durant les temps de repos et remonte durant le temps joué. La nuit après un match, dans une salle de hockey fermée, il faut près d'une dizaines d'heures pour retrouver un taux de CO2 bas (600 à 700 ppm), qui est encore au-dessus de la normale. En outre dans les pays froids, tempérés ou chauds, de nombreuses salles de sport sont climatisées ; pour des raisons d'économies d'énergie elles n'ont pas un renouvellement d'air extérieur constant ou suffisant. Durant un match de hockey sur glace, les femmes et les enfants émettent moins de CO2 que les hommes, mais dans une même salle, le degré d'augmentation du taux de CO2 dans l'air de la salle de sport est comparable, et dans tous les cas étudiés la pause entre deux matchs ne réduit pas la concentration en CO2 assez pour que le début de la deuxième période soit aussi faible que le début de la première. Quand le nombre de spectateurs augmente, le taux de CO2 dans la salle augmente plus encore. Le nombre d'ouvertures/fermetures de portes donnant sur l'extérieur influe aussi sur le renouvellement d'air et donc le taux de CO2 dans la salle de sport. Des études ont montré une diminution des performances cognitives et de décision ou d'apprentissage quand le CO2 augmente. Peu d'études ont porté sur l'effet de ce même CO2 sur les performances sportives d'un individu ou de son équipe.
Dans les logements
Il n'est pas réglementé dans l'air du domicile ; mais il doit être mesuré en tant qu'« indicateur de confinement et de la qualité du renouvellement de l'air » dans certains lieux confinés, sur la base de normes dont l'ANSES estime qu'elles n'ont pas de bases sanitaires.
Dans les bâtiments non résidentiels
En France, le règlement sanitaire départemental (RSD) recommande de ne pas passer le seuil de 1 000 ppm (partie par million) « dans des conditions normales d'occupation », avec une tolérance à 1 300 ppm dans les lieux où il est interdit de fumer (« sans fondement sanitaire explicite de ces deux valeurs » selon l'Anses.
Un décret du impose une surveillance de la qualité de l'air intérieur à certains établissements recevant du public sensible tel que les enfants ; il propose le calcul d'un « indice de confinement » dit « indice Icone » (proposé par le Centre scientifique et technique du bâtiment (CSTB) sur la base de la fréquence de dépassement des niveaux de CO2 par rapport à deux seuils de 1 000 et 1 700 ppm dans les salles de classe.
En milieu professionnel, la question de la sécurité et de la prévention liée aux risques d'intoxication au dioxyde de carbone est une préoccupation majeure pour limiter les risques d'accident du travail. Faute de données épidémiologiques, il n'a cependant pas été considéré comme pertinent en France comme indicateur de la qualité sanitaire de l'air intérieur par l'Anses qui ne prévoit pas de valeur guide de qualité d'air intérieur (VGAI) pour ce polluant.
Dans de fortes concentrations approchant les 50 à 100 %, telles que celles retrouvées dans les nappes de dioxyde de carbone d'origine artificielle en milieu professionnel, il peut se produire un effet de sidération nerveuse et une perte de conscience immédiate, suivie d'une mort rapide en l'absence d'aide extérieure. Ces accidents présentent un risque élevé de suraccident, des témoins pouvant se précipiter au secours de la victime sans penser à leur propre sécurité et devenir eux aussi victimes de l'intoxication.
CO2 dans l'atmosphère terrestre


La figure en encart détaille la chute saisonnière du CO2 durant la saison de végétation (d'avril à octobre) et son élévation en automne/hiver de l'hémisphère nord (la végétation terrestre est plus importante dans l'hémisphère nord).

Légende et sources :
* bleu clair : CO2 d'après les carottes de glace polaire, NOAA/ Law Dome ;
* bleu : CO2 à Mauna Loa, NOAA/Mauna Loa ; * rouge : température (°C), Unité de recherche climatique (Univ. East Anglia) ; * orange : taches solaires, Solar Influences Data Analysis Center (SIDC).

Le dioxyde de carbone n'est normalement présent dans l'atmosphère terrestre qu'à l'état de traces. Il est mesuré par un indice, nommé « Annual Greenhouse Gas Index » (AGGI) depuis 1979 par un réseau d'une centaine de stations sur terre et en mer, disposées de l'Arctique au pôle Sud.
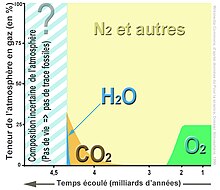
Depuis la révolution industrielle, en raison de la combustion constante de très grandes quantités de carbone fossile, alors que la régression des incendies, des forêts et des superficies végétalisées se poursuit, le taux de CO2 dans l'air augmente régulièrement (en , i vaut 415,13 ppm en volume, soit aussi 632,96 ppm en masse. Cela correspond à une masse totale de CO2 atmosphérique d'environ 3,258 × 1015 kg (environ trois mille gigatonnes)[réf. nécessaire]. Cette teneur était de 283,4 ppmv en 1839 d'après les carottes de glace prélevées dans la région du cap Poinsett dans l'Antarctique, soit une augmentation globale d'environ 42 % en 177 ans. Le taux de CO2 atmosphérique attendu à la fin du XXIe siècle est estimé entre 540 et 970 ppmv selon les simulations (modèle ISAM et modèle Bern-CC). L'année 1990 (qui correspond à un surplus d'environ 2,1 W/m2 par rapport à 1980) est l'année de référence retenue pour le protocole de Kyoto (elle a donc un « indice AGGI » de 1). Un groupe de recherche spécifique sur le cycle du carbone et les gaz à effet de serre a été mis en place.
La teneur en CO2 diffère entre les hémisphères, chacun connaissant des variations saisonnière régulières (voir le motif « en dents de scie » sur le graphique de droite, montrant une baisse de CO2 en saison de végétation et une augmentation en hiver). Apparaissent aussi des variations régionales, en particulier au niveau de la couche limite atmosphérique, c'est-à-dire dans les couches proches du sol.
Les taux de CO2 sont généralement plus élevés dans les zones urbaines et dans les habitations (jusqu'à dix fois le niveau de fond).
Peu après la formation de la Terre (bien avant l'apparition de la vie), alors que le Soleil était presque deux fois moins « chaud », la pression initiale de CO2 était environ 100 000 fois plus élevée qu'aujourd’hui (30 à 60 atmosphères de CO2 (soit 3 000 000 à 6 000 000 pascals), soit 100 000 fois la quantité actuelle de CO2 il y a environ 4,5 milliards d'années).
Puis la vie et la photosynthèse sont apparues, prélevant le CO2 de l'atmosphère et de l'eau pour le transformer en roches carbonatées et en charbon, pétrole et gaz naturel, en grande partie enfouis dans les profondeurs de la Terre. Le taux de CO2 a néanmoins encore connu quelques pics de bien moindre importance (vingt fois plus élevée qu'aujourd'hui il y a environ un demi milliard d'années, mais le Soleil était alors moins chaud qu'aujourd'hui (le rayonnement solaire croît avec le temps ; il a augmenté d'environ 40 % dans les quatre derniers milliards d'années). Le taux de CO2 a encore chuté de quatre à cinq fois durant le Jurassique, puis a diminué lentement, sauf, de manière accélérée durant un épisode géologiquement bref, dit « évènement Azolla » (il y a environ 49 millions d'années).
Le volcanisme émet aussi du CO2, qui représente jusqu'à 40 % des gaz émis par certains volcans lors des éruptions subaériennes, de même que certaines sources chaudes (par exemple sur le site italien de Bossoleto, près de Rapolano Terme, où dans une dépression en forme de cuvette d'environ 100 m de diamètre, par nuit calme, le taux de CO2 peut grimper de 75 % en quelques heures, assez pour tuer les insectes et petits animaux ; mais la masse de gaz se réchauffe rapidement quand le site est ensoleillé et est alors dispersée par les courants de convection de l'air durant la journée). Localement, des concentrations élevées de CO2, produites par la perturbation de l'eau d'un lac profond saturé en CO2 peuvent aussi tuer (exemple : 37 morts lors d'une éruption de CO2 à partir du lac Monoun au Cameroun en 1984 et 1 700 victimes autour du lac Nyos, au Cameroun également, en 1986.
Les émissions de CO2 par les activités humaines sont actuellement plus de 130 fois supérieures à la quantité émise par les volcans, atteignant près de 27 milliards de tonnes par an en 2007. En 2016, l’agence météorologique de l’ONU indique que la concentration de dioxyde de carbone a atteint un nouveau record historique, soit 403,3 ppm, et un record de température a été battu pour l'El Niño de 2017 selon l'OMM alors qu'à 405 ppm, le taux de CO2 de l'air n'a jamais été aussi élevé depuis environ 800 000 ans.
Les émissions mondiales de CO2 augmentent de 2,7 % en 2018, ce qui constitue la plus forte hausse en sept ans. Selon un rapport de 2019, les concentrations en CO2 ont atteint 407,8 ppm en 2018, un constat corrélé également à l'augmentation des concentrations de méthane (CH4) et de protoxyde d'azote (N2O).
Des thèses climatosceptiques réapparaissent sur les réseaux sociaux en 2023, s'appuyant sur le fait avéré que la teneur en CO2 de l'atmosphère est seulement de 0,04 % et sur l'affirmation erronée selon laquelle « l'activité humaine n'y contribue que pour 5 % » pour nier sa responsabilité dans l'effet de serre, contrairement au consensus scientifique.
Nutriment des végétaux
Un taux plus élevé de CO2 stimule la photosynthèse et la croissance des plantes, avec des avantages potentiels pour la productivité des cultures céréalières, première source alimentaire dans le monde pour les humains et les animaux d'élevage. Le carbone, tiré du dioxyde de carbone de l'air par les plantes autotrophes grâce au processus de la photosynthèse, ou tiré du carbone du sol, est effectivement l'un des principaux nutriments du réseau trophique. L'augmentation de la biomasse est l'un des effets des simulations d'expériences prédisant une augmentation de 5 à 20 % du rendement des cultures à 550 ppm de CO2. Il a été démontré que les taux de photosynthèse foliaire augmentent de 30 à 50 % dans les plantes C3 et de 10 à 25 % dans le C4 sous des niveaux de CO2 doublés.
À partir de 2010, un tableau plus complet se dessine, avec une différence significative des réponses observées pour différentes espèces végétales, les disponibilités en eau et la concentration d'ozone. Par exemple, le projet Horsham Free-air concentration enrichment (en) (FACE) 2007-2010 (utilisant des cultures de blé) à Victoria, en Australie, a constaté que « l'effet du CO2 était d'augmenter la biomasse des cultures à maturité de 20 % et la biomasse des racines de l'anthèse de 49 % ». Il a été constaté qu'une augmentation du dioxyde de carbone atmosphérique réduisait la consommation d'eau des plantes et, par conséquent, l'absorption d'azote, ce qui bénéficiait particulièrement aux rendements des cultures dans les régions arides.
Effets envisagés sur la valeur alimentaire des plantes
Cependant, si l'élévation du taux de CO2 atmosphérique dope effectivement la croissance (des céréales par exemple), pour des raisons encore mal comprises, elle diminue alors la valeur nutritionnelle des principales cultures de base (riz, blé et pomme-de-terre notamment), en diminuant leur taux de protéines, d'oligo-éléments et de vitamines du groupe B. En conditions expérimentales, le taux de CO2 augmenté (même non-combiné à une température augmentée) se traduit par un taux de sucres plus élevé dans les végétaux cultivés (source d'alcools de plus en plus forts pour le raisin), mais aussi par des carences en protéines et en minéraux. Le riz présente en outre souvent des concentrations élevées d'arsenic, que l'acidification des milieux peut aggraver. Enfin, des concentrations plus élevées de CO2 exacerbent l'acidification des eaux douces et l'acidification des océans, ce qui pourrait affecter la productivité des algues (et donc l'algoculture).
Pour cette raison, selon une étude récente (2018), dès 2015-2050, le taux anormalement élevé de CO2 de notre atmosphère pourrait dans le monde entraîner avant 2050 des maladies induites chez l'homme et certains animaux d'élevage (porcs, vaches, volailles) par des carences alimentaires. Dans une étude publiée dans un numéro spécial de PLOS Medicine sur le changement climatique et la santé, Christopher Weyant et ses collègues de l'université Stanford se sont concentrés sur deux micronutriments essentiels, le zinc et le fer. En tenant compte du dérèglement climatique et des habitudes alimentaires, ils montrent que le risque de maladie évoluera dans les 137 pays. Si rien n'est fait, l'augmentation du taux de CO2 diminuera le taux de zinc et de fer des aliments, coûtant environ 125,8 millions d'années de vie corrigées de l'incapacité (intervalle de confiance de 95 % [CrI] 113,6–138,9) dans le monde pour la période 2015–2050, en raison d'une augmentation des maladies infectieuses, des diarrhées et des cas d'anémie, tout particulièrement en Asie du Sud-Est et Afrique où la population est déjà très affectée par des carences en zinc et fer. Les enfants seraient particulièrement affectés, avec des risques de troubles irréversibles du développement liés à ces carences, transmissible sur plusieurs générations au moins pour des raisons épigénétiques.
L'étude de Weyant indiquerait aussi que l'inégalité nutritionnelle pourrait augmenter, et montrerait que les réponses traditionnelles de santé publique (dont la supplémentation en minéraux et vitamines, et le contrôle renforcé des maladies humaines et animales) pourraient ne pas suffire à endiguer le phénomène. En effet, de telles réponses ne permettraient de réduire que 26,6 % (95 % des IC 23,8–29,6) de ce fardeau sanitaire, humain et économique, tandis qu'une stratégie efficace de réduction des émissions de gaz à effet de serre, telle que proposée par l'Accord de Paris sur le climat, permettrait d'éviter jusqu'à 48,2 % (95% de l'indice CIF 47,8–48,5) de cette charge.
Bien que le CO2 nourrisse la croissance des plantes, son excès induit une dégradation de leur valeur alimentaire qui aura des conséquences globales pour toutes les créatures vivantes qui consomment des plantes, y compris l'homme. Les auteurs incitent à mieux étudier les effets de l'augmentation du CO2 atmosphérique sur d'autres composés d'origine végétale ayant des implications pour la santé humaine (ex : acides gras, vitamines, composés pharmacologiques, d'autant que cette étude n'a pas tenu compte d'autres conséquences de l'augmentation du CO2, sur les aléas météorologique et biologiques (déprédation accrue...) sur la sécurité alimentaire, l'accès aux aliments, leur usage et la stabilité des prix, ni les chaines de conséquences différées dans l'espace et le temps (effets à long terme de la dénutrition notamment).
Les rendements agricoles stagnent ou se dégradent dans une partie du monde, en raison notamment du réchauffement (vagues de chaleur...) et de régimes de précipitations modifiés. Les cultures vitales (blé et riz notamment) sont déjà affectées en zone tropicale et tempérée et des études prospectives laissent penser que les cultures de riz et de maïs pourrait décliner de 20 à 40 % rien qu'à cause des hausses de température prévues en zone tropicale et subtropicale d'ici à 2100, dans même prendre en compte les effets des évènements climatiques extrêmes. Ce contexte pourrait causer des hausses des prix des aliments, les rendant inabordable pour les plus pauvres, alors que la hausse des teneurs de l'air en CO2 pourrait aussi réduire la qualité nutritionnelle, des céréales notamment, importantes pour la santé humaine et, potentiellement, pour celle des animaux (également sources de lait et de viande (et donc de protéines), pendant qu'en mer la biomasse en poisson diminue aussi.
« On ignore encore si le déclin de la valeur nutritive des cultures vivrières induit par le CO2 est linéaire et si la qualité nutritionnelle a déjà baissé en raison de l'augmentation du CO2 depuis le début de la révolution industrielle. »
En complément des mesures d'adaptation au Changement climatique, les mesures de réduction des émissions de CO2 et piégeage biologique du CO2 restent urgemment nécessaires. Des cultivars moins sensibles aux déficits nutritionnels dans un climat qui se réchauffe sont à rechercher concluent les travaux de Weyant et ses collègues.
Les effets de l'augmentation du CO2 sur les plantes se montrent plus préoccupants que ce qui était prédit par les premiers modèles des années 1990 et du début des années 2000. Morgan et al., sur la base d'expériences de laboratoire et in situ, ont confirmé dès 2004 que dans les écosystèmes émergés, le CO2, même quand il améliore la productivité en termes de biomasse, peut néanmoins avoir des effets négatifs en modifiant la composition des espèces et en réduisant la digestibilité des graminées courtes par exemple dans la végétation steppique).
Gaz à effet de serre et acidifiant

Le CO2 est le deuxième gaz à effet de serre le plus important dans l'atmosphère après la vapeur d'eau, contribuant respectivement à hauteur de 26 % et 60 % à ce phénomène. La réalité du réchauffement climatique observé à l'échelle planétaire depuis le siècle dernier n'est aujourd'hui plus guère contestée d'un point de vue scientifique, mais la part exacte de responsabilité du dioxyde de carbone dans ce processus (par rapport au méthane notamment) doit encore être précisée, grâce aux enregistrements fossiles des paléoclimats notamment.
Par ailleurs, l'acidification des océans résultant de la dissolution du dioxyde de carbone atmosphérique pourrait compromettre la survie de nombreux organismes marins avant la fin du XXIe siècle, notamment tous ceux à exosquelette calcifié tels que les coraux et les coquillages, mais aussi de certains poissons.
Une réduction des émissions anthropiques est visée par le protocole de Kyōto ainsi que par la directive 2003/87/CE ; sa séquestration géologique à long terme fait l'objet de recherches mais est une solution controversée quand il s'agit simplement d'injecter du CO2 dans les couches géologiques.
Effets écosystémiques de l'augmentation du taux de CO2 dans l'eau et dans l'air
Dans l'eau
Le CO2 a un certain effet eutrophisant (c'est un nutriment de base, essentiel pour les plantes), mais il est aussi un facteur d'acidification des océans et de certaines masses d'eau douce, qui peut négativement interférer avec de nombreuses espèces (dont certaines microalgues et autres microorganismes aquatiques protégées par des structures calcaires que l'acide carbonique peut dissoudre). L'acidification favorise aussi la libération et la circulation et donc la biodisponibiltié de la plupart des métaux lourds, métalloïdes ou radionucléides (naturellement présent dans les sédiments ou d'origine anthropique depuis la révolution industrielle surtout).
Dans l'air
L'augmentation de la teneur de l'atmosphère en CO2 peut aussi avoir des effets différenciés voire antagonistes selon son taux, le contexte environnemental et biogéographique et selon des données plus récentes selon la saison et les variations saisonnières de la pluviométrie (au-dessus des forêts notamment) ;
Il existe chez les écologues associés à l'étude des effets du changement climatique un consensus sur le fait qu'au-delà d'une augmentation de 2 °C en un siècle, les écosystèmes terrestres et marins seront sérieusement négativement affectés.
En 2013, la réponse réelle des écosystèmes au CO2 et ses modulations biogéographiques sont encore considérées comme complexes et à mieux comprendre, en raison de nombreux « feedbacks biogéochimiques ». Elle doit être néanmoins élucidée si l'on veut correctement évaluer voire prédire les capacités planétaires ou locales des écosystèmes en termes de stockage naturel du carbone et d'amortissement des effets du dérèglement climatique induit par l'Homme.
Les rétroactions médiés par le cycle hydrologique sont particulièrement importantes et la pluviométrie y joue un rôle majeur. La physiologie des plantes a au moins un rôle bien connu ; jusqu'à un certain stade (au-delà duquel la plante dépérit), l'augmentation du taux de CO2 de l'air réduit la conductance stomatique et augmente l'efficacité d'utilisation de l'eau par les plantes (la quantité d'eau nécessaire pour produire une unité de matière sèche), la diminution de l'utilisation de l'eau se traduisant par une plus grande disponibilité de l'humidité du sol. Il a été estimé, en 2008, que les effets de l'augmentation du CO2 dans l'air sur l'écosystème devraient être exacerbés quand l'eau est un facteur limitant (mais les apports d'azote sont aussi à prendre en compte) ; ceci a été démontré par quelques expériences, mais est un facteur qui a été « oublié » par de nombreuses études.
Cette relation semble si forte qu'elle permet — en zone tempérée — de prédire avec précision les variations annuelles de la stimulation de la biomasse aérienne à la suite de l'élévation du taux de CO2 dans une prairie mixte contenant des végétaux de type C3 et C4, sur la base du total des précipitations saisonnières ; les pluies d'été ayant un effet positif, alors que celles d'automne et du printemps ont des effets négatifs sur la réponse au CO2. L'effet du taux croissant de CO2 dépendra donc principalement des nouveaux équilibres ou déséquilibres qui s'établiront entre les précipitations estivales et d'automne / printemps.
Le lien à l'azote (autre élément perturbé par les activités humaines dont l'agriculture industrielle, l'industrie et les émissions de la circulation automobile) est ici retrouvé : de fortes précipitations en saisons froides et humides conduisent à limiter l'accès des plantes terrestres à l'azote et, de ce fait, réduisent ou interdisent la stimulation de la biomasse par un taux de CO2 élevé. Cette prédiction valait aussi pour des parcelles « réchauffées » de 2 °C ou non-réchauffées, et était similaire pour les plantes en C3 et de la biomasse totale, ce qui semble permettre aux prospectivistes de faire des prévisions robustes sur les réponses aux concentrations élevées de CO2 de l'écosystème. Ceci est un atout précieux car les projections climatiques des modèles à haute résolution confirment la très forte probabilité de changements importants dans la répartition annuelle des pluies, même là où la quantité annuelle totale de pluie tombée au sol ne changera pas. Ces données, scientifiquement confirmées en 2013, devraient aider à expliquer certaines différences apparues dans les résultats des expériences sur l'exposition de plantes à un taux accru de CO2 et améliorer l'efficacité prospective des modèles qui ne tenaient pas assez compte des effets saisonniers des précipitations sur les réponses de la biodiversité au CO2 14, notamment en milieux forestiers.
Réduction du taux de CO2 dans l'atmosphère
Plusieurs voies sont explorées ou mises en œuvre pour limiter l'accumulation du CO2 dans l'atmosphère. Elles peuvent faire appel à des processus naturels comme la photosynthèse ou à des procédés industriels. Il faut également distinguer la capture à la source de la capture dans l'atmosphère.
La startup indienne Carbon Clean Solutions (CCSL) a lancé sa première installation, qui capte et réutilise à 100 % les émissions de CO2 (60 000 tonnes par an) d'une petite centrale au charbon en Inde, à Chennai (Madras) ; ce CO2 est purifié, puis revendu à un industriel local, qui l'utilise pour fabriquer de la soude. La technologie de CCSL ramène le coût de revient du CO2 vendu à 30 dollars la tonne en Inde et à 40 dollars en Europe ou aux États-Unis, très en dessous du prix du marché : 70 à 150 dollars la tonne. Veolia a signé avec CCSL un contrat pour commercialiser ce procédé à l'international. En parallèle, l'entreprise Climeworks cherche à capturer le CO2 en filtrant l’air ambiant.
La société canadienne Carbon Engineering, fondée par l'ingénieur David Keith et financée par Bill Gates et plusieurs entreprises pétrolières et minières, a développé un réacteur qui extrait le CO2 de l'atmosphère à un coût inférieur à celui des technologies de capture existantes. Les fonds apportés par les investisseurs seront employés à combiner ce procédé de capture directe avec un procédé « Air to fuels » permettant de transformer le carbone récupéré dans l’atmosphère en un carburant similaire à l'essence. Elle envisage la construction d'une importante usine à Houston en partenariat avec Occidental Petroleum. Cependant, les réacteurs capteurs de CO2 sont très énergivores et doivent donc être alimentés par des sources d’énergie renouvelable ; le Conseil scientifique des Académies des sciences européennes (EASAC) émet des réserves : selon lui, l’élimination du CO2 dans l’air n’empêchera pas le changement climatique et n’est, à ce jour, pas à la hauteur des recommandations du GIEC.
Vers une production de « méthane solaire » à partir de CO2 ?.
En théorie, transformer du CO2 en carburant ou en matières premières chimiques permettrait de diminuer l'utilisation de combustibles fossiles et de réduire les émissions de CO2.
La conversion électrochimique à partir de sources d'électricité renouvelable est une piste qui fait l'objet de nombreux travaux de recherche depuis les années 2010.
Un espoir, reposant sur la photochimie, est de pouvoir n'utiliser que la lumière du soleil et des catalyseurs non polluants, peu coûteux et abondants sur Terre. Parmi les photocatalyseurs et les électrocatalyseurs moléculaires évoqués par la littérature scientifique des années 2010, seuls quelques-uns sont stables et sélectifs pour la réduction du CO2 ; de plus ils produisent principalement du CO ou du HCOO, et les catalyseurs capables de générer des rendements même faibles à modérés en hydrocarbures fortement réduits restent rares.
Quatre chercheurs, dont deux français (Julien Bonin & Marc Robert) ont produit un catalyseur qui est un complexe de tétraphénylporphyrine de fer fonctionnalisée avec des groupes triméthylammonium, qu'ils présentent comme étant (au moment de la publication) l'électrocatalyseur moléculaire le plus efficace et le plus sélectif pour convertir le CO2 en CO car pouvant catalyser la réduction de huit électrons du CO2 en méthane sous simple lumière, à température et pression ambiantes. Le catalyseur doit cependant être utilisé dans une solution d’acétonitrile contenant un photosensibilisateur et un donneur d’électrons sacrificiel, il fonctionne alors de manière stable durant quelques jours. Le CO2 est d’abord principalement transformé en CO par photoréduction et s’il y a deux réacteurs CO génère ensuite du méthane avec une sélectivité atteignant 82 % et avec un rendement quantique, c'est-à-dire une efficacité de la lumière, de 0,18 %). Les auteurs estiment que d'autres catalyseurs moléculaires pourraient s’en inspirer.
Des systèmes de « co-catalyse » sont aussi envisagés, de catalyseurs moléculaires, ainsi que des systèmes à base de pérovskite, ou de complexes de métaux de transition.
Voir aussi
Bibliographie
- Gérard Borvon, Histoire du carbone et du CO2. De l’origine de la vie jusqu’au dérèglement climatique, Vuibert, 2013, 256 p.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :