
Daclatasvir
| Daclatasvir | |
| |
| Daclatasvir | |
| Identification | |
|---|---|
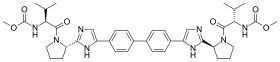
| Nom UICPA | [(2S)-1-{(2S)-2-[4-(4’-{2-[(2S)-1-{(2S) -2-[(méthoxycarbonyl)amino] -3-méthylbutanoyl}-2-pyrrolidinyl]-1H-imidazol-4-yl}-4-biphénylyl) -1H-imidazol-2-yl]-1-pyrrolidinyl}-3-méthyl-1-oxo-2-butanyl]carbamate de méthyle |
| Synonymes |
BMS-790052 |
| No CAS | 1009119-64-5 |
| Code ATC | J05AX14 |
| SMILES | |
| InChI |
InChI : vue 3D InChI=1/C40H50N8O6/c1-23(2)33(45-39(51)53-5)37(49)47-19-7-9-31(47)35-41-21-29(43-35)27-15-11-25(12-16-27)26-13-17-28(18-14-26)30-22-42-36(44-30)32-10-8-20-48(32)38(50)34(24(3)4)46-40(52)54-6/h11-18,21-24,31-34H,7-10,19-20H2,1-6H3,(H,41,43)(H,42,44)(H,45,51)(H,46,52)/t31-,32-,33-,34-/m0/s1 InChIKey : FKRSSPOQAMALKA-CUPIEXAXBX Std. InChI : vue 3D InChI=1S/C40H50N8O6/c1-23(2)33(45-39(51)53-5)37(49)47-19-7-9-31(47)35-41-21-29(43-35)27-15-11-25(12-16-27)26-13-17-28(18-14-26)30-22-42-36(44-30)32-10-8-20-48(32)38(50)34(24(3)4)46-40(52)54-6/h11-18,21-24,31-34H,7-10,19-20H2,1-6H3,(H,41,43)(H,42,44)(H,45,51)(H,46,52)/t31-,32-,33-,34-/m0/s1 Std. InChIKey : FKRSSPOQAMALKA-CUPIEXAXSA-N |
| Propriétés chimiques | |
| Formule |
C40H50N8O6 [Isomères] |
| Masse molaire | 738,875 ± 0,038 9 g/mol C 65,02 %, H 6,82 %, N 15,17 %, O 12,99 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
|
modifier |
|
Le daclatasvir (nom de code BMS-790052) est un principe actif en expérimentation pour le traitement de l'hépatite C.
Il a été développé par la compagnie pharmaceutique Bristol-Myers Squibb sous le nom commercial de Daklinza.
Mode d'action
Le daclatasvir est le premier inhibiteur de la protéine non-structurale 5A (NS5A) du virus de l'hépatite C. Des recherches récentes suggèrent que le daclatasvir cible deux étapes du processus de réplication virale, ce qui permet une diminution rapide de l'ARN du VHC.
Il a été testé en association avec l'interféron pégylé et la ribavirine ainsi qu'avec d'autres agents antiviraux d'action directe tels que l'asunaprévir, le sofosbuvir ainsi qu'en combinaison avec l'asunaprévir et le beclabuvir (en).
Mise sur le marché
Le , le comité des médicaments à usage humain (CHMP) de l’Agence européenne du médicament (EMA) a rendu un avis favorable pour le daclatasvir dans le traitement de l’hépatite C chronique chez les adultes.
En France, le daclatasvir peut être utilisé dans le cadre d’une autorisation temporaire d'utilisation (ATU) depuis mars 2014.
Indications
Il est indiqué pour le traitement de patients adultes atteints d’infection virale C chronique :
- présentant une maladie à un stade avancé (avec fibrose hépatique F3/F4 ou présentant des manifestations extra-hépatiques du VHC) et pour lesquels il n’existe pas d’alternatives thérapeutiques appropriées ;
- sur liste d’attente pour une transplantation hépatique ou rénale ;
- ayant subi une transplantation hépatique et présentant une récurrence de l’infection par le virus de l’hépatite C.
Effets secondaires
Le , des cas d’arythmies cardiaques ont été portés à la connaissance du Comité d'évaluation des risques en pharmacovigilance (PRAC) de l’Agence européenne des médicaments (EMA) lors de l’association de daclatasvir avec le sofosbuvir chez des patients ayant des facteurs favorisants tels que la prise de médicaments bradycardisants — notamment l’amiodarone — ou des antécédents cardiaques. Des cas d’arythmies ont également été rapportés sous sofosbuvir en dehors de l’association avec daclatasvir.