
Chlorure de benzyle
| Chlorure de benzyle | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | chlorométhylbenzène | ||
| Synonymes |
α-chlorotoluène |
||
| No CAS | 100-44-7 | ||
| NoECHA | 100.002.594 | ||
| No CE | 202-853-6 | ||
| PubChem | 7503 | ||
| ChEBI | 615597 | ||
| SMILES | |||
| InChI |
|
||
| Apparence | Liquide incolore et odeur piquante | ||
| Propriétés chimiques | |||
| Formule |
C7H7Cl [Isomères] |
||
| Masse molaire | 126,583 ± 0,008 g/mol C 66,42 %, H 5,57 %, Cl 28,01 %, |
||
| Propriétés physiques | |||
| T° fusion | −39 °C | ||
| T° ébullition | 179 °C | ||
| Solubilité | 0,46 g·l-1 (eau,30 °C) | ||
| Masse volumique | 1,1 g·cm-3 à 20 °C | ||
| T° d'auto-inflammation | 585 °C | ||
| Point d’éclair | 60 °C | ||
| Limites d’explosivité dans l’air | 1,1–14 %vol | ||
| Pression de vapeur saturante |
0,12 kPa à 20 °C 0,99 kPa à 50 °C 7,96 kPa à 100 °C 23,4 kPa à 130 °C |
||
| Viscosité dynamique | 1,289 mPa·s à 25 °C | ||
| Thermochimie | |||
| ΔfH0gaz | 19 kJ·mol-1 | ||
| ΔfH0liquide | −33 kJ·mol-1 | ||
| ΔvapH° | 51. kJ·mol-1 | ||
| Cp | 182,4 J·K-1·mol-1 (liquide,25,35 °C) | ||
| PCI | −3 708 kJ·mol-1 | ||
| Précautions | |||
| NFPA 704 | |||
| Directive 67/548/EEC | |||
|
Numéro index : 602-037-00-3 Classification : Carc. Cat. 2; R45 - T; R23 - Xn; R22-48/22 - Xi; R37/38-41 Symboles : T : Toxique Phrases R : R22 : Nocif en cas d’ingestion. R23 : Toxique par inhalation. R41 : Risque de lésions oculaires graves. R45 : Peut provoquer le cancer. R37/38 : Irritant pour les voies respiratoires et la peau. R48/22 : Nocif : risque d’effets graves pour la santé en cas d’exposition prolongée par ingestion. Phrases S : S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette). S53 : Éviter l’exposition - se procurer des instructions spéciales avant l’utilisation. |
|||
| Transport | |||
Code Kemler : 68 : matière toxique et corrosive Numéro ONU : 1738 : CHLORURE DE BENZYLE Classe : 6.1 Étiquettes :  6.1 : Matières toxiques  8 : Matières corrosives Emballage : Groupe d'emballage II : matières moyennement dangereuses ; |
|||
| Écotoxicologie | |||
| DL50 |
1,5 g·kg-1 (souris, oral) 1,231 g·kg-1 (rat, oral) 1 g·kg-1 (rat, s.c.) |
||
| LogP | 2,3 | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
|
modifier |
|||
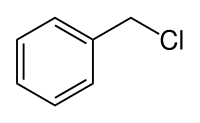
Le chlorure de benzyle est un halogénure aromatique de formule C6H5CH2Cl.
Utilisation
Le chlorure de benzyle est un intermédiaire dans la fabrication de nombreux composés notamment les additifs pour plastique (benzylbutylphtalate), la synthèse de l'acide phénylacétique, de l'alcool benzylique, du disulfure de benzyle (antioxydant), de désinfectants, d'esters de benzyle (benzoate de benzyle,acétate de benzyle) utilisés dans l'industrie des arômes et des parfums.
Propriétés physico-chimiques
Le chlorure de benzyle irrite les muqueuses et les yeux, ce qui en fait un excellent lacrymogène.
Production et synthèse
Les premières préparations de ce composé utilisaient l'alcool benzylique et de l'acide chlorhydrique comme réactifs et furent découvertes par Stanislao Cannizzaro.
Actuellement, le chlorure de benzyle est produit à partir du toluène et de chlore par activation radicalaire. La formation de radicaux peut se faire via l'ajout d'AIBN, de peroxyde de benzoyle ou d'hexaphényléthane. Ces substances étant consommées par la réaction, il faut continuellement en ajouter. C'est pourquoi l'utilisation de l'ultraviolet est préférée (longueur d'onde: 300–500 nm). On peut encore provoquer la scission des molécules de chlore par l'élévation de la température (à partir de 100 à 200 °C, on constate la présence de radicaux de chlore).
Un des principaux problèmes de cette voie de synthèse est la chloration successive du toluène. Pour éviter une séparation des différents produits chlorés, il faut éviter de chlorer plus de 40 % du toluène. Ceci conduit à une séparation du toluène par distillation assez coûteuse au vu de la quantité de toluène. Une autre méthode de production sélective est la distillation réactive, où la chloration a lieu dans une colonne dans des conditions de température et de pression permettant de garder le toluène sous forme gazeuse et où le chlorure de benzyle est liquide. Ce procédé est toutefois très dangereux, car proche de la température d'auto-inflammation du toluène dans le chlore qui est de 185 °C et parce que les mélanges toluène-chlore et chlorure de benzyle-chlore sont explosifs.
Le procédé actuel de synthèse produit un mélange de chlorure de benzyle et de dichlorométhylbenzène de manière à consommer le maximum de toluène tout en évitant de chlorer davantage le toluène.

