Aziridine
| Aziridine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | aziridine | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes |
azacyclopropane |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 151-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NoECHA | 100.005.268 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 205-793-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 9033 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 30969 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | liquide huileux incolore et clair | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule |
C2H5N [Isomères] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire | 43,067 8 ± 0,002 2 g/mol C 55,78 %, H 11,7 %, N 32,52 %, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moment dipolaire | 1,90 ± 0,01 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −78 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 56 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 0,832 1 g·cm-3 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 320 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | −13 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air |
3,6–46 %vol 64–820 g·cm-3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante |
213 mbar à 20 °C 333 mbar à 30 °C 780 mbar à 50 °C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ΔfH0liquide | 91,9 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp |
équation :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | −1 591,36 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   B2, D1A, D2A, E, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Directive 67/548/EEC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Numéro index : 613-001-00-1 Classification : F; R11 - Carc. Cat. 2; R45 - Muta. Cat. 2; R46 - T+; R26/27/28 - C; R34 - N; R51-53 Symboles : T+ : Très toxique F : Facilement inflammable N : Dangereux pour l’environnement Phrases R : R11 : Facilement inflammable. R34 : Provoque des brûlures. R45 : Peut provoquer le cancer. R46 : Peut provoquer des altérations génétiques héréditaires. R26/27/28 : Très toxique par inhalation, par contact avec la peau et par ingestion. R51/53 : Toxique pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l’environnement aquatique. Phrases S : S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette). S53 : Éviter l’exposition - se procurer des instructions spéciales avant l’utilisation. S61 : Éviter le rejet dans l’environnement. Consulter les instructions spéciales/la fiche de données de sécurité. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 663 : matière très toxique et inflammable (point d'éclair égal ou inférieur à 60 °C) Numéro ONU : 1185 : ÉTHYLÈNEIMINE STABILISÉE Classe : 6.1 Étiquettes :  6.1 : Matières toxiques  3 : Liquides inflammables Emballage : Groupe d'emballage I : matières très dangereuses ; |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 2B : Peut-être cancérogène pour l'homme | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL50 |
15 mg·kg-1 (rat, oral) 3,5 mg·kg-1 (rat, i.p.) 4 mg·kg-1 (souris, i.p.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'aziridine (n.f.) ou azacyclopropane est le composé organique cyclique de formule brute C2H5N. Elle est aussi le composé parent des aziridines et du groupe fonctionnel qui correspond à un hétérocycle à trois côtés composé d'une amine et de deux groupes méthylène.
Production et synthèse
Les aziridines peuvent être préparées en chimie organique de nombreuses façons.
Cyclisation d'haloamines et d'amino-alcools
Un groupe amine peut déplacer un halogénure adjacent (en β) dans une réaction de substitution nucléophile intramoléculaire pour former une aziridine. Les amino-alcools ont la même réactivité mais il faut tout d'abord convertir les groupes hydroxyde en meilleurs groupes partants, par exemple en tosylate. La cyclisation d'un amino-alcool est appelé synthèse de Wenker (en) (1935) et une d'haloamine, la éthylènimine-méthode de Gabriel (1888)
Addition de nitrène
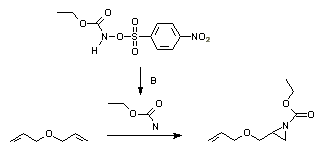
L'addition d'un nitrène sur un alcène est une méthode bien établie pour la synthèse des aziridines. Photolyses ou thermolyses d'azotures sont une bonne voie pour générer des nitrènes. Ceux-ci peuvent aussi être générés in-situ du diacétate d'iodobenzène et des sulfamidés ou sulfamates, ou de l'éthoxycarbonylnitrène d'un N-sulfonyloxy précurseur:
Décomposition de triazolines
Sous traitement thermique ou par photolyse d'une triazoline, de l'azote est expulsé et reste une aziridine. La triazoline requise est obtenue d'une réaction de cycloaddition d'un azoture sur un alcène.
Via l'ouverture d'un époxyde
Une méthode consiste en une réaction d'ouverture de cycle d'un époxyde avec l'azoture de sodium suivie d'une réduction organique de l'azoture obtenu avec la triphénylphosphine par expulsion d'azote gazeux:
Une autre méthode consiste en la réaction d'ouverture d'un époxyde par une amine suivie de la refermeture du cycle par une réaction de Mitsunobu.
Réaction d'un oxime avec un réactif de Grignard
L'éthylènimine synthèse de Hoch-Campbell décrit la synthèse d'aziridines par la réaction de certains oximes avec des réactifs de Grignard:
Caractéristiques physico-chimiques
Structure
Les angles des liaisons dans l'aziridine sont autour de 60 ° ce qui considérablement moins que l'angle de 109,5 ° normalement trouvé dans les hydrocarbures ou les amines linéaires et non contraints. Ces angles sont cependant comparables à ceux trouvés dans les cycles cyclopropane ou oxirane et correspondent aux mêmes contraintes angulaires dans le cycle : les liaisons dans ce type de cycle peuvent être expliquées en invoquant un modèle de liaison banane. L'aziridine est moins basique qu'une amine acyclique et aliphatique avec un pKa de 7.9 pour l'acide conjugué ce qui est dû à un accroissement du caractère s dans la paire libre de l'azote. Les contraintes angulaires accrues dans l'aziridine sont aussi responsables de l'accroissement de la barrière d'énergie pour l'inversion de l'azote. Cette barrière est suffisamment haute dans les aziridines pour pouvoir séparer des invertomères comme les invertomères cis et trans de la N-chloro-2-méthylaziridine.
Réactions
Ouverture de cycle nucléophilique
Les aziridines sont des substrats sensibles aux réactions d'ouverture de cycle avec beaucoup de nucléophiles à cause des contraintes moléculaires dans le cycle. Alcoolyses et ammonialyses sont typiquement les réactions inverses des cyclisations. D'autres nucléophiles efficaces sont les carbones nucléophiles comme dans les réactifs organolithiens ou les organocuprates comme le réactif de Gilman.
Une application importante d'une réaction d'ouverture de cycle en synthèse asymétrique est celle avec le triméthylsilylazoture TMSN3 et un ligand asymétrique:
Le catalyseur est construit sur l'yttrium et trois substituants isopropyloxy, le ligand est une phosphine oxyde. Avec un excès énantiomérique de 91 % ee, cette réaction permet une synthèse totale de l'oseltamivir (Tamiflu).
Autres réactions
Les aziridines non N-substituées peuvent être ouvertes par des alcènes en présence d'un acide de Lewis fort comme B(C6F5)3 Certaines aziridines N-substituées et avec des groupes attracteurs d'électron sur les deux atomes de carbone forment des azométhine ylures par une réaction électrocyclique (en) d'ouverture de cycle. Ces ylures peuvent être piégés avec un dipolarophile idoine par une cycloaddition 1,3-dipolaire.
Sécurité
La toxicologie de chaque aziridine spécifique dépend de sa propre structure et activité qui participe des caractéristiques générales du groupe des aziridines. Étant électrophile, les aziridines sont susceptibles d'attaquer et de voir leur cycle ouvert par des nucléophiles endogènes tels que les bases nucléiques de l'ADN ce qui correspond à un potentiel mutagène, et peut également induire dans certains cas une activité antitumorale.
Ainsi inhalation et contact direct avec les aziridines sont proscrits. Certains rapports notent que même des gants utilisés normalement en chimie ne préviennent pas l'infiltration cutanée des aziridines. Il est donc important que les utilisateurs vérifient les temps d'imprégnation des gants et fassent scrupuleusement attention au fait d'éviter la contamination lors du retrait des gants.
L'Agence internationale de recherche sur le cancer (IARC=International Agency for Research on Cancer) a passé en revue les composés aziridines et les a classés comme carcinogène humain possible (Group 2B). En procédant à une évaluation globale, le groupe de travail IARC a pris en considération le fait que les aziridines sont des agents alkylants directs qui sont mutagènes dans une large gamme de systèmes d'essai et forment des adduits d'ADN qui sont promutagènes.
Les aziridines provoquent des effets irritants sur les muqueuses telles les yeux, le nez, le système respiratoire et même la peau. Les aziridines pénètrent rapidement à travers la peau en cas de contact. Elles peuvent causer des dermatoses allergiques et de l'urticaire ou donner un asthme occupationnel.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Aziridine » (voir la liste des auteurs).
Lien externe
- Désymétrisation d'aziridines méso en particulier à partir de 1.2.