Acide gras synthase
Подписчиков: 0, рейтинг: 0
| Acide gras synthase | ||
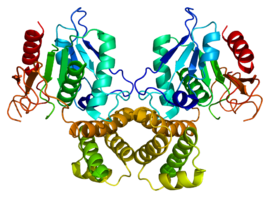 FAS I humaine (PDB 1XKT) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | FASN | |
| N° EC | 2.3.1.85 | |
| Homo sapiens | ||
| Locus | 17q25.3 | |
| Masse moléculaire | 273 427 Da | |
| Nombre de résidus | 2 511 acides aminés | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Acide gras synthase
| N° EC | EC 2.3.1.85 |
|---|---|
| N° CAS | 9045-77-6 |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
L'acide gras synthase (FAS, de l'anglais fatty acid synthase) est une enzyme, codée chez l'Humain par le gène FASN, ou un système d'enzymes qui réalise la biosynthèse des acides gras linéaires saturés par des condensations de Claisen successives d'unités malonyl-CoA sur de l'acétyl-CoA jusqu'à obtention de l'acide palmitique :
-
Acétyl-CoA + n malonyl-CoA + 2n NADPH+H+
acide gras en C2(n + 1) + (n + 1) coenzyme A + n CO2 + 2n NADP+.
On connaît essentiellement deux types d'acide gras synthases :
- La FAS I est une macrosynthase multifonctionnelle homodimérique, c'est-à-dire un dimère de deux grandes sous-unités identiques — de 272 kDa chacune chez l'Humain — possédant plusieurs sites actifs, les substrats demeurant liés à un domaine acyl carrier protein (ACP) de cette enzyme pour être transférés d'un domaine fonctionnel à l'autre au cours de l'assemblage de l'acide palmitique. La FAS I est commune aux mammifères et aux mycètes — bien que l'arrangement structurel de ces systèmes diffère entre ces deux groupes — ainsi qu'aux bactéries des genres Corynebacterium, Mycobacterium et Nocardia ; chez ces bactéries, la FAS I produit de l'acide palmitique et des enzymes de la FAS II produisent tout une variété d'autres lipides.
- La FAS II des bactéries est constituée d'enzymes dissociées qui sont chacune monofonctionnelles ; les inhibiteurs de ce système d'enzymes sont étudiés comme antibiotiques potentiels. Le fonctionnement de l'acide gras synthase d'E. coli a été particulièrement étudié et entièrement élucidé. Ce complexe regroupe :
- deux domaines fonctionnels d'activation de l'amorce d'acétyl-CoA et de l'unité malonyl-CoA à condenser sur l'acide gras en cours d'assemblage,
- un domaine fonctionnel réalisant la condensation de Claisen de la malonyl-CoA avec l'acide gras en cours d'assemblage,
- trois domaines fonctionnels assurant la réduction du groupe céto >C=O du carbone bêta en atome de carbone saturé >CH2 : cétoréductase (KR), déshydratase (DH) et énoyl réductase (ER),
- une thioestérase (TE) qui hydrolyse la liaison thioester de l'ACP avec l'acide gras en cours de synthèse lorsque ce dernier atteint 16 atomes de carbone, correspondant l'acide palmitique.
Ces réactions et les enzymes correspondantes sont résumées dans le schéma et le tableau ci-dessous :
| Étape | Réaction | Enzyme & N° EC | Description |
|---|---|---|---|
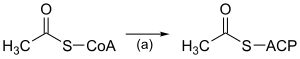
| (a) |
ACP S-acétyltransférase EC 2.3.1.38 |
Active l'acétyl-CoA en vue de la réaction avec la malonyl-ACP. | |
| (b) |
ACP S-malonyltransférase EC 2.3.1.39 |
Active la malonyl-CoA en vue de la condensation sur l'acétyl-ACP ou sur la chaîne d'acide gras linéaire saturé en cours de synthèse. |
|
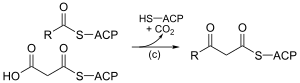
| (c) |
3-cétoacyl-ACP synthase EC 2.3.1.41 |
Réaction de la malonyl-ACP avec l'amorce d'acétyl-ACP ou l'extrémité de la chaîne hydrocarbonée en cours d'assemblage. |
|
| (d) |
3-cétoacyl-ACP réductase EC 1.1.1.100 |
Réduit le groupe cétone du carbone 3 en hydroxyle. | |
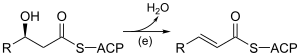
| (e) |
3-hydroxyacyl-ACP déshydratase EC 4.2.1.59 |
Introduit une double liaison trans-Δ2 par déshydratation. | |
| (f) |
Énoyl-ACP réductase EC 1.3.1.9 |
Réduit la double liaison entre les atomes de carbone 2 et 3. |
Ne pas confondre
FAS, ligands et récepteurs impliqués dans l'apoptose